双指示剂法测定混合碱样的含量
喻长军


摘 要: 使用双指示剂测定混合碱含量,是根据两个终点消耗的盐酸的体积计算混合碱中的组分与含量,利用溶液化学计量点时颜色的明显变化,判断其滴定终点,整个操作经济实用,步骤简单快捷,测定结果较准确,使用较广泛。
关键词: 双指示剂 混合碱 含量测定
1.引言
本文是测定混合碱的含量,而目前测定混合碱的方法有很多种,如Bacl■法、混合指示剂法、自动电位滴定等,本实验采用的是双指示剂测定混合碱的含量。用双指示剂测定碱含量操作简单,使用仪器在实验室中常见,整个实验不需要过多开销就能得到需要的准确数据。所谓双指示剂是分别以酚酞和甲基橙为指示剂,在同一溶液中用盐酸标准溶液作滴定剂进行连续滴定。根据两个终点消耗的盐酸标准溶液滴定的体积,计算混合碱中各组分的含量,下面是对测定混合碱的具体分析与讨论。
2.实验部分
2.1实验原理
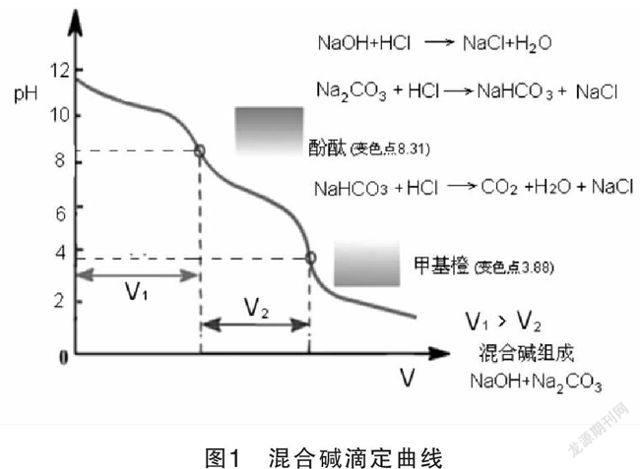
混合碱是Na■CO■与NaOH或Na■CO■与NaHCO■的混合物,可采用双指示剂法进行分析,测定各组分的含量。
在混合碱的试液中加入酚酞指示剂用HCL标准溶液滴定至溶液呈微红色,此时试液中所含NaOH完全被中和。Na■CO■也被滴定成NaHCO■,此时是第一个化学计量点,pH=8.31反应方程式如下:
NaOH+HCl=NaCl+H■O
Na■CO■+HCl=NaHCO■+NaCl
设滴定体积V■ml,再加入甲基橙指示剂,继续用HCL标准溶液滴定至溶液由黄色变为橙色即为终点,此时NaHCO■被中和成H■CO■,此时是第二个化学计量点,pH=3.88反应方程式如下:
NaHCO■+HCl=NaCl+H■O+CO■
设此时消耗HCl标准溶液的体积为V■ml,根据V■和V■可以判断出混合碱的组成。
当V■>V■时,试液Na■CO■与NaOH的混合物。
当V■ 2.1.1实验仪器 电子天平,酸式滴定管,锥形瓶,烧杯(500ml),容量瓶(250ml),移液管(25ml),试剂瓶,洗耳球,洗瓶。 2.1.2实验试剂 酚酞(1%酚酞的酒精溶液,溶解1G酚酞于90ML乙醇及10ML水中),甲基橙(0.1%甲基橙的水溶液,溶解1G甲基橙于1000ML热水中),Na■CO■基准物质,混合碱,HCL(12MOL/L)。 2.2实验步骤 2.2.10.1mol/LHCl标准溶液的配制; 量取4.5mlHCl(12mol/L),倒入500ml烧杯中,加入300ml蒸馏水摇匀再稀释至500ml,移入试剂瓶中,继续摇匀,贴上标签待标定。 2.2.20.1mol/LHCl溶液浓度的标定; 在分析天平上准确称取基准物Na■CO■.15g~0.2g于锥形瓶中,加25ml水使其溶解。加甲基橙指示剂2滴,用待标定的HCL滴定至溶液由黄色变为橙黄色即为指示终点(近终点时剧烈摇动,或加热至沸,使CO■分解)。记下消耗溶液的体积,计算HCL标准溶液的准确浓度CHCI,计算公式如下(另做一份空白实验,数据见表1): CHCI=2mNa■CO■/(MNa■CO■×vHCI×10■■) 2.2.3混合碱样的测定 在分析天平上准确称取0.15g~0.2g于锥形瓶中,加入少量水使其溶解,定量转移至500ml的容量瓶中,加水稀释至刻度线,摇匀。用25.00ml移液管移取25.00ml溶液于锥形瓶中,加2~3滴酚酞,以HCl标准溶液滴定至红色变微红色,为第一终点,记下HCl标准溶液体积V■,再加入2滴甲基橙,继续用HCl标准溶液滴定,液体由黄色恰变橙色,为第二终点,记下HCl标准溶液体积V■。平行测定三次。根据V■,V■的大小判断混合物的组成,并计算各组分的含量(数据见表二),计算公式如下(另做一份空白实验,数据见表2,滴定曲线见图1): 当V■>V■时,试液为NaOH和Na■CO■的混合物,NaOH和Na■CO■的含量(以质量浓度g·L-1表示)可由下式计算: NaOH%=c■×100% Na■CO■%=■×100% 当V■ Na■CO■%=■×100% NaHCO■%=■×100% 3.数据记录与处理 3.1 0.1mol/lHCl溶液浓度的标定 3.2混合碱的测定 表1 表2 图1 混合碱滴定曲线 4.结论与讨论 4.1结论 本次实验中V■>V■,所以可以判定混合碱的成分是NaOH与Na■CO■的混合物。计算出NaOH的含量为45.64%,Na■CO■的含量为17.57%;最后得知NaOH的实际含量为45.70%,Na■CO■的实际含量为51.30%,最后分别计算出NaOH,Na■CO■的回收率: NaOH的回收率=(45.64/45.70)×100%=99.87% Na■CO■的回收率=(51.27/51.30)×100%=99.94% 4.2讨论 4.2.1实验要进行浓盐酸酸的稀释,因为容易挥发,所以要在通风橱里完成,倒的时候要小心,防止造成安全事故。 4.2.2实验中盐酸的标定要注意终点时生成的是H■CO■饱和溶液,PH为3.9,为了防止终点提前,必须尽可能驱除CO■,接近终点时要剧烈振荡溶液,或者加热;本文采用的是剧烈振荡溶液。 4.2.3碱测定在第一终点时生成NaHCO■,应尽可能保证CO■不丢失,滴定速度一定不能过快,否则会造成HCL局部过浓,引起CO■的丢失,摇动应该缓慢,不要剧烈振动。 4.2.4实验是采用双指示剂法测定混合碱的含量,由于使用了酚酞(由红色至无色)、甲基橙(由黄色至橙色),颜色变化不是太明显,并存在主观因素,分析结果的误差较大,本文采用对照方法提高分析结果的准确度。 4.2.5实验只要认真对待,严谨的作风就可以很好地形成。 参考文献: [1]吉林化工学校.姜洪文《分析化学》.化学工艺出版社,1994第1版. [2]吉林化工学校.李楚芝《分析化学实验》.化学工艺出版社,1995.6第1版. [3]蔡增俐.《分析技术与操作(二)》.化学工艺出版社和教材出版中心出版,2005.7第1版. [4]华中师范学院等学院主编.《分析化学》.高等教育出版社,1981.2第1版. [5]《中华人民共和国药典》(2005版二部).药典委员会.北京.化学工业出版社.

