新药诱导后自体干细胞移植巩固治疗对不同危险度骨髓瘤患者的作用探讨*
周 莉 莉曾添美 奚 昊 傅卫军 杜 鹃 张春阳 姜 华 侯 健
·论著·
新药诱导后自体干细胞移植巩固治疗对不同危险度骨髓瘤患者的作用探讨*
周莉莉曾添美奚昊傅卫军杜鹃张春阳姜华侯健
目的:探讨自体造血干细胞移植(autologous hematopoietic stem cell transplantation,ASCT)作为新药诱导后的巩固治疗对不同危险分层骨髓瘤患者的无进展生存时间(progression-free survival,PFS)及总生存时间(overall survival,OS)的影响。方法:回顾性分析2006年8月至2011年7月在本科行自体干细胞移植巩固治疗的67例多发性骨髓瘤患者,根据ISS分期及FISH检测结果为基础的最新IMWG预后标准分为高危组17例,中危组24例,低危组26例。另选取同时期67例接受化疗作为巩固治疗的骨髓瘤患者进行年龄、危险分层配对,比较移植组与化疗组的PFS和OS差异。所有患者前期均接受硼替佐米和/或沙利度胺为主的诱导治疗。结果:所有患者诱导治疗后均达到部分缓解(partial remissive disease,PR)以上疗效,移植组与化疗组vs.接近完全缓解率(nCR/CR)差异无统计学意义(44.8%vs.37.3%,P=0.380)。巩固治疗后,高、中、低危移植组患者中位nCR/CR率分别由47.1%,37.5%,50.0%增加为62.9%,62.5%,61.5%。高危患者移植巩固后中位PFS(30.5个月vs.11.2月,P<0.001)和OS(85.5 vs.34个月,P=0.015)均明显延长;中危移植组和化疗组中位PFS和OS无统计学差异(P>0.05);低危移植组患者与化疗组相比,中位PFS延长(34.8 vs.17.6个月,P=0.012),OS差异无统计学意义(P>0.05)。结论:在硼替佐米和/或沙利度胺为基础的新药诱导治疗后,高危骨髓瘤患者更能从自体造血干细胞移植巩固治疗中获益,进而延长生存。
多发性骨髓瘤自体造血干细胞移植细胞遗传学
Correspondence to:Jian HOU;E-mail:houjian@medmail.com.cn
Department of Hematology,Myeloma&Lymphoma Center,Changzheng Hospital of the Second Military Medical University,Shanghai,China
This work was supported by grants from the National Natural Science Foundation of China(No.81172248 and 81001050)and the Yangtze River Delta Project of Tackling Key Problems of Shanghai Municipal Science and Technology Commission(No.12495810500)
1 材料与方法
1.1研究对象
回顾性分析2006年8月至2011年7月在第二军医大学长征医院血液科接受自体造血干细胞移植的67例多发性骨髓瘤患者。按照IMWG最新预后标准:高危:ISS分期Ⅱ~Ⅲ期,伴有t(4;14)易位或/ 17p13缺失;中危:ISSⅡ~Ⅲ,无不良预后FISH,或ISSⅠ期伴有t(4;14)或17p13缺失;低危:ISSⅠ/Ⅱ不伴不良FISH[4]。按年龄、性别及危险分层进行配对,年龄选择与配对病例相差5岁以内,病例数及性别按1:1配对。共纳入67例化疗巩固患者作为对照,移植组和化疗组分别包括高危患者17例,中危患者24例,低危患者26例。所有患者前期均接受4~6个疗程硼替佐米和/或沙利度胺为基础的诱导治疗,且疗效均在PR(部分缓解)及以上。两组患者在年龄、性别、疾病分型、最佳疗效及危险分层上均差异无统计学意义,具体临床资料见表1。
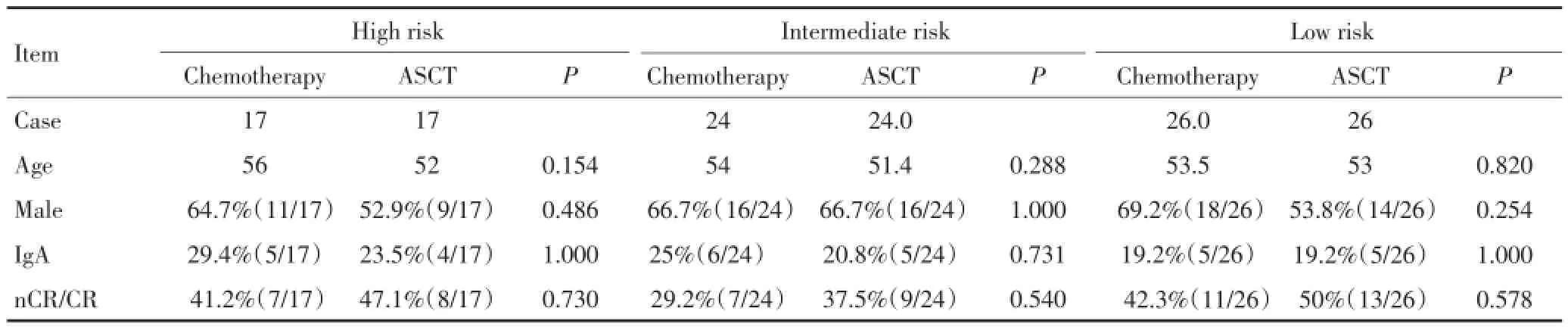
表1 不同危险度患者一般情况比较Table 1 General conditions of patients in autologous stem cell transplantation and chemotherapy groups with different risks
1.2诱导方案及疗效评估
根据患者经济水平及一般状态,选择以硼替佐米和/或沙利度胺为主的联合化疗方案,主要方案包括:PAD(硼替佐米1.75 mg/d d1,4,8,11,阿霉素10 mg d1~4,地塞米松20 mg d1~4,8,11),TAD(沙利度胺75~150 mg/日,阿霉素10 mg d1~4,地塞米松20 mg d1~4),根据不良反应适度调整方案及剂量。各组诱导治疗及最佳疗效均差异无统计学意义(P>0.05)。每两个疗程按IMWG标准评估疗效[5]。
1.3荧光原位杂交(fluorescence in situ hybridization,FISH)检测
FISH检测包含17p-、13q-、1q21+、t(4;14)、t (11;14)、t(14;16)在内的遗传学异常。留取MM患者治疗前骨髓20 mL,提取单个核细胞,采用免疫磁珠分选CD138阳性细胞。利用离心涂片机将分选细胞涂片,IgH探针、D13S319探针、P53探针及1q21探针购自北京金菩嘉公司,t(11;14)探针、t(4;14)探针、t(14;16)探针购自美国Vysis公司。杂交后在荧光显微镜下观察计数。参考值确立采用10例非血液系统疾病患者骨髓标本,范围设定为正常骨髓标本所观察到异常细胞数占总细胞数比例的均值±3个标准差(分界值=X±3S)。
1.4研究终点
无进展生存期(progression-free survival,PFS)及总生存期(overall survival,OS)。其中无进展生存期定义为巩固治疗开始至疾病进展或死亡的时间[5]。
1.5统计学方法
采用SPSS 17.0统计软件进行统计学分析,多组均值比较采用方差分析,两组间率的比较采用χ2检验,多组率的比较R×C表卡方检验,生存分析采用Kaplan-Meier法。P<0.05为具有显著性差异。
2 结果
2.1新药诱导后移植组和化疗组最佳疗效比较
移植组及化疗组共134例患者,均接受4~6个疗程的以硼替佐米和/或沙利度胺为基础的诱导治疗,诱导后均达到PR及以上疗效,总nCR/CR为38.1%(51/134)。巩固治疗前,移植组及化疗组患者总体的年龄、性别、诱导治疗、IgA型比例及最佳疗效均无显著差异,nCR/CR率分别为移植组37.3%,化疗组47.8%(P=0.380)。不同危险分层亚组之间最佳疗效差异无统计学意义(表1)。
2.2巩固治疗后不同危险分层移植组与化疗组最佳疗效比较
移植组中,12例治疗前疗效评估PR/VGPR的患者,经过ASCT巩固治疗后进一步达到nCR/CR,总体nCR/ CR率由诱导后的44.8%进一步升为65.6%。亚组分析显示,高危组nCR/CR率由移植前的47.1%增至移植后的62.9%,中危组由37.5%增至62.5%,低危组由50.0%增为61.5%,不同危险分层的移植患者最佳疗效均在巩固治疗后获得进一步提高,而化疗组巩固治疗前后最佳疗效则差异无统计学意义(P>0.05)。
2.3巩固治疗后移植组及化疗组患者生存比较
中位随访30.6个月,移植组与化疗组相比,患者总体PFS(32.4个月vs.15.1个月,P<0.001)及OS(58.8个月vs.42.1个月,P=0.009)明显延长。亚组分析进一步显示,高危移植组患者比高危化疗组患者中位PFS(30.5个月vs.11.2个月,P<0.001)及OS(85.5个月vs.34.0个月,P=0.015)均明显延长(图1);中危移植组患者与中危化疗组患者中位PFS(25.7个月vs.15.1个月,P=0.05)和OS(54.0个月vs.42.1个月,P= 0.932)差异无统计学意义(图2);低危移植组患者与化疗组患者相比,中位PFS(34.8个月vs.17.6个月,P= 0.012)延长,而OS无显著性差异(P=0.069,图3)。
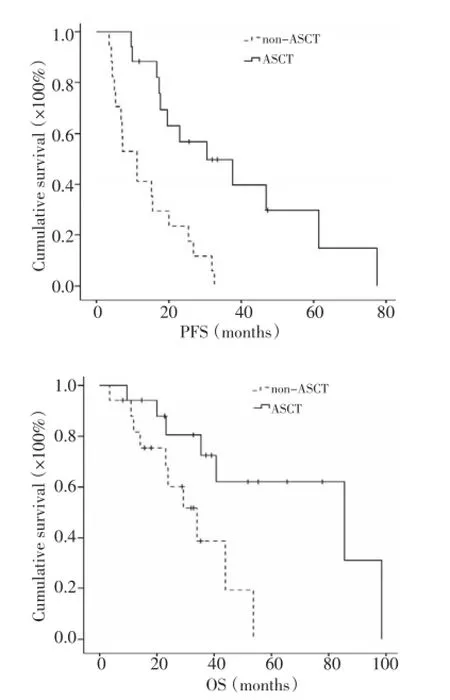
图1 高危移植组与化疗组PFS及OS比较Figure 1 Progression-free survival and overall survival of high-risk patients in autologous stem cell transplantation and chemotherapy groups

图2 中危移植组与化疗组PFS及OS比较Figure 2 Progression-free survival and overall survival of intermediate-risk patients in autologous stem cell transplantation and chemotherapy groups

图3 低危移植组与化疗组PFS及OS比较Figure 3 Progression-free survival and overall survival of low-risk patients in autologous stem cell transplantation and chemotherapy groups
3 讨论
自体干细胞移植(ASCT)是年轻多发性骨髓瘤患者的一线治疗,全球多个临床随机对照试验已经证实,ASCT能改善患者生存,延长PFS[5]。近年来,随着遗传学分层对预后及治疗的指导,以及新药在临床的广泛应用,MM患者的生存获得极大改善,包括ASCT在内的传统治疗方案组合有了新的选择,新药诱导后序贯ASCT的多项临床研究提示CR率为33%~61%,3年PFS为50~69个月,3年OS可达72~85个月[6-11]。从TT1到TT3研究的最新随访结果均表明:加入新药的诱导及维持在以ASCT为巩固的MM患者中有更高的CR率,并显著延长PFS及OS[12],因此目前联合化疗后的ASCT仍为MM治疗的最佳策略。
但是在不适合移植的MM患者中,新药诱导序贯新药巩固的研究也显示了相似的CR率及生存优势。Palumbo等[13]报道了在不适合移植的老年患者中,MP联合反应停的治疗(MPT)能使两年PFS达43%,3年OS也达50%。一篇综合6项随机对照试验的Meta分析结果表明:较之MP方案,MPT方案更能使患者生存获益(HR=0.83,95%CI为0.73~0.94),P=0.004),中位OS可延长约6.6个月,中位PFS可延长约5.4个月[14]。新药治疗在不适合移植的患者中的生存优势促使我们思考即使在适合移植的患者中,ASCT是否仍然对所有患者均有益。
随着对MM细胞遗传学认识的深入,目前对患者预后的评估不再仅仅依赖于ISS分期。Mayo中心的mSMART预后评估系统[14]基于蛋白酶体抑制剂及免疫调节剂的广泛应用而建立,具有临床指导意义。IMWG对2 637例大样本临床MM患者的研究中应用了最新预后分层体系:高危:ISS分期Ⅱ~Ⅲ期,伴有t (4;14)易位或/17p13缺失;中危:ISSⅡ~Ⅲ,无不良预后FISH,或ISSⅠ期伴有t(4;14)或17p13缺失;低危:ISSⅠ/Ⅱ不伴不良FISH[4]。结果不同危险分层患者的中位OS具有显著性差异,分别为高危组2年,中危组7年,低危组>10年,该危险分层对预后具有良好的提示作用[15-18]。
本研究基于IMWG最新的预后分层,比较硼替佐米及沙利度胺诱导后,ASCT对不同危险分层MM患者生存的作用。研究结果表明,在以硼替佐米和沙利度胺为主的方案诱导后,ASCT可延长低危MM患者PFS,但对OS无显著影响;同样,在中危患者,ASCT 对PFS和OS的改善无明显优势;而在高危患者中,ASCT组比化疗组患者的PFS延长近20个月,OS也有显著改善,尽管随访时间还较短,已经显示出不同危险分层患者获益不同,高危MM患者可从ASCT中获益更多,能够改善长期生存和预后。该研究进一步证实MM是一种异质性肿瘤,早期更精细的分子及遗传学分层对于临床治疗选择,尤其是新药诱导治疗后巩固方案的选择具有重要的意义。对于ISS分期Ⅰ期不伴有FISH高危结果的患者,可以选择以新药为基础的治疗,ASCT可不作为一线治疗,而更多地考虑在疾病进展或复发时进行。而对于ISS分期Ⅱ/Ⅲ期并伴有FISH高危的患者,应在诱导缓解后尽快行ASCT巩固,以提高PFS及OS。本研究表明,高危患者从ASCT巩固治疗中获益最多,未来需要建立前瞻性、大样本的研究,并延长随访时间来进一步验证。
1 Siegel R,Ward E,Brawley O,et al.Cancer statistics,2011:The impact of eliminating socioeconomic and racial disparities on premature cancer deaths[J].CA Cancer J Clin,2011,61(4):212-236.
2 Du J,Huo J,Shi J,et al.Polymorphisms of nuclear factor-κB family genes are associated with development of multiple myeloma and treatment outcome in patients receiving bortezomib-based regimens [J].Haematologica,2011,96(5):729-737.
3 Moreau P,Minvielle S.Multiple myeloma:so much progress,but so many unsolved questions[J].Haematologica,2013,98:487-489.
4 Chng WJ,Dispenzieri A,Chim CS,et al.IMWG consensus on risk stratification in multiple myeloma[J].Leukemia,2014,28:269-277. 5Durie BG,Harousseau JL,Miguel JS,et al.International uniform response criteria for multiple myeloma[J].Leukemia,2006,20:1467-1473.
6 Koreth J,Cutler CS,Djulbegovic B,et al.High-dose therapy with single autologous transplantation versus chemotherapy for newly diagnosed multiple myeloma:a systematic review and meta-analysis of randomized controlled trials[J].Biol Blood Marrow Transplant,2007,13(2):183-196.
7 Harousseau JL,Attal M,Avet-Loiseau H,et al.Bortezomib plus dexamethasone is superior to vincristine plus doxorubicin plus dexamethasone as induction treatment prior to autologous stem cell transplantation in newly diagnosed multiple myeloma:results of the IFM 2005-01 phase III trial[J].J Clin Oncol,2010,28(30):4621-4629.
8 Sonneveld P,Wolf IG,van der Holt B,et al.HOVON-65/GMMG-HD4 randomized phase III trial comparing bortezomib,doxorubicin,dexamethasone(PAD)vs VAD followed by high-dose melphalan(HDM)and maintenance with bortezomib or thalidomide in patients with newly diagnosed multiple myeloma(MM)[abstract].Blood(ASH Annual Meeting Abstracts).2010,116(21):40.
9 Palumbo A,Gay F,Falco P,et al.Bortezomib as induction before autologous transplantation,followed by lenalidomide as consolidation-maintenance in untreated multiple myeloma patients[J].J Clin Oncol,2010,28(5):800-807.
10 Reeder CB,Reece DE,Kukreti V,et al.Cyclophosphamide,bortezomib and dexamethasone induction for newly diagnosed multiple myeloma:high response rates in a phase II clinical trial[J].Leukemia,2009,23(7):1337-1341.
11 Cavo M,Tacchetti P,Patriarca F,et al.Bortezomib with thalido-mide plus dexamethasone compared with thalidomide plus dexamethasone as induction therapy before,and consolidation therapy after,double autologous stem-cell transplantation in newly diagnosed multiple myeloma:a randomized phase 3 study[J].Lancet,2010,376(9758):2075-2085.
12 Usmani SZ,Crowley J,Hoering A,et al.Improvement in long-term outcomes with successive Total Therapy trials for multiple myeloma:are patients now being cured[J]?Leukemia,2013,27 (1):226-32.
13 Palumbo A,Bringhen S,Liberati AM,et al.Oral melphalan,prednisone,and thalidomide in elderly patients with multiple myeloma:updated results of a randomized controlled trial[J].Blood,2008,112 (8):3107-3114.
14 Dispenzieri A,Rajkumar SV,Gertz MA,et al.Treatment of newly diagnosed multiple myeloma based on Mayo Stratification of Myeloma and Risk-adapted Therapy(mSMART):consensus statement[J].Mayo Clin Proc,2007,82:323-341.
15 Usmani SZ,Crowley J,Hoering A,et al.Improvement in long-term outcomes with successive Total Therapy trials for multiple myeloma:are patients now being cured[J]?Leukemia,2013,27:226-232.
16 Chinen Y,Kuroda J,Shimura Y,et al.Phosphoinositide protein kinase PDPK1 is a crucial cell signaling mediator in multiple myeloma [J].Cancer Res,2014,74(24):7418-7429.
17 van de Donk NW,Sonneveld P.Diagnosis and risk stratification in multiple myeloma[J].Hematol Oncol Clin North Am,2014,28 (5):791-813.
18 van Laar R,Flinchum R,Brown N,et al.Translating a gene expressionsignaturefor multiplemyeloma prognosis intoarobust high-throughput assay for clinical use[J].BMC Med Genomics,2014,7:25.
(2014-10-30收稿)
(2014-12-30修回)
(编辑:杨红欣)

周莉莉专业方向为骨髓瘤、淋巴瘤等疾病的诊断与治疗。
E-mail:silencelily@163.com
Benefit of autologous stem cell transplantation in multiple myeloma patients at different risks after bortezomib-and/or thalidomide-based induction therapies
Lili ZHOU,Tianmei ZENG,Hao XI,Weijun FU,Juan DU,Chunyang ZHANG,Hua JIANG,Jian HOU
Objective:To evaluate the benefit of autologous stem cell transplantation(ASCT)as a consolidation therapy in the survival of multiple myeloma(MM)patients at different risks.Methods:A total of 67 MM patients who received ASCT as consolidation therapy between August 2006 and July 2011 were enrolled in the retrospective study.The cases were divided into three risk groups on the basis of the International Staging System and fluorescence in situ hybridization.Another 67 patients who accepted consolidation chemotherapy at the same period were selected as case-paired controls matched in terms of age,sex,optimal response after induction, and risk stratifications.All the patients received bortezomib-and/or thalidomide-based induction therapies.Results:No statistical differences in non-complete remission(nCR)/complete remission(CR)rate were observed between the ASCT and chemotherapy groups (44.8%vs.37.3%,P=0.380)after the induction therapy.The progression-free survival(PFS)was longer in the ASCT group than in the chemotherapy group(32.4 months vs.15.1 months,P<0.001).The overall survival(OS)was longer in the ASCT group than in the chemotherapy group(58.8 months vs.42.1 months,P=0.009).both the PFS(median:30.5 months vs.11.2 months,P<0.001)and the OS (median:85.5 months vs.34 months,P=0.015)rates were significantly prolonged in the high-risk subgroup after ASCT.In the intermediate-risk subgroup,neither PFS nor OS showed any significance after ASCT(P>0.05).In the low-risk subgroup,only PFS was extended(median:34.8 months vs.17.6 months,P=0.012)after ASCT,without significant improvements in the OS(P>0.05).Conclusion: The MM patients obtained cytogenetic high-risk benefits mostly fromASCT consolidation after inductions based on novel agents.
multiple myeloma,autologous hematopoietic stem cell transplantation,cytogenetics多发性骨髓瘤(multiple myeloma,MM)是一种恶性浆细胞克隆增殖性疾病[1-2]。大剂量化疗联合自体造血干细胞移植(autologous hematopoietic stem cell transplantation,ASCT)显著改善了MM的临床疗效,已经成为65岁以下无移植禁忌患者的一线标准治疗。近年来,随着对MM分子机制及遗传学预后分层的认识不断深入,以蛋白酶体抑制剂及免疫调节剂为代表的新药在临床广泛应用,MM患者的生存得到了极大改善,甚至被认为有望成为“可治愈的疾病”[3]。然而,新药时代ASCT对不同遗传学分层的患者是否作用相同,目前尚不明确。本文拟对新药诱导后ASCT作为巩固治疗的67例MM患者进行回顾性病例对照研究,探讨其对不同遗传学分层患者生存的作用。
10.3969/j.issn.1000-8179.20142173
第二军医大学长征医院血液科全军骨髓瘤与淋巴瘤疾病中心(上海市200003)
*本文课题受国家自然科学基金(编号:81172248&.81001050)和上海市科委长三角科技攻关课题(编号:12495810500)资助
侯健houjian@medmail.com.cn

