低共熔溶剂中铁盐脱除硫化氢性能的研究
隋 琳,杨 浮,罗根祥,韩春玉
(辽宁石油化工大学化学化工与环境学部,辽宁 抚顺 113001)
低共熔溶剂中铁盐脱除硫化氢性能的研究
隋 琳,杨 浮,罗根祥,韩春玉
(辽宁石油化工大学化学化工与环境学部,辽宁 抚顺 113001)
针对湿法氧化法脱除硫化氢气体可以回收硫磺副产物,并且脱硫剂可以循环使用的特点,以铁盐在低共熔溶剂中作为脱除硫化氢气体的氧化剂,考察了反应条件对脱硫率的影响。结果表明:合适的Fe(NO3)3·9H2O浓度是保证高脱硫率的必要条件,离子液体体系是影响脱硫率的主要因素;在一定的低共熔溶剂条件下,脱硫率主要受硫化氢气体进口流量的影响。反应产物为单斜相硫磺。
低共熔溶剂 硫化氢 氧化脱硫 硫磺
随着环保法规的日趋严格,开发硫化氢的高效脱除技术已成为世界各国相关人员关注的热点。目前,克劳斯法常用于处理含高浓度硫化氢的废气,但该方法存在诸多不足:工艺路线长、操作复杂、尾气需二次处理、投资大、存在安全隐患等。开发新工艺取代传统的克劳斯法酸性气处理工艺被大量关注[1]。湿法氧化炼油厂酸性气法具有操作简便、工艺流程简单、投资少、脱硫剂可以循环使用、回收硫磺可再利用等优势,已成为研究的热点[2]。
离子液体作为一种环境友好材料是目前绿色化学研究领域的热点之一,在吸收硫化氢等酸性气体方面引起了广泛关注。Guo Bin等[3]合成了一系列己内酰胺四丁基溴化铵离子液体,进行吸收H2S的研究。结果表明,己内酰胺与四丁基溴化铵物质的量比为1∶1时,该类离子液体对H2S吸收性能最佳,在常压、303.2 K时,H2S的溶解度是5.40%。将离子液体解吸后再吸收,循环使用6次,其对H2S的溶解性能几乎不变。
离子液体具有一般脱硫剂无法比拟的优势,蒸气压极小,避免了吸收剂因挥发而造成的损失和污染[4-5]。然而,大多数离子液体还存在一些缺陷,如合成过程复杂、提纯困难、价格昂贵等,而且制备过程中一般需使用有机溶剂,会产生一定量的废物,降低了离子液体的绿色特征,人们试图寻求一种更绿色、价格更低廉的离子液体。2003年,Abbott等[6]发现了一种由季铵盐和酰胺化合物形成的物理化学性质优良的溶剂——低共熔溶剂。低共熔溶剂通常是按照一定化学计量比的季铵盐和氢键给体(如酰胺、羧酸和多元醇等化合物)组合而成的低共熔混合剂[7]。由于低共熔溶剂的合成原料均为常见的化合物,具有来源丰富、价格低廉、不易挥发、低毒、可降解等优点,因此,低共熔溶剂有望实现大规模工业化生产[8-11]。低共熔体系能够应用于对一些气体的吸附,功能化低共熔溶剂对酸性气体中的含硫组分具有优异的吸收能力[12]。本课题以Fe(Ⅲ)作为低共熔体系中的氧化剂,考察低共熔体系的脱硫能力,探索构建新型氧化脱硫工艺。
1 实 验
1.1 试剂及仪器
硝酸铁[Fe(NO3)3·9H2O],分析纯,天津市恒兴化学试剂制造有限公司生产;氯化胆碱,分析纯,上海山浦化工有限公司生产;乙二醇,分析纯,国药集团化学试剂有限公司生产;尿素,分析纯,上海山浦化工有限公司生产;丙二酸,化学纯,上海试剂三厂生产;硫化氢气体,大连光明特种气体有限公司生产,硫化氢体积分数为1 998μL/L,N2为平衡气。
GC7900气相色谱仪,火焰光度检测器(FPD),上海天美科学仪器有限公司生产;气体进样量为0.4 mL,气化温度为120 ℃,检测器温度为160 ℃。NHA-300氮、氢、空一体机,北京中惠普分析技术研究所生产。D/max-RB型X射线衍射仪,辐射源为Cu Kα,连续扫描,扫描步长为0.02 mm,扫描速率4(°)/min,管电压为40 kV,管电流为100 mA。
1.2 低共熔脱硫剂的制备
低共熔溶剂的制备:氯化胆碱/乙二醇(摩尔比1∶2),在磁力加热搅拌器上加热到60 ℃,得到无色透明、流动性较好的液体,静止冷却至室温后,密封好防止被污染。氯化胆碱/尿素(摩尔比1∶2)和氯化胆碱/丙二酸(摩尔比1∶1)的配制方法同上。
称取一定质量的Fe(NO3)3·9H2O,与低共熔溶剂配制成脱硫剂,Fe(NO3)3·9H2O摩尔浓度分别为0.10,0.15,0.20 mol/L。
1.3 脱硫反应机理
选择液相反应来处理H2S,吸收液由Fe(NO3)3·9H2O与低共熔溶剂组成。反应过程中,被吸收的H2S会发生相应的转化并在吸收瓶内生成清晰可见的浅黄色单质硫。脱硫反应机理如下:
吸收反应:
(1)
(2)
(3)
再生反应:
(4)
总反应:
(5)
1.4 脱硫实验装置
图1为脱硫反应装置示意。该反应装置由供气系统、反应系统和检测系统3部分组成。其中反应器由G3、G4型玻璃砂漏斗和带有水浴壁的玻璃管组成。反应过程中,定期采集脱硫反应器末端的尾气,并通过GC7900气相色谱仪测定其中的硫化氢浓度。

图1 脱硫反应实验装置示意
2 结果与讨论
2.1 不同低共熔体系对脱硫率的影响
在温度为25 ℃、H2S流量为30 mL/min的条件下,考察Fe(Ⅲ)与不同低共熔剂形成的体系对H2S脱除率(脱硫率)的影响,结果见图2。低共熔溶剂分别为氯化胆碱-乙二醇、氯化胆碱-尿素和氯化胆碱-丙二酸,Fe(NO3)3·9H2O的浓度为0.15 mol/L。由图2可以看出,氯化胆碱分别与尿素和丙二酸配制的低共熔体系对H2S的脱除率较低。在室温(25 ℃)条件下,低共熔溶剂氯化胆碱-尿素(摩尔比为1∶2)[13]、氯化胆碱-丙二酸(摩尔比为1∶1)的黏度大于氯化胆碱-乙二醇(摩尔比为1∶2)的黏度[14-15],不利于硫化氢气体的吸收,不适合用作脱硫剂。因此,选择氯化胆碱-乙二醇作为脱除H2S的低共熔体系。
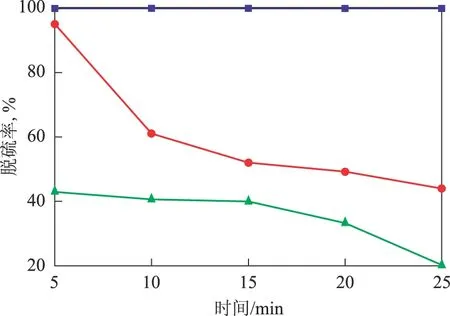
图2 不同低共熔体系对脱硫率的影响■—氯化胆碱-乙二醇; ●—氯化胆碱-尿素; ▲—氯化胆碱-丙二酸
2.2 铁盐低共熔溶剂硫容的评估
硫容是评估脱硫剂脱硫性能的重要指标,与脱硫剂的脱硫性能成正比。硫容是在脱硫率为100%的有效时间内脱硫剂吸收的硫磺的质量与脱硫剂的体积比[16]。硫容可表示为:
(6)
式中:S为铁基低共熔溶液的硫容,g/L;pH2S为硫化氢气体的压力,220 kPa;QH2S为硫化氢标准气体的流量,3.0×10-5m3/min;t为反应时间,min;R为气体状态方程常数,8.314 J/(mol·K);T为硫化氢气体的温度,298.15 K;V为低共熔溶剂的体积,0.01 L。
取10 mL Fe(NO3)3·9H2O浓度为0.15 mol/L的铁盐低共熔溶剂,设定反应温度为25 ℃,从反应器下端通入流速为30 mL/min的硫化氢标准气体。每间隔5 min用色谱检测反应器出口的硫化氢浓度,脱硫率随时间的变化如图3所示。从图3可以看出,反应时间低于60 min时尾气中没有检测到硫化氢,反应70 min时开始检测到少量硫化氢,反应80 min后尾气中硫化氢的浓度迅速增大。在保证100%净化度的情况下,取反应时间为60 min,代入式(6),即得到铁基离子液体的硫容为1.024 g/L。而通过化学计量反应方程式计算得到的理论硫容为2.4 g/L,大于实际的硫容。这与硫化氢气体常温、常压下在低共熔溶剂中的溶解度有关[17]。
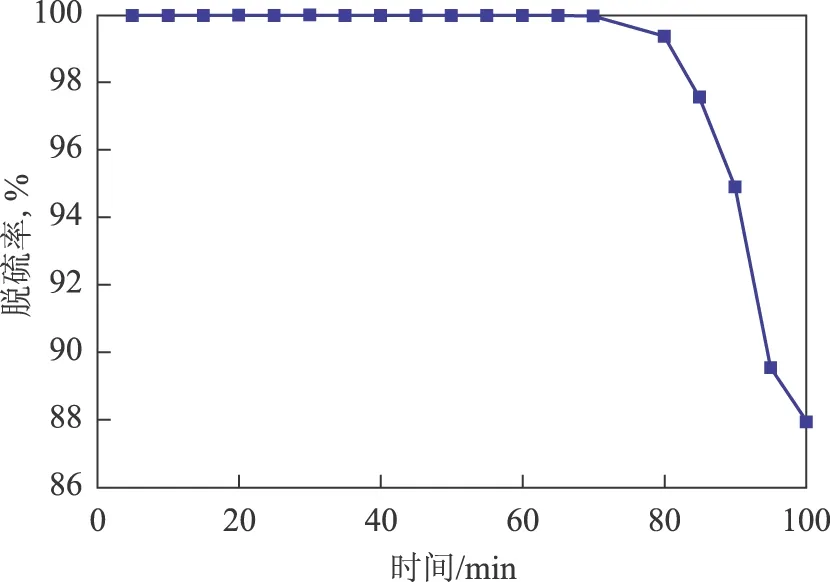
图3 脱硫率随时间的变化
2.3 Fe(NO3)3·9H2O浓度对脱硫率的影响

图4 Fe(NO3)3·9H2O浓度对脱硫率的影响Fe(NO3)3·9H2O浓度,mol/L: ■—0.10; ●—0.15; ▲—0.20
在硫化氢流量为30 mL/min、反应温度为25 ℃、脱硫剂用量为10 mL的条件下,考察Fe(NO3)3·9H2O浓度对脱硫率的影响,结果见图4。从图4可以看出,随着Fe(NO3)3·9H2O浓度的增大,脱硫率为100%的时间延长,Fe(Ⅲ)与硫化氢气体的反应能力增强。在反应过程中,当硫化氢分子从气相通过气-液界面进入液相时可与Fe(Ⅲ)完成反应。具有氧化性的Fe(Ⅲ)浓度越大,吸收的硫化氢越多,脱硫剂使用寿命越长。由此可知,合适的Fe(Ⅲ)浓度是保证高脱硫率时间的重要因素,浓度增大,保持高脱硫率的时间增长。
2.4 硫化氢流量对脱硫率的影响
在反应温度为25 ℃、低共熔溶剂中Fe(NO3)3·9H2O浓度为0.15 mol/L、脱硫剂用量为10 mL的条件下,考察硫化氢流量对脱硫率的影响,结果见图5。从图5可以看出,随硫化氢流量的增大,脱硫率为100%的时间缩短。按照溶液吸收的一般规律,溶剂对气体的吸收与气体流量有关,当气体流量越小时,溶剂与气体接触越充分,吸收也越完全,净化效率也就越高。
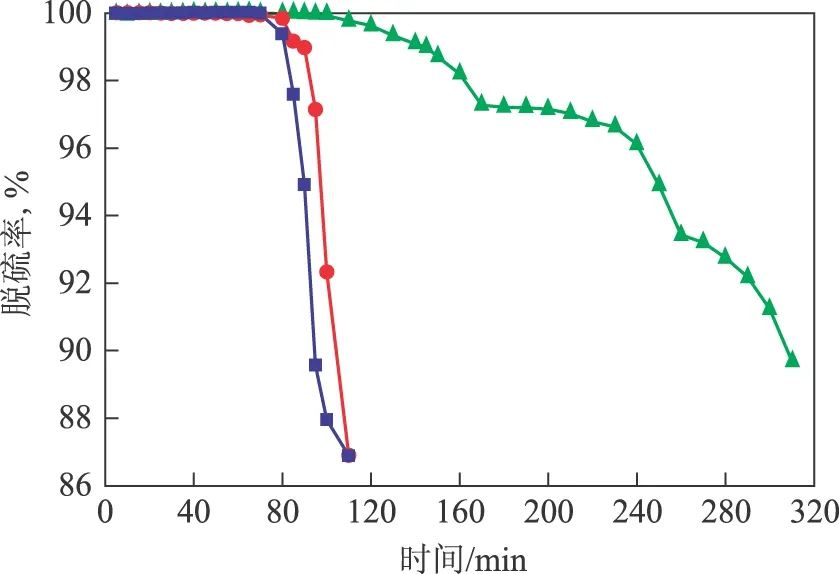
图5 硫化氢流量对脱硫率的影响硫化氢流量,mL/min: ■—40; ●—30; ▲—20
2.5 反应温度对脱硫率的影响

图6 反应温度对脱硫率的影响反应温度,℃: ■—25; ●—40; ▲—55
在硫化氢流量为30 mL/min、低共熔溶剂中Fe(NO3)3·9H2O浓度为0.15 mol/L、脱硫剂用量为10 mL的条件下,考察反应温度对脱硫率的影响,结果见图6。从图6可以看出,随反应温度的升高,脱硫率有所提高。在前60 min内,不同温度下的脱硫率均可达100%,但随反应时间的延长,脱硫剂中Fe(Ⅲ)的量减少,导致脱硫率下降。低共熔溶剂不仅能够耐受较高的温度,而且随温度的升高其黏度逐渐降低[18],较低的黏度有利于提高铁基脱硫剂催化氧化硫化氢的反应。但温度升高对脱硫性能的影响不明显,因为温度的升高会降低气体在脱硫剂中的溶解度[19]。
2.6 产物硫磺的XRD表征
将脱硫得到的硫磺用蒸馏水清洗,然后置于真空干燥箱中干燥。将产物研磨后用X射线衍射仪分析晶相结构,结果见图7。将图7与硫的标准衍射谱图进行比较,发现产物硫磺的XRD谱图中峰的位置和强度与单斜相硫的衍射峰标准谱图(PDF No.83-2283)相符,呈现单斜相硫微粒的特征,说明Fe(Ⅲ)氧化硫化氢得到的产物为单斜相硫磺。另外,对得到的产品纯度进行分析[20],硫质量分数为99.60%。

图7 产物硫磺的XRD图谱
3 结 论
在低共熔铁盐溶剂中,Fe(Ⅲ)可以直接氧化硫化氢脱硫。合适的Fe(NO3)3·9H2O浓度是保证高脱硫率的必要条件,离子液体体系是影响脱硫率的主要因素。在一定的低共熔溶剂条件下,脱硫率主要受硫化氢气体进口流量的影响,即气液接触时间为该体系脱硫的主要影响因素。在整个反应过程中,除产生硫磺外,不存在二次污染,硫化氢中的硫以单质硫的形式被回收。
[1] 董群,武显春,单希林,等.化学吸收——催化氧化法脱除酸性气中硫化氢的试验研究[J].石油炼制与化工,2000,31(9):17-19
[2] 李新学,魏雄辉.铁离子湿式氧化法脱除硫化氢的技术进展[J].气体净化,2004,4(3):5-7
[3] Guo Bin,Duan Erhong,Zhong Yongfei,et al.Absorption and oxidation of H2S in caprolactam tetrabutyl ammonium bromide ionic liquid[J].Energy Fuels,2011,25(1):159-161
[4] Ghobadi A F,Taghikhani V,Elliott J R.Investigation on the solubility of SO2and CO2in imidazolium-based ionic liquids using NPT Monte Carlo simulation[J].J Phys Chem B,2011,115(46):13599-13607
[5] Sakhaeinia H,Jalili A H,Taghikhani V,et al.Solubility of H2S in ionic liquids 1-ethyl-3-methylimidazolium hexafluorophosphate ([emim][PF6]) and 1-ethyl-3-methylimidazolium bis(trifluoromethyl) sulfonylimide ([emim][Tf2N])[J].Chem Eng Data,2010,55(12):5839-5845
[6] Abbott A P,Capper G,Davies D L,et al. Novel solvent properties of choline chlorideurea mixtures[J].Chem Commun,2003(1):70-71
[7] 韦露,樊友军.低共熔溶剂及其应用研究进展[J].化学通报,2011,77(4):333-334
[8] Phadtare S B,Shankarling G S.Halogenation reactions in biodegradable solvent: Efficient bromination of substituted 1-aminoanthra-9,10-quinone in deep eutectic solvent (choline chloride:urea)[J].Green Chem,2010,12(3):458-462
[9] Chen Zizhan,Zhu Wei,Zheng Zubiao,et al.One-pot α-nucleophilic fluorination of acetophenones in a deep eutectic solvent[J].Journal of Fluorine Chemistry,2010,131(3):340-344
[10]Chen Shumei,Zhang Jian,Wu Tao,et al.Zinc (Ⅱ)-boron (Ⅲ)-imidazolate framework (ZBIF) with unusual pentagonal channels prepared from deep eutectic solvent[J].Dalton Transactions,2010,39(3):697-699
[11]Hu Suqin,Zhang Zhaofu,Zhou Yinxi,et al.Direct conversion of inulin to 5-hydroxymethylfurfural in biorenewable ionic liquids[J].Green Chem,2009,11(6):873-877
[12]Tokuda H,Hayamizu K,Ishii K,et al.Physicochemical properties and structures of room temperature ionic liquids.1.Variation of anionic species[J].J Phys Chem B,2004,108(42):16593-16600
[13]Andrew P A,Glen C,David L D,et a1.Novel solvent properties of choline chlorideurea mixtures[J].Chem Commun,2003(1):70-71
[14]Abbott A P,Boothby D,Capper G,et al.Deep eutectic solvents formed between choline chloride and carboxylic acids:Versatile alternatives to ionic liquids[J].Journal of the American Chemical Society,2004,126(29):9142-9147
[15]Abbott A P,Harris R C,Ryder K S.Application of hole theory to define ionic liquids by their transport properties[J].J Phys Chem B,2007,111(18):4910-4913
[16]何义.铁基离子液体湿法氧化[D].北京:北京化工大学,2010
[17]王建宏,朱玲.[bmim]FeCl4离子液体催化氧化硫化氢的研究[J].天然气化工,2012,37(6):30-32
[18]王建宏,陈家庆,阎红昭.[bmim]FeCl4离子液体的物理性质[J].化学研究,2012,23(1):9-13
[19]Ma Xiaoliang,Wang Xiaoxing,Song Chunshan.“Molecular basket” sorbents for separation of CO2and H2S from various gas streams[J].Journal of the American Chemical Society,2009,131(16):5777-5783
简 讯
烷基化技术进展
目前液体酸烷基化(硫酸和氢氟酸)技术在世界烷基化加工能力中仍占主导地位,已有4家液体酸烷基化商业技术授权方(CDTECH、DuPont STRATCO、ExxonMobil 和 UOP)。但由于安全方面的担心,美国及欧洲已不再新建装置。技术授权方转向新的替代技术(例如间接烷基化、固体酸烷基化、离子液体和丁烷氧化脱氢)。
UOP公司的间接烷基化工艺 (InAlkTM)可以作为新建或者MTBE改造之用。这种催化工艺主要靠转化丁烯生产烷基化产品,同时也能处理来自FCC、蒸汽裂解或者专产烯烃的脱氢装置产出的C3~C5烯烃。在两步工艺中,第一步用弱酸催化剂(固体磷酸或者磺酸离子交换树脂)促进小分子烯烃的聚合;第二步用碱金属或者贵金属催化剂,将第一步生成的大分子异构烯烃饱和生成汽油调合组分,主要是异辛烷,研究法辛烷值(RON)在101~102之间。2001年,第一套InAlk装置在日本投产,之后有11套装置获得授权。
离子液体(ILs)属于类似盐的液体,以前用作溶剂和催化剂。现已发现离子液体的催化性能优于硫酸和氢氟酸。异丁烷在离子液体催化剂中的溶解能力比在硫酸和氢氟酸中高,有利于异丁烷在离子液体中扩散,从离子液体中分离烷基化产物也更容易,因为反应过程中不易形成难分离的乳化液。最近开发的复合离子液体催化剂显示了巨大前景,复合离子液体催化剂提高了C8选择性,尤其是三甲基戊烷(TMP),对辛烷值有很大的提升。中国石油天然气股份有限公司完成了第一套离子液体烷基化技术的商业装置应用,利用复合离子液体催化剂对其STRATCO硫酸烷基化装置进行了改造。
烷基化技术大多数研发工作集中在替代技术(固体酸、离子液体)。固体酸烷基化技术商业化的主要障碍是催化剂的快速失活,以及再生能力问题。原料中的烯烃聚合后占据催化剂活性位,阻塞孔道并导致快速失活。另一个问题是扩散速率较差。中国石油化工股份有限公司申请了两份关于提高固体酸再生性能的专利,第一份详细介绍了固体酸烷基化工艺,包括催化剂连续再生和延长操作周期;第二份涉及维持固体酸烷基化高活性和选择性。其它研发工作集中在各种固体酸催化剂制备方法,包括固体酸新的制备方法以获得高活性和热稳定性,以及高酸性氟树脂催化剂制备。新固体酸烷基化催化剂组成包括大孔网状离子交换树脂、ZnBr2改性黏土以及β分子筛。

[靳爱民摘译自Worldwide Refining Business Digest Weekly,2015-01-05]
HYDROGEN SULFIDE REMOVAL BY Fe-BASED DEEP EUTECTIC SOLVENTS
Sui Lin, Yang Fu, Luo Genxiang, Han Chunyu
(CollegeofChemistry,ChemicalEngineeringandEnvironmentalEngineering,LiaoningShihuaUniversity,Fushun,Liaoning113001)
Wet oxidation method can remove hydrogen sulfide and recover sulfur by-product and the desulfurizer can be recycled. The ferric salt in deep eutectic solvent was used as oxidant for removing hydrogen sulfide. The effect of different reaction conditions on the desulfurization is investigated. The results show that the suitable concentration of Fe(NO3)3·9H2O is the necessary requirement for high efficiency desulfurization, and the ionic liquid system is the main factor influencing the desulphurization rate. Under the conditions of certain eutectic solvent, the desulfurization efficiency is mainly affected by inlet flow rate of hydrogen sulfide gas. The product is of monoclinic sulfur.
deep eutectic solvent; hydrogen sulfide; oxidative desulfurization; sulfur
2014-11-02; 修改稿收到日期: 2015-01-15。
隋琳,硕士研究生,研究方向为新材料合成、含硫精细化学品开发等。
韩春玉,E-mail:hcy7652@163.com。

