矽肺观察对象早期蛋白标志物的研究
缪荣明 丁帮梅 张颖轶 吴为民 房中华 赵锐 夏倩 李永
矽肺观察对象早期蛋白标志物的研究
缪荣明 丁帮梅 张颖轶 吴为民 房中华 赵锐 夏倩 李永
目的 本研究的目的主要集中在矽肺观察对象与非接尘健康正常人之间蛋白组表达谱的变化分析,探索矽肺发展的早期蛋白标志物。方法 收集矽肺观察对象组和健康正常人组样本各10例,利用双向电泳检测筛选差异表达的蛋白,然后进行质谱鉴定分析。结果 与非接触粉尘比较,表达差异在两倍以上的39个上调蛋白和7个下调蛋白被成功鉴定出来。在矽肺观察对象组下调的蛋白有转化生长因子β前体、二肽基肽酶1、载脂蛋白A-Ⅳ前体等蛋白;上调的蛋白有干扰素β前体、肿瘤坏死因子、弗林蛋白酶原、脱氧核糖核酸酶Ⅱ、糖蛋白、颗粒酶A、趋化因子受体等蛋白因子。结论 这些显著变化的蛋白因子主要参与免疫调控、细胞毒性、物质代谢等过程,可能通过免疫反应和蛋白酶活性在矽肺的早期发展中起重要作用。研究结果为矽肺早期临床诊断提供了一些潜在的蛋白分子靶点,有助于矽肺早期标志物的进一步研究和应用。
观察对象;职业疾病;纤维化;细胞因子;蛋白标志物
矽肺是由于吸入游离的二氧化硅而引起的肺部组织弥漫性纤维化为特征的职业疾病。一旦经临床胸片确诊,肺部的损伤便无有效药物恢复。而且矽肺观察对象更容易发生肺癌及其他疾病,是危害最严重的职业病之一。活性氧物质(ROS:reactive oxygen species)、活性氮物质(RNS:reactive nitrogen species)、细胞凋亡相关因子、细胞因子等参与矽肺的发生和发展[1-2]。
二氧化硅颗粒进入肺部细胞后,肺部的细胞和分子机制发生显著的变化[3],低剂量(密度)颗粒可以诱发可逆的炎症损伤;高密度的颗粒可以导致长时的炎症反应、细胞增殖、胞外基质及胶原的沉积[4]。多种细胞包括肺泡巨噬细胞(AM:alveolar macrophages)、中性粒细胞(neutrophils)、T淋巴细胞(T-lymphocytes)及肥大细胞参与其中。这些细胞间的信息交流在矽肺的发病过程中起着重要作用。肺泡Ⅰ型表皮细胞不仅参与早期的纤维化,在纤维化的修复和再生中也具有重要作用[5]。吸入二氧化硅后可促进ROS的产生。ROS介导矽肺中的细胞损伤和纤维化中的即刻的和持续的炎症反应。而活化的炎性细胞会促进氧化物的释放[6]。在肺泡巨噬细胞中,ROS和RNS参与纤维化的信号通路[7]。氧化物质所起作用复杂,可诱导炎症相关的细胞信号级联反应,从而在纤维化中起重要作用。
生长因子和细胞因子包括转化生长因子、白介素等在矽肺的发展过程中表达发生显著变化,且在纤维化过程中起重要作用。在AM中,血小板衍生生长因子(PDGF:Platelet derived growth factor)在成纤维细胞增殖过程与转化生长因子β交互作用[8]。表皮生长因子和转化生长因子在肺部表皮细胞有丝分裂和成纤维化过程中起着关键作用,激活相关的信号通路。肿瘤坏死因子和白介素1的表达早于炎症反应和纤维化,能够通过T或B淋巴细胞增殖和活化等过程刺激炎症和免疫反应[9]。二氧化硅可通过肿瘤坏死因子启动子促进肿瘤坏死因子的表达[10]。
由于矽肺的发病机制未完全清楚,细胞内信号传导的复杂性和矽肺观察对象个体不同状态,矽肺的治疗变得尤为困难。而矽肺观察对象一旦确诊,肺部损伤便无有效药物逆转。为了探索矽肺早期的诊断标志物,本文选取矽肺观察对象样本和非接触粉尘样本,采用双向电泳和MALDI-TOF-MS质谱分析方案,筛选差异表达的蛋白,并进行鉴定及分析,以期发现有意义的蛋白标志物。
1 对象与方法
1.1 对象 某酒店服务员人员10例为非接触粉尘健康对照组,年龄32.4~59.1岁,平均(41.6±3.7)岁,工龄6.1~10.9年,平均(7.9±1.5)年;被集体诊断为观察对象者10例为实验组(清砂工6例、型砂工4例),年龄33.1~56.5岁,平均(42.2±4.1)岁,工龄6.9~10.7年,平均(8.2±1.3)年;两组对象均为男性,年龄、工龄比较,差异无统计学意义(P>0.05)。收集实验组和健康对照组全血2 mL,每组3重复,每个重复来源于10例矽肺观察对象或健康个体的混合,该研究获得伦理委员会许可且所有样本组人员均接受知情同意书。两组对象全部剔除高血压病、糖尿病、心脏病、血液病、风湿免疫系统疾病、肿瘤、肾脏病、肝脏病等矽肺观察对象。全部受检对象均未从事过各类辐射和有毒作业,也无长期接触过各类农药和毒物,营养和消化吸收功能良好,在受检前1个月内均未服用维生素C、银杏叶制剂和茶多酚等抗氧化药物。两组之间年龄差异无统计学意义。所有血样置于4℃冰箱24 h,然后样本转移到离心机(型号:5418R,品牌:Eppendorf)于4 000 rpm速度下离心10 min取血清,保存于-80℃待用。
1.2 蛋白提取和高丰度蛋白去除 矽肺观察对象和健康对照组样本总蛋白根据三氯乙酸的方法(trichloroacetic acid method)[11]。去高丰度蛋白去除试剂(Agilent human 14 multiple affinity removal system columns:albumin、IgG、antitrypsin、IgA、transferrin、haptoglobin、fibrinogen、alpha2-macroglobulin、alpha1-acid glycoprotein、IgM、apolipoprotein AI、apolipoprotein AII、complement C3和transthyretin),进行处理总蛋白样本。得到富集低丰度蛋白,有利于进一步的蛋白组学分析,从而提高双向电泳和质谱的分辨率及动态范围。样本依次用裂解液(9 mol/L urea,4%CHAPS,65 mmol/L dithiothreitol and cocktail enzyme inhibitor)溶解及定量。
1.3 双向电泳 先进行第一相电泳(等电聚集isoelectric focusing,IEF),将样品液和水化液混和后总体积450 μL加入胶槽中,放入胶条后加覆盖液。等电聚焦条件为:30 V 6 h;60 V 6 h;500 V 1 h;1 000 V 1 h;8 000 V 20 h,等电聚焦达到64 000 Vhr后结束。然后进行第二相电泳(十二烷基磺酸钠聚丙烯酰胺凝胶电泳,SDS-PAGE),胶条平衡后进行凝胶的灌制,灌制浓度为12.5%的聚丙烯酰胺凝胶。将平衡完毕的凝胶放置第二相凝胶的顶部;用低熔点琼脂糖封胶液后进行第二相电泳。以恒功率进行电泳(Ettan DALT SIX垂直电泳仪),每胶4 W电泳45 min,然后每胶15 W直至溴酚蓝前沿泳至凝胶的底部。硝酸银染色后,置凝胶于扫描仪扫描(瑞典Amersham Bioscience公司),用ImageMaster 2D Platinum软件(美国GE公司)进行凝胶的数据分析。按照P值小于0.05和差异倍数为2倍以上为标准筛选分析差异表达的蛋白点。
1.4 MALDI-TOF-MS质谱分析 取出的点放入96孔板中,加入ddH2O超声5 min。加乙腈50 μL,脱水至胶粒完全变白,真空抽干5 min。加入10 mM DTT/25 mM NH4HCO350 μL,56 ℃水浴1 h。然后冷却至室温后,吸干,加入55 mM碘乙酰胺/25 mM NH4HCO350 μL,避光45 min。依次用25 mM NH4HCO3,50%乙腈洗,脱水到胶粒完全变白,真空抽干5 min。加胰酶储液冰上放置30 min,加NH4HCO3覆盖胶粒,37℃水浴12 h,加入0.1%TFA,终止酶解反应。样品及标准品1 μL点于AutoflexⅡMALDI-TOF/TOF质谱仪靶上,干燥后点少许基质,进行质谱检测。得到肽质量指纹谱(Peptide Mass Fingerprint,PMF)用Flexanalysis 3.0软件处理,肽段检测算法为SNAP算法,信噪比(S/N)的域值为1.5。肽质量指纹谱用Matrixscience网站提供的Mascot搜索引擎进行数据库检索[12]。
1.5 统计学分析 矽肺观察对象组和对照组之间差异表达的蛋白利用T-test方法进行比较分析(SPSS V20)。将差异表达的蛋白序列导入软件Blast2GO(V2.7.2),分析蛋白序列,进行功能注释并GO丰度分析[13]。
2 结果
2.1 蛋白表达谱 来源于矽肺观察对象组和健康对照组的血清样本经双向电泳和MALDI-TOF/TOF质谱鉴定分析后,46个差异2倍以上(P<0.05)蛋白鉴定出来(表1)。相比非接触粉尘,在矽肺观察对象组有39个蛋白上调,7个蛋白下调(表1,图1A~B)。这些蛋白主要为细胞因子、载脂蛋白、酶类等蛋白因子。
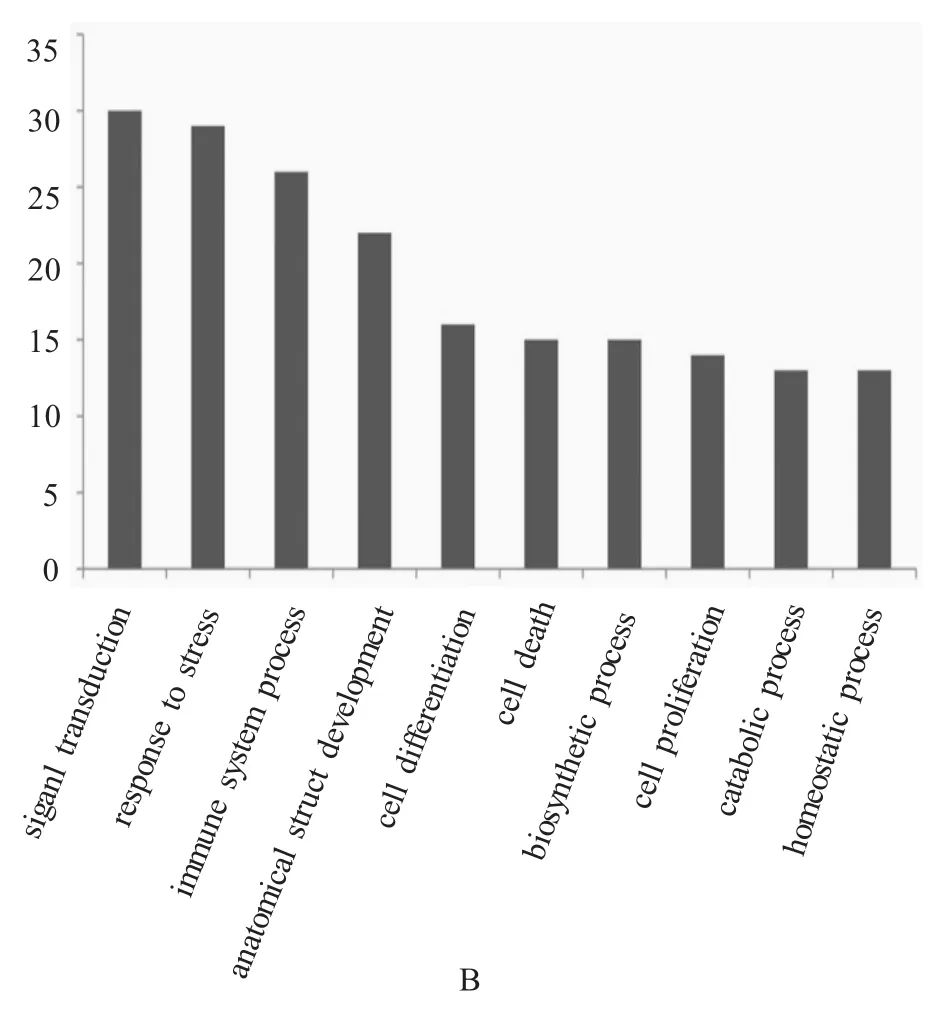
2.2 蛋白GO功能分析 在矽肺观察对象组和健康对照组中差异表达的蛋白利用软件Blast 2GO进行功能注释和分析[14]。对鉴定出的蛋白按照3大类功能进行富集分析,包括生物学处理、细胞组分和分子功能。从分子生物功能类别看,在矽肺观察对象组和健康对照组中差异表达的蛋白主要参与离子结合、酶活性等分子生物学功能。其中前5名的富集功能为离子结合,信号转导活性,酶调节活性,肽酶活性和酶结合(图2A)。从生物学过程的分类分析,这些差异表达的蛋白主要参与信号转导、免疫反应、细胞分化等生物过程。排列前6名的功能类别为信号转导,压力反应,免疫系统过程,解剖结构的发展,细胞分化和细胞死亡(图2B)。通过细胞组分类别的富集分析,排列前6名的为胞外区,细胞器,质膜,蛋白复合体,细胞组分和内质网(图2C)。
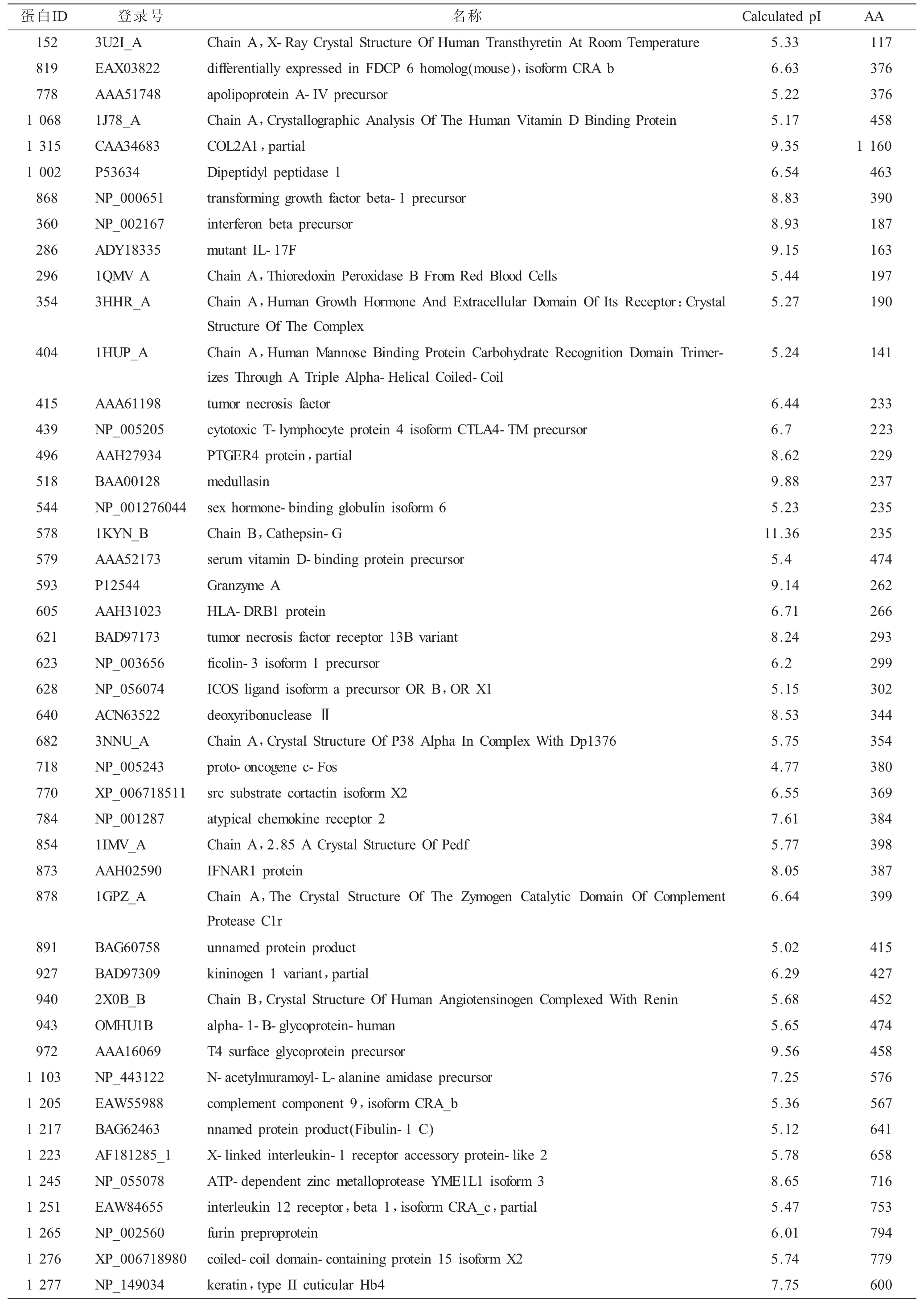
表1 矽肺早期(观察对象组)与健康对照组差异表达的蛋白
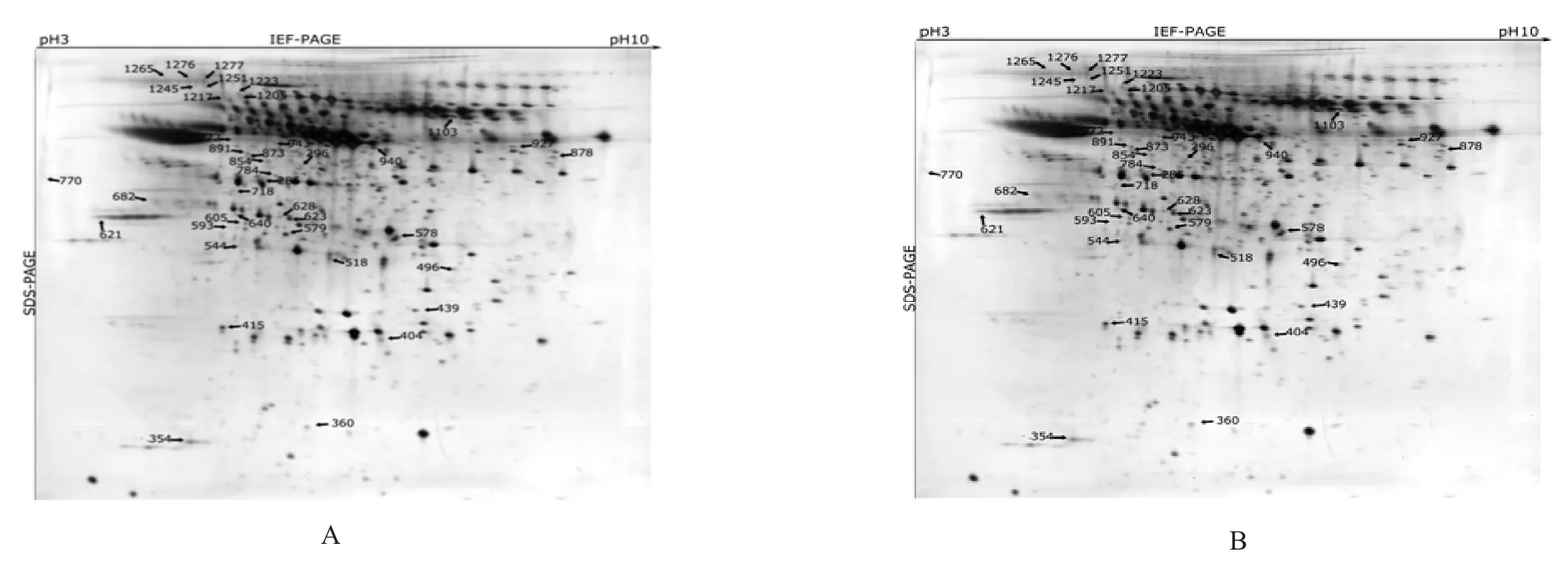
图1 来源于矽肺观察对象组和健康对照组的血清样本经双向电泳IPG(17 cm,pH 3-10L)和垂直电泳分析的扫描结果图。A:在矽肺观察对象组中高表达的蛋白;B:在健康对照组中高表达的蛋白

图2 矽肺观察对象组与健康对照组之间差异表达的蛋白利用GO功能分析后的功能富集图。A:差异表达的蛋白在分子生物学功能类别中的功能富集分析图;B:差异表达的蛋白在生物学处理过程中的功能富集分析图;C:差异表达的蛋白在细胞组分中的功能富集分析图
3 讨论
矽肺是因吸入二氧化硅颗粒而引起的严重的肺部功能性损伤,表现为持续的炎性反应和肺部弥漫性纤维化。观察对象短期接触高浓度的粉尘或低浓度长期接触的职业性危害因素,当时无明显临床表现或仅有轻度相应的症状而未能确诊为职业病,需作进一步医学监护。目前矽肺的发病机制仍不清楚,并且在发展早期缺少有效的检测手段。我们通过研究矽肺观察对象组与非接触粉尘之间的蛋白谱变化,从而初步探索矽肺早期诊断标志物。
细胞因子是一大类由免疫细胞释放的蛋白分子,参与细胞信号调控、免疫反应过程。本研究发现多种细胞因子在矽肺观察对象组中高表达,例如干扰素β前体、肿瘤坏死因子等(图1A,表1)。肿瘤坏死因子、白介素、干扰素及转化生长因子在肺部组织纤维化中起重要作用,这些相关细胞因子的持续表达可活化成纤维细[4,15-16]。本研究发现肿瘤坏死因子、干扰素β前体、突变IL-17F在矽肺观察对象组中高表达(图1,表1)。干扰素γ和致炎症剂例如IL-10能够刺激上调一氧化氮的产生[17],ROS和RNS诱导肺部表皮细胞炎性损伤[4]。IL1及肿瘤坏死因子能够刺激多种炎症和免疫反应例如T细胞增殖、活化及炎性细胞脱粒。肿瘤坏死因子受体超家族13B基因(TNFRSF13B)翻译的蛋白主要在一些B细胞亚组表面表达,结合TNF受体后具有B淋巴细胞分化调控功能,在体液反应过程中发挥重要作用[18-19]。TNFRSF13B编码变化与免疫缺陷密切相关,促进疾病的发生。肿瘤坏死因子13B variant(TNFR13BV)在矽肺观察对象组中高表达,提示TNFR13BV可能参与矽肺的发生过程中的免疫反应,起着重要的作用。趋化因子是一类单链小分子的蛋白质超家族,在多种免疫和炎症反应中起着关键作用。非典型趋化因子受体不偶联经典G蛋白信号通路,但可有效地内化同源趋化因子配基并使其降解[20]。这些在矽肺观察对象组中表达上调的蛋白可能参与炎症的起始和维持,并启动成纤维细胞的活化,在矽肺的早期发展中扮演重要的角色。
白介素1受体辅助蛋白(IL1AR1)在白介素33诱导的T淋巴细胞和肥大细胞的活化中起着重要作用。白介素1受体辅助蛋白也参与X联锁智力低下与神经钙感应1相互作用的过程[21-22]。X联锁白介素1受体辅助蛋白样2(IL1RAPL2)参与X联锁的神经退化[23],与健康对照组相比较,IL1RAPL2在矽肺观察对象组中表达水平升高(表1),说明其可能在矽肺的早期发展过程中有调节神经信号通路的作用。相对非接触粉尘,人生长激素胞外区受体在矽肺观察对象组中表达上升(图1,表1)。生长激素结合受体后通过相关的信号传导调节生长和发育[24]。生长激素胞外区受体可能通过正调控多细胞机体、AK或JAK-STAT级联调控的生长激素信号通路参与矽肺早期的发展。
角蛋白Ⅱ型表皮Hb4(KRT4)是由角蛋白基因家族编码参与细胞骨架的结构组成、角质形成细胞分化等过程。角蛋白Ⅱ型表皮Hb4在类风湿自身免疫疾病中高表达[25]。本研究发现KRT4在矽肺观察对象组中高表达(表1,图1),提示其可能参与矽肺疾病的早期发展。
载脂蛋白通过淋巴和血液循环系统运输脂类物质,并且参与脂类蛋白的代谢调控。载脂蛋白A-Ⅳ前体在矽肺观察对象组中表达水平下调(表1,图1),说明该蛋白的表达变化可能与矽肺早期的脂类代谢改变有一定关系。载脂蛋白A-Ⅳ基因与A-Ⅰ和C-Ⅲ相连,位于A-Ⅰ下游14kb位置,研究表明3个基因有一定的调控关系[26]。载脂蛋白A-Ⅳ参与调控多种代谢通路包括脂类吸收、转运及代谢,在预防动脉粥样硬化中有重要作用。该蛋白可能受营养物质、胆道复合体、药物、激素等因子的影响。此外,载脂蛋白A-Ⅳ前体也在自身免疫疾病如类风湿性关节炎中表达升高[27]。
糖蛋白(glycoprotein)是由共价相连的分支寡糖链和多肽链构成的复合糖,具有生物识别、信号在细胞间传递等功能。KL-6(Krebs von den lungen-6)是第9族肺组织细胞抗原的高分子量糖蛋白,主要位于Ⅱ型肺泡上皮细胞等处,是重要的纤维化肺疾病的标志物[28]。KL-6在小气道上皮细胞衬液表达水平上调可引起纤维化肺部疾病的肺泡内纤维化[29]。本研究发现α1B糖蛋白和T4表面糖蛋白前体在矽肺观察对象组显著上调(表1,图1)。α1B糖蛋白参与多种疾病如子宫内膜癌、宫颈癌等[30-31]。该蛋白在肝纤维化矽肺观察对象表达上调,且可作为无创诊断区分健康患病的手段[32]。T4表面糖蛋白前体参与T细胞共刺激、正调控白介素2生物合成过程、T细胞受体复合物、胞外机制结构组成、先天性免疫反应、转膜受体蛋白酪氨酸酶信号通路等。α1B糖蛋白和T4表面糖蛋白前体在矽肺观察对象组中的显著上调提示该两类蛋白可能通过生物识别、纤维化信号通路的刺激等方式参与矽肺早期的发展,可考虑深入研究作为矽肺早期诊断标志物的可行性。
颗粒酶具有丝氨酸蛋白酶活性,由毒性T细胞及自然杀伤细胞的胞质粒分泌。颗粒酶A可导致细胞凋亡或死亡、线粒体内膜减少及ROS的释放。受ROS刺激,内质网相关SET复合体转移到细胞核后,颗粒酶A剪切参与DNA修复的SET复合体的三个组分[33]。颗粒酶A可能影响核纤层蛋白和组蛋白H1,这对核膜稳定性和染色体结构维持有重要意义,有利于DNA酶活性[33]。在特发性肺部纤维化矽肺观察对象和博来霉素处理后的小鼠单核细胞浸润淋巴细胞中发现颗粒酶B表达上调[34]。本研究结果中颗粒酶A在矽肺观察对象组中表达水平升高(表1),提示颗粒酶A有可能通过影响T细胞增加和活化而提高细胞毒性对抗二氧化硅吸入后的反应,在矽肺发展的早期有重要作用。
组织蛋白酶G属于丝氨酸酶类,是嗜天青颗粒蛋白重要组成部分,在炎症的嗜中性功能中起着重要作用,降解胞外基质组分和细胞因子等。组织蛋白酶G可能是维持嗜中性介导的急性组织病理极其缺血肾脏再灌注损伤后的纤维化重要组成部分[35]。本研究发现组织蛋白酶G链B在矽肺观察对象组中表达水平升高(表1),说明组织蛋白酶G可能在矽肺发展的早期参与免疫反应,是一个潜在的早期诊断标志物。
弗林蛋白是存在于真核生物细胞中一种重要的内切蛋白酶,具有重要的生物学功能,参与多种疾病的发生和发展。该酶在内质网-高尔基体中经两次自剪切活化后,能够识别特定的氨基酸序列,对分泌过程中多种重要的蛋白及多肽前体进行剪切加工,使之具有生物活性[36]。弗林蛋白酶有多种类型的底物,包括生长因子、蛋白受体、基质金属蛋白酶、黏附分子及某些病毒包装糖蛋白等。基质金属蛋白酶有助于急性和慢性矽肺发生,并且基质金属蛋白酶的失衡可能导致胞外基质重建以及基底膜的破坏[37-38]。弗林前蛋白原在矽肺观察对象组中表达升高(相对健康对照组),可能通过对相关蛋白的选择性剪切修饰参与矽肺的早期发生。弗林蛋白在矽肺的早期诊断上有潜在的参考和应用价值。
综上所述,本研究发现α1B糖蛋白和T4表面糖蛋白前体在矽肺观察对象组中高表达,可能参与胞外基质的构建和免疫反应的调控。丝氨酸蛋白酶相关的颗粒酶A在矽肺观察对象组中表达升高,可能通过T细胞的活化等过程影响矽肺早期的细胞毒性和外源物的清除。二氧化硅长期吸入后,组织蛋白酶G和弗林前蛋白原在矽肺观察对象组表达量升高,可能参与早期的蛋白或多肽的剪切等过程,从而影响一系列的免疫反应。多种细胞因子如肿瘤坏死因子、干扰素β前体、白介素6等在矽肺观察对象组中表达上升,可能直接参与免疫反应和调控,并且在持续的免疫反应中起维持作用。本研究中的蛋白表达谱在矽肺观察对象组和健康对照组中的显著变化的结果为早期矽肺发展机制提供了蛋白谱研究基础,为矽肺早期的临床诊断提供了多种潜在的蛋白标志物。
[1]Fubini B,Hubbard A.Reactive oxygen species(ROS)and reactive nitrogen species(RNS)generation by silica in inflammation and fibrosis[J].Free Radical Biology Medicine,2003,34(12):1507-1516.
[2]Hata J,Aoki K,Motsuhashi H,et al.Change in location of cytokine-induced neutrophilchemoattractants(CINCs)in pulmonary silicosis[J].Exp Mol Pathol,2003,75(1):68-73.
[3]Craighead JE.Diseases associated with exposure to silica and nonfibrous silicate minerals,silicosis and silicate disease committee[J].Arch Pathol Lab Med,1998,112(7):673-720.
[4]Mossman BT,ChurgA.Mechanismsin thepathogenesisof asbestosis and silicosis[J].Am J Respir Crit Care Med,1998,157(51):1666-1680.
[5]Lesur O.Alterations of surfactant lipid turnover in silicosis:evidence of a role for surfactant-associated protein A(SP-A)[J].Int J Exp Pathol,1995,76(4):287-298.
[6]Rom WN.Characterization of the lowerrespiratory tractinflammation ofnonsmoking individuals with interstitiallung diseaseassociated with chronicinhalation of inorganicdusts[J].Am Rev Respir Dis,1987,136(6):1429-1434.
[7]Blackford JA.Intratrachealinstillation ofsilica up-regulates inducible nitric oxide synthase gene expression and increases nitric oxide production in alveolar macrophages and neutrophils[J].Am J Respir Cell Mol Biol,1994,11(4):426-431.
[8]Battegay EJ,Raines EW,Seifert RA,et al.TGF-beta induces bimodalproliferation ofconnective tissue cells via complex control of an autocrine PDGF loop[J].Cell,1990,63(3):515-524.
[9]DriscollKE.TNF alpha and increased chemokine expression in rat lung after particle exposure[J].Toxicol Lett,1995(82):483-489.
[10]Savici D.Silica increases tumor necrosis factor(TNF)production,in part,by upregulating the TNF promoter[J].Exp Lung Res,1994,20(6):613-625.
[11]Link AJ,LaBaer J.Trichloroacetic acid(TCA)precipitation of proteins[J].Cold Spring Harb Protoc,2011(8):993-994.
[12]Perkins DN.Probability-based protein identification by searching sequence databasesusing massspectrometry data[J].Electrophoresis,1999,20(18):3551-3567.
[13]Conesa A.Blast2GO:a universal tool for annotation,visualization and analysis in functionalgenomics research[J].Bioinformatics,2005,21(18):3674-3676.
[14]Gotz S.High-throughput functional annotation and data mining with the Blast2GO suite[J].Nucleic Acids Res,2008,36(10):3420-3435.
[15]Perdue TD,Brody AR.Distribution oftransforming growth factor-beta 1,fibronectin,and smooth muscle actin in asbestos-induced pulmonary fibrosis in rats[J].J Histochem Cytochem,1994,42(8):1061-1070.
[16]Matsuzaki H,Maeda M,Lee S,et al.Asbestos-induced cellular and molecular alteration of immunocompetent cells and their relationship with chronic inflammation and carcinogenesis[J].J Biomed Biotechnol,2012(10):492-608.
[17]Thomas Gl.Asbestos fibers and interferon-gamma up-regulate nitric oxide production in rat alveolar macrophages[J].Am J Respir Cell Mol Biol,1994,11(6):707-715.
[18]MackayF,SchneiderP.TACI,an enigmaticBAFF/APRIL receptor,with new unappreciated biochemical and biological properties[J].Cytokine Growth Factor Rev,2008,19(3-4):263-276.
[19]SazziniM,ZuntiniR,Farjadian S,etal.An evolutionary approach to the medical implications of the tumor necrosis factorreceptorsuperfamilymember13B(TNFRSF13B)gene[J].Genes Immun,2009,10(6):566-578.
[20]Graham GJ.D6 and the atypical chemokine receptor family:novel regulators of immune and inflammatory processes[J].Eur J Immunol,2009,39(2):342-351.
[21]Ali S,Huber M,Kollewe C,et al.IL-1 receptor accessory protein is essential for IL-33-induced activation of T lymphocytes and mast cells[J].Proc Natl Acad Sci USA,2007,104(47):18660-18665.
[22]BahiN.IL1 receptoraccessory protein like,a protein involved in X-linked mental retardation,interacts with NeuronalCalcium Sensor-1 and regulatesexocytosis[J].Hum Mol Genet,2003,12(12):1415-1425.
[23]FerranteMI.IL1RAPL2mapsto Xq22and isspecifically expressed in the central nervous system[J].Gene,2001,275(2):217-221.
[24]De Vos AM,Ultsch M,Kossiakoff AA.Human growth hormone and extracellular domain of its receptor:crystal structure of the complex[J].Science,1992,255(5042):306-312.
[25]Chang X,Zhao Y,Wang Y,etal.Screening citrullinated proteins in synovialtissues ofrheumatoid arthritis using 2-dimensional western blotting[J].J Rheumatol,2013,40(3):219-227.
[26]Elshourbagy NA.The nucleotide and derived amino acid sequence of human apolipoprotein A-IV mRNA and the close linkage of its gene to the genes of apolipoproteins A-I and C-Ⅲ[J].J Biol Chem,1986,261(5):1998-2002.
[27]Li TW,Zheng BR,Huang ZX,et al.Screening disease-associated proteins from sera of patients with rheumatoid arthritis:a comparative proteomic study[J].Chin Med J(Engl),2010,123(5):537-543.
[28]Kohno N.Serum marker KL-6/MUC1 for the diagnosis and managementofinterstitialpneumonitis[J].J Med Invest,1999,46(3-4):151-158.
[29]HirasawaY.KL-6,ahumanMUC1mucin,ischemotactic for human fibroblasts[J].Am J Respir Cell Mol Biol,1997,17(4):501-507.
[30]Abdul-Rahman PS,Lim BK,Hashim OH.Expression of high-abundance proteins in sera of patients with endometrial and cervical cancers:analysis using 2-DE with silver staining and lectin detection methods[J].Electrophoresis,2007,28(12):1989-1996.
[31]CanalesNA,Marina VM,Castro JS,etal.A1BG andC3 are overexpressed in patients with cervical intraepithelial neoplasia Ⅲ[J].Oncol Lett,2014,8(2):939-947.
[32]Qin S,Zhou Y,Lok AS,et al.SRM targeted proteomics in search for biomarkers of HCV-induced progression of fibrosis to cirrhosis in HALT-C patients[J].Proteomics,2012,12(8):1244-1252.
[33]Lieberman J,Fan Z.Nuclearwar:the granzyme A-bomb[J].Curr Opin Immunol,2003,15(5):553-559.
[34]Miyazaki H.The perforin mediated apoptotic pathway in lung injury and fibrosis[J].J Clin Pathol,2004,57(12):1292-1298.
[35]ShimodaN,FukazawaN,NonomuraK,etal.Cathepsing is required for sustained inflammation and tissue injury after reperfusion of ischemic kidneys[J].Am J Pathol,2007,170(3):930-940.
[36]Rockwell NC,Krysan DJ,Komiyama T,et al.Precursor processing by kex2/furin proteases [J].Chem Rev,2002,102(12):4525-4548.
[37]Langley RJ,Mishra NC,Pe a-Philippides JC,et al.Fibrogenic and redox-related but not proinflammatory genes are upregulated in Lewisratmodelofchronic silicosis[J].J Toxicol Environ Health A,2011,74(19):1261-1279.
[38]Perez-Ramos J.Matrix metalloproteinases 2,9,and 13,and tissue inhibitors of metalloproteinases 1 and 2 in experimental lung silicosis[J].Am J Respir Crit Care Med,1999,160(4):1274-1282.
Objective To study mainly the change analysis of proteomic expression profile between silicosis objects of observation and healthy people,so as to investigate the protein biomarkers of silicosis in early stage.Methods 10 samples from observation objects of silicosis and 10 healthy people were collected and performed by two-dimensional electrophoresis to screen protein with differential expression,and then mass spectrum identification was analyzed.Results Compared with non-dust contact healthy people,39 up-regulated proteins and 7 down-regulated proteins with more than twice of differential expression were successfully identified.In observation objects of silicosis,down-regulated proteins showed transforming growth factor βprecursor,dipeptidyl peptidase 1,and apolipoprotein A-Ⅳ precursor,and up-regulated proteins showed interferon β precursor,tumor necrosis factor,Furin proteinase,deoxyribonuclease Ⅱ ,glycoprotein,granzyme A and chemokine receptor.Conclusion These differently expressed protein factors are mainly involved in immune regulation,cytotoxicity,and metabolism,which plays an important role in the early development of silicosis through immunoreaction and proteinase activity.The results provide some potential protein molecular targets for early clinical diagnosis of silicosis,which are helpful for further study and application of markers of silicosis in early stage.
Observation objects;Occupational disease;Fibrosis;Cell factor;Protein markers
2015-07-18)
1005-619X(2015)09-0906-07
10.13517/j.cnki.ccm.2015.09.003
214000 无锡市第八人民医院(缪荣明,张颖轶,吴为民,房中华,赵锐);214000 江苏省疾病预防控制中心(丁帮梅);214000 无锡市慈善医院(夏倩,李永)
江苏省委组织部333人才基金项目(BRA2013041);江苏省六大人才高峰资助项目(2014-WSN-063);无锡市科技发展资金项目(CSE31N1327)
缪荣明

