枯草芽孢杆菌发酵米渣制备抗氧化肽发酵工艺条件的优化*
廖卢艳,张 喻
(湖南农业大学 a.东方科技学院;b.食品科学技术学院,湖南长沙410128)
枯草芽孢杆菌发酵米渣制备抗氧化肽
发酵工艺条件的优化*
廖卢艳a,b,张喻b*
(湖南农业大学 a.东方科技学院;b.食品科学技术学院,湖南长沙410128)
以生产淀粉糖的副产物米渣为原料,采用枯草芽孢杆菌液态发酵法制备米渣抗氧化肽。在单因素试验的基础上,以发酵产物的还原力为指标,进行正交试验设计,研究发酵时间、发酵温度、接种量和料液比等因素对米渣抗氧化肽抗氧化活性的影响,对发酵制备工艺条件进行工艺优化。结果表明,最大还原力的发酵工艺条件为发酵时间48 h,温度30℃,接种量5%,料液比1∶4,此时还原力达1.907。
枯草芽孢杆菌;发酵;还原力;米渣;抗氧化肽
doi:10.3969/j.issn.1007-7146.2015.04.012
长期以来,稻米生产以及副产物的综合利用一直受到高度关注。稻米经生产加工后剩下的大量副产物如米渣、稻壳、米糠、碎米等,国内外有大量的文献报道对这些大米副产物综合利用的研究[1-3]。以大米为原料生产淀粉糖、谷氨酸、柠檬酸、乳酸及生化药品等产品时,大米粉经液化或糖化后会产出副产品--米渣,由于大量淀粉已被利用,米渣中蛋白质得到浓缩,蛋白质含量高达40%~60%,是宝贵的蛋白质资源。据资料显示在大米淀粉糖的生产过程中每消耗7吨大米就要产出1吨米渣[4]。若能将这些大米蛋白资源用于大米蛋白活性肽、浓缩蛋白、分离蛋白等产品的开发利用,将极大地提高米渣的附加值,带来可观的经济效益。
近年来,利用酶法制备大米抗氧化肽的研究比较多[5-6],但利用发酵法制备米渣蛋白活性肽的研究很少,对米渣蛋白抗氧化肽的研究也鲜见,而对玉米和豆类蛋白活性肽已有相当数量的研究报道[7-9]。微生物发酵法作为一种新的制备抗氧化肽的方法,有其良好的优越性[10-12]:微生物蛋白酶来源广、酶产量高、生产周期短、生产成本低。目前,文献报道发酵法的方法制备抗氧化肽不多,仅有少数几篇[13-16]。由此可见,研究枯草芽孢杆菌发酵米渣有着重要的作用和意义,以发酵产物的还原力为指标,通过对发酵条件的不断优化,以期为微生物发酵法在制备大米抗氧化肽工艺中的应用奠定基础。
1 材料和方法
1.1试验材料和培养基
种子培养基:蛋白胨3 g,NaCl 0.5 g,牛肉膏0.5 g,葡萄糖0.1 g,水100 mL,pH 7.2。121℃下灭菌20 min,冷却待用。
发酵培养基:米渣,NaCl 0.5 g,葡萄糖0.1 g,水100 mL。121℃下灭菌20 min,冷却待用。
1.2主要仪器与设备
立式灭菌锅:LMQ.CJ山东新华医疗器械股份有限公司;紫外分光光度计:UV-18000 Spectrophotometer上海美谱达仪器有限公司:电子天平:BS224S北京赛多利斯仪器有限公司。水浴恒温振荡器:SHZ-82上海浦东物理光学仪器厂;电热恒温鼓风干燥箱: 101A-3ET上海试验仪器厂有限公司;HH-8型数显恒温水浴锅:上海浦东物理光学仪器厂;SW-CJ-1FD型单人单面净化工作台:苏州净化设备有限公司;生化培养箱:上海新苗医疗器械有限公司;高速多功能粉碎机:上海冰都电器有限公司。
1.3试验方法
1.3.1制备米渣抗氧化肽的工艺流程 米渣→粉碎→过筛→接种→发酵→离心分离→冷冻干燥并保存样品→抗氧化活性测定
1.3.2枯草芽孢杆菌生长曲线的制备 将保藏完好的枯草芽孢杆菌斜面菌种接种于斜面培养基,32℃培养24 h,进行菌种活化;将活化好的枯草芽孢杆菌斜面菌种单菌落接入灭菌后的种子液体培养基中,30℃恒温振荡培养,采用比浊法测定,用枯草芽孢杆菌菌种未接种的种子液体培养基作空白,在波长600 nm条件下,分别测定在6、12、18、24、30、36、42、48 h时的吸光度;以培养时间为横坐标,吸光度为纵坐标,制作枯草芽孢杆菌生长曲线图。
(2)学生活动时间长不等于学生的参与度高,关键要看学生活动中动脑和动手是不是相辅相成,是不是统一的整体.在思路5中,得到α2-α1=90° 后,教师提示“既然求角的正切值行不通,那么求余弦值会怎样?大家试一试.”和教师提示“既然求角的正切值行不通,大家看看有没有其他办法?”两种提示下,学生都要动手尝试,但前者只是被动的活动,学生思维并没有真正参与,“为什么求余弦”这个重要的“思维起点”被忽视了;后者则是脑与手联动,如果学生自己意识到求余弦时,动手的活动就具有思维的含量了,如果多数学生意识不到,那么教学重心应放在引导学生发现“求余弦”上.总之,不要让学生成为验证教师想法的工具.
1.3.3米渣抗氧化肽的制备方法 将保藏完好的枯草芽孢杆菌斜面菌种接种于斜面培养基,32℃培养24 h,进行菌种活化;将活化好的枯草芽孢杆菌斜面菌种单菌落接入灭菌后的种子培养基中,30℃恒温振荡培养24 h,种子发酵液的含菌量为107-108 cfu/mL;将得到的种子液培养基以4%-8%的接种量接入装有300 mL发酵培养基的1 000 mL三角瓶,发酵温度28-36℃,培养12-60 h;菌株发酵液在100℃下灭酶10 min,待发酵液冷却至室温以4 000 r/min离心10 min去除菌体和未发酵的米渣残渣,得到发酵上清液。取上清液经0.45 μm微孔滤膜过滤,并把滤过液进行浓缩,冷冻干燥,冻干至粉末状,即得产品为米渣蛋白抗氧化肽。
1.3.4米渣抗氧化肽抗氧化活性的测定 抗氧化剂是通过自身的还原给出电子而清除自由基的,还原力越强,抗氧化性越强,因此可通过测定还原力来说明抗氧化活性的强弱[13]。还原性测定[14]方法如下:用蒸馏水将各粉末状米渣抗氧化肽配制成1 mg/mL的抗氧化肽溶液。取抗氧化肽水溶液2 mL,加入磷酸盐缓冲溶液(0.2 mol/L,pH=6.6)5 mL和1%铁氰化钾5 mL,置于50℃水浴中反应20 min,然后加入10%的三氯乙酸10 mL,经充分混合后以3 000 r/min离心10 min。吸取上清液5 mL,加入5 mL蒸馏水和1 mL 0.1%的三氯化铁溶液,在700 nm处测定吸光值,吸光值增加表明还原力增强。
1.3.5单因素试验 在固定条件:料液比1∶3(g/ mL)、接种量5%、发酵温度32℃、发酵时间48 h进行单因素试验,采用枯草芽孢杆菌发酵米渣制备抗氧化肽,将发酵粗提物浓缩冷冻干燥成粉末状米渣抗氧化肽并配制成1 mg/mL的抗氧化肽溶液,取抗氧化肽水溶液2 mL进行还原力测定。分别考察料液比为1∶3、1∶4、1∶5、1∶6、1∶7;接种量为3%、4%、5%、6%、7%;发酵时间为12 h、24 h、36 h、48 h、60 h;发酵温度为30℃、32℃、34℃、36℃、38℃条件下对制备的米渣抗氧化肽还原力的影响。
1.3.6正交试验设计 在单因素研究基础上,采用枯草芽孢杆菌发酵米渣,以发酵产物的还原力为指标,用正交实验优化出最佳的料液比、接种量、发酵温度和发酵时间。如表1所示。
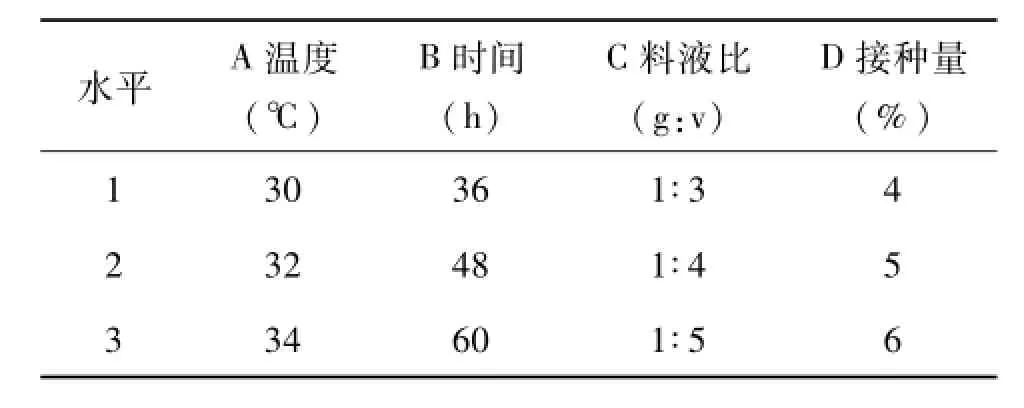
表1 发酵条件优化试验因素水平表Tab.1 Fermentation test factors and levels
2 结果与分析
2.1枯草芽孢杆菌生长曲线
通过采用比浊法测定枯草芽孢杆菌生长中不同时段的吸光度,可以得到枯草芽孢杆菌的生长曲线,见图1。由图1可见,枯草芽抱杆菌接种后30 h达最大吸光度,在这之前生长速度提高较快,36 h以后随着液体培养基中营养物质消耗,枯草芽孢杆菌生长开始进入稳定期。所以枯草芽孢杆菌种子液以培养24 h接种比较合适。

图1 枯草芽孢杆菌生长曲线Fig.1 Growth curve of Bacillus subtilis
2.2单因素试验的结果与分析
2.2.1料液比对发酵制备的米渣抗氧化肽还原力的影响 由图2可知,料液比对枯草芽孢杆菌发酵米渣制备的抗氧化肽还原力有显著的影响。随着料液比不断的增大,发酵液的吸光度值不断减小,表明米渣抗氧化肽的还原能力呈下降趋势,料液比为1∶3时,枯草芽孢杆菌发酵米渣制备的抗氧化肽的还原能力最强,吸光度为1.621。但是并不是料液比越小越好,若料液比继续减小,米渣发酵不充分,造成米渣资源浪费。故选择料液比1∶4左右为宜。

图2 料液比对发酵制备米渣抗氧化肽还原力的影响Fig.2 Effect of solid-liquid ratio on the reducing power of rice residue antioxidant peptides
2.2.2接种量对发酵制备的米渣抗氧化肽还原力的影响 由图3可知,接种量5%时,米渣抗氧化肽的还原能力最强,吸光度值为1.724。接种量过高或过低都会导致米渣抗氧化肽还原力的降低。当接种量过高,但是发酵培养基中营养物质有限,不能满足枯草芽孢杆菌生长的需要,从而导致米渣抗氧化肽的还原能力下降。当接种量过低时,米渣不能被充分分解,不仅还原力下降,还导致资源浪费。故接种量5%左右最合适。
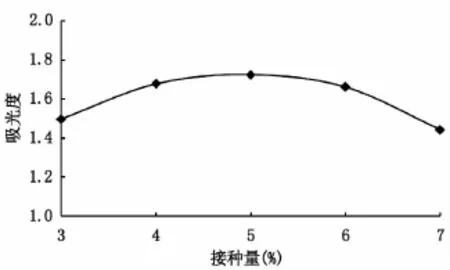
图3 接种量对发酵米渣制备抗氧化肽还原力的影响Fig.3 Effect of inoculation quantity on the reducing power of rice residue antioxidant peptides
2.2.3 发酵时间对制备的米渣抗氧化肽还原力的影响 由图4可知,随着发酵时间的增加,发酵产物米渣抗氧化肽的还原能力呈逐渐上升趋势,发酵48 h后米渣抗氧化肽的还原能力下降。当发酵时间为48 h时,米渣抗氧化肽的还原能力最强,吸光度值为1.647。这说明适宜的发酵时间有利于产生较强还原能力的米渣抗氧化肽。有可能原因是在适宜的发酵时间下,蛋白质的分解会产生大量的短肽产物,但随着发酵时间增加,具有还原能力的短肽会被进一步水解,使其还原能力降低或者完全丧失;也有可能发酵时间的延长会使蛋白酶解程度的加剧,会有一些没有明显还原能力的肽段从蛋白中释放出来,导致具有还原能力的肽段在发酵产物中的比例下降[11]。因此,随着发酵时间增加,而发酵产物的还原能力却呈现下降的趋势。故选择发酵时间48 h左右为宜。

图4 发酵时间对发酵米渣制备抗氧化肽还原力的影响Fig.4 Effect of fermentation time on the reducing power of rice residue antioxidant peptides
2.2.4发酵温度对制备的米渣抗氧化肽还原力的影响 由图5可知,在一定范围内,随着温度升高,米渣抗氧化肽的还原力随之提高,但是温度超过32℃,米渣抗氧化肽的还原力有下降的趋势。当温度较低时,枯草芽孢杆菌产酶缓慢导致米渣抗氧化肽的抗氧化活性程度弱;但当温度过高时,影响枯草芽孢杆菌的生长。发酵温度为32℃时,米渣抗氧化肽的抗氧化活性最强,吸光度值为1.775。故选择枯草芽孢杆菌发酵温度为32℃左右为宜。
3 正交试验
3.1正交试验设计的结果与分析
根据表2中直观分析极差R值大小可以看出4因素影响枯草芽孢杆菌发酵米渣制备抗氧化肽的还原力主次关系依次为(R)C>A>D>B,说明料液比对制备的米渣抗氧化肽的还原力影响最大,其次依次为发酵温度、接种量、发酵时间。从表2中也可以看出枯草芽孢杆菌发酵米渣制备抗氧化肽各因素的最佳组合为A1B2C2D2,即发酵温度30℃、发酵时间48 h、料液比1∶4、接种量5%。

图5 发酵温度对发酵米渣制备抗氧化肽还原力的影响Fig.5 Effect of fermentation temperature on the reducing power of rice residue antioxidant peptides
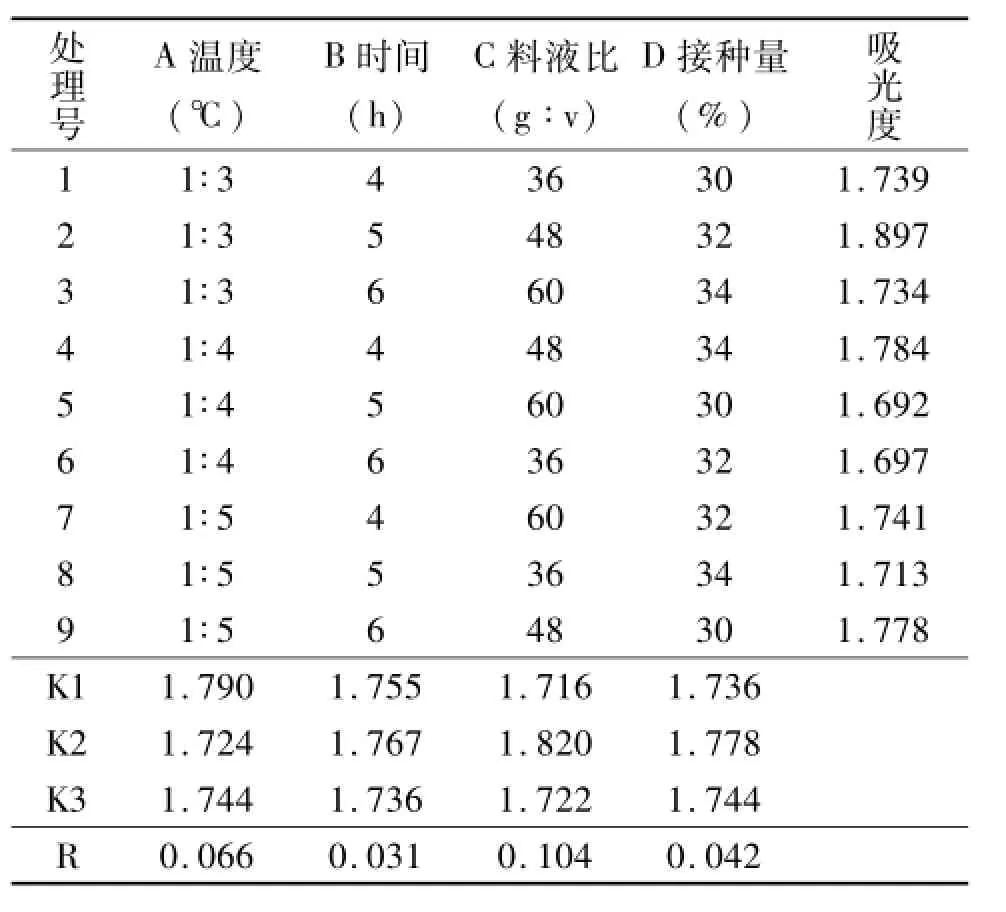
表2 正交试验结果Tab.2 The results of orthogonal test
3.2验证试验
在最佳工艺条件下,进行3组平行验证试验,吸光度分别为1.899、1.912、1.910,平均吸光度为1.907。彭地纬等人[5]运用响应面分析法对酶解米渣制备抗氧化肽的工艺进行优化,最大还原力达0.688。与之对比,在此优化工艺条件下,枯草芽孢杆菌发酵米渣制备抗氧化肽的还原能力强,验证了所选工艺的合理性和科学性。
4 结论
本试验采用枯草芽孢杆菌发酵米渣制备抗氧化肽,选取料液比、接种量、发酵时间及发酵温度四个最佳因素进行研究优化,以枯草芽孢杆菌发酵米渣制备的米渣抗氧化肽还原力为考核指标进行正交试验,结果表明:在料液比为1∶4(g∶v)、接种量为5%、时间为48 h、温度为30℃的条件下,制备的米渣抗氧化肽的还原力达1.907,表现出强的抗氧化活性。
[1] 朱斌昕.大米蛋白——大米中的含量,品质及分布[J].无锡轻工业学报,1986,5(3):67-73. ZHU Binxin.The content of rice protein,its quality and distribution in the rice[J].Journal of the Wuxi Institute of Light Industry,1986,5(3):67-73.
[2]张全才,熊华,曹银娣,等.米蛋白肽锌的制备工艺研究[J].食品科技,2008,33(2):110-113. ZHANG Quancai,XIONG Hua,CAO Yinti,et al.Evaluation of optimal parameters for preparating zinc chelate with peptides by enzymic of rice protein[J].Food Science and Technology,2008,33(2):110-113.
[3]陈望华,熊华,张明丽,等.米渣蛋白酶解及产物作微囊化壁材的工艺研究[J].粮食与饲料工业,2007(6):24-27. CHEN Wanghua,XIONG Hua,ZHANG Mingli,et al.Research on the technology for enzymolysis of rice dregs albumin and its products as microencapsulated wall material[J]. Cereal&Feed industry.2007(6):24-27.
[4]刘玉德,曹雁平.生物蛋白肽的开发研究展望[J].食品科学,2002,23(8):319-320. LIU Yude,CAO Yaoping.Research advance of biological protein peptides[J].Food Science and Technology,2002,23(8):319-320.
[5]彭地纬,熊华,赵强,等.米渣抗氧化肽制备工艺的研究[J].食品科技,2009(7):55-59. PENG Diwei,XIONG Hua,ZHAO Qiang,et al.Study on the preparation of antioxidant peptide from rice residue[J].Food Science and Technology,2009,2009(7):55-59.
[6]李绮丽,吴卫国.大米抗氧化活性肽的研究进展[J].粮食加工,2010(4):43-45. LI Qili,WU Weiguo.Research advance of rice antioxidation polypeptides[J].Grain Processing,2010(4):43-45.
[7]胡文琴,王恬,孟庆利.抗氧化活性肽的研究进展[J].中国油脂,2004,29(5):42-45. HU Wenqin,WANG Tian,MENG Qingli.Research advance of antioxidant bioactive peptides[J].China Oils and Fats,2004,29(5):42-45.
[8]张强,阚国仕,陈红漫.玉米抗氧化肽的分离制备及其体外抗氧化活性的研究[J].中国粮油学报,2006,20(5): 36-39. ZHANG Qiang,KAN Guoshi,CHEN Hongman,et al.Preparation of corn antioxidant peptide and study on its antioxidant activity in vitro[J].Chinese Cereals and Oils Association,2006,20(5):36-39.
[9]禚同友,丛建民.大豆生物活性肽的制备及其生物活性研究[J].中国酿造,2007,26(8):6-9. ZHUO Tongyou,CONG Jianmin.Research on preparation of soybean bioactive peptide and its bioactivity[J].China Brewing,2007,26(8):6-9.
[10] 张友维,张晖,王立,等.枯草芽孢杆菌发酵制备花生多肽及其自由基清除活力的研究[J].中国油脂,2011,36(10):25-29. ZHANG Youwei,ZHANG Hui,WANG Li,et al.Preparation of peanut peptides using Bacillus subtilis fermentation and their radical-scavenging activities[J].China Oils and Fats,2011,36(10):25-29.
[11]张友维.枯草芽孢杆菌发酵花生粕制备抗氧化肽的研究[D].江南大学,2012. ZHANG Youwei.Research on antioxidant peptides preparaed from fermented peanut meal by using Bacillus subtilis[D]. Jiangnan University,2007.
[12]于长青,赵学明,姚琨,等.高产蛋白酶芽孢杆菌的选育及其在大豆活性肽制备中的应用[J].中国农业大学学报,2005,10(1):34-37. YU Changqing,ZHAO Xueming,YAO Kun,et al.Mutagenesis of high yield protease spore-forming and its application in soy-peptide preparation[J].Journal of China Agricultural University,2005,10(1):34-37.
[13]STEINKRAUS K H.Classification of fermented foods:worldwide review of household fermentation techniques[J].Food Control,1997,8(5-6):311-317.
[14]TERLABIE N N,SAKYI-DAWSON E,AMOA-AWUA W K. The comparative ability of four isolates of Bacillu subtilis to ferment soybeans into dawadawa[J].International Journal of Food Microbiology,2006,106(2):145-152.
[15]CHUNG Y C,CHANG C T,CHAO W W,et al.Antioxidant activity and safety of 50%ethanolic extract from red bean fermented by Bacillus subtilis IMR-NK1[J].Journal of Agricultural and Food Chemistry,2002,50(8):2454-2458.
[16]ZHU Y P,FAN J F,CHENG Y Q,et al.Improvement of the antioxidant activity of Chinese traditional fermented okara(Meitauza)using Bacillus subtilis B2[J].Food Control,2008,19(7):654-661.
Optimized Fermentation Conditions for Research on Antioxidant Peptides Prepared from Fermented Rice Residue by Using Bacillus subtilis
LIAO Luyan1,2,ZHANG Yu2*
(Hunan Agricultural University a.College of Orient Science and Technology;b.College of Food Science and Technology,Changsha 410128,Hunan,China)
The rice residue was fermented with Bacillus subtilis to prepare rice residue antioxidant peptides.The effects of fermentation time,fermentation temperature,inoculation quantity and solid-liquid ratio on the reducing power of rice residue antioxidant peptides were investigated.The results showed that the optimal condition was:fermentation time 48 h,fermentation temperature 30℃,inoculation quantity 5%and solid-liquid ratio 1∶4.Under the condition,the reducing power of rice residue antioxidant peptides was 1.907,which shows strong anti oxidation.
Bacillus subtilis;fermentation;reducing power;rice residue;antioxidant peptides
TS210.9
A
1007-7146(2015)04-0368-05
2014-12-16;
2015-01-31
湖南省教育厅一般项目(14C0566)
廖卢艳(1982-),女,湖南岳阳人,实验师,在读博士,研究方向为粮食深加工及开发利用。(电子邮箱)120425073@qq.com
张喻(1972-),女,湖南益阳人,教授,博士,主要研究方向为粮食深加工及开发利用。(电子邮箱)skxzhangyu@163.com

