卡培他滨联合吉西他滨或长春瑞滨治疗复发转移性乳腺癌的疗效观察
王英哲,司 文,令狐锐霞,张兴洋,吉铁凤,赵冬梅,杨俊兰解放军总医院 肿瘤内科,北京 00853;南开大学医学院,天津 30007
目前,晚期乳腺癌患者的5年生存率仅为20%左右,肿瘤的复发转移仍是晚期乳腺癌患者的主要死亡原因[1]。虽然内分泌治疗和靶向治疗对部分激素受体阳性和Her-2阳性的晚期乳腺癌患者有良好的疗效,但化疗仍然是晚期乳腺癌患者治疗的重要方法[2]。已有多项临床研究奠定了蒽环类药物与紫杉类药物在晚期乳腺癌患者治疗中的重要地位[3-6],但部分患者在应用其化疗后短期内即出现耐药,发生肿瘤的复发或进展。卡培他滨、吉西他滨与长春瑞滨均为其后续治疗中可选择的化疗药物,其中卡培他滨联合长春瑞滨(NX)方案与吉西他滨联合卡培他滨(GX)方案应用时均有一定的协同增效作用[7-8]。本研究回顾性研究了我院收治的75例复发转移后曾行GX或NX方案治疗的晚期乳腺癌患者,拟探讨两方案在晚期乳腺癌患者治疗中的疗效。
对象和方法
1 研究对象 本研究纳入2008年1月1日- 2014年5月1日解放军总医院收治的所有女性晚期乳腺癌患者中接受GX和NX方案治疗的病例。所有患者均经病理证实为乳腺癌,根据实体瘤的疗效评价标准1.1版(RECIST 1.1)至少有1个靶病灶,美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)活动状态评分0 ~ 2分,预期生存时间≥3个月。
2 治疗方案 两组均采用3周治疗方案。GX方案组:吉西他滨1 000 mg/m2,静滴,d1、d8;卡培他滨2 000 mg/m2,分早晚两次口服,d1 ~ d14。NX方案组:长春瑞滨25 mg/m2,静滴,d1、d8;卡培他滨2 000 mg/m2,分早晚两次口服,d1 ~d14。每2周期复查靶病灶情况,化疗4 ~ 6周期后根据患者病情选择继续化疗或口服卡培他滨2 000 mg/m2,分早晚两次口服,d1 ~ d14维持治疗,直至疾病进展或出现不能耐受的不良反应。
3 观察指标 1)客观有效率(objective response rate,ORR):达到完全缓解(CR)与部分缓解(PR)的患者占治疗患者的比例;2)疾病控制率(disease control rate,DCR):达到CR、PR与稳定(SD)的患者占治疗患者的比例;3)临床获益率(clinical benefit rate,CBR):各治疗方案治疗6个月时未发生进展的患者比例;4)肿瘤进展时间(time to progression,TTP):治疗开始直至肿瘤进展的时间(包括维持治疗时间)。所有患者疗效评价按照RECIST 1.1标准进行评价,不良反应参照美国国立癌症研究所的常规毒性判定标准(NCI-CTC 3.0)进行评估。
4 统计学方法 所有统计数据均采用SPSS 22.0进行统计学分析。组间比较采用t检验或χ2检验,Kaplan-Meier法计算生存率及绘制生存曲线,单因素分析显著性检验选用Log-rank检验。P<0.05为差异有统计学意义。
结 果
1 入组患者的基线特征 本研究中纳入75例女性晚期乳腺癌患者,75例中仅1例既往未行蒽环或紫杉类药物治疗,66例(88%)既往行蒽环类药物化疗,69例(92%)既往行紫杉类药物化疗。75例的基线资料见表1。
2 疗效分析 本研究中GX方案与NX方案共进行309周期化疗,平均行4周期化疗;GX组进行176周期化疗,NX组行133周期化疗。GX与NX化疗方案总体疗效无统计学差异(P=0.745),见表2。GX方案的ORR、DCR、CBR和TTP分别为16.67%、85.7%、45.2%和5.684个 月(95% CI:3.679 ~ 7.689),NX方 案 的ORR、DCR、CBR和TTP分别为30.3%、75.8%、51.5%、8.246个月(95%CI:3.717 ~ 12.776),两组间ORR、DCR、CBR和TTP均无统计学差异(P>0.05)。进一步比较两方案在不同化疗线数中的疗效见表3。GX方案一线与二线或以上化疗的ORR、DCR、CBR和TTP均无统计学差异,一线化疗的TTP略长于二线以上化疗;NX方案在一线与二线或以上化疗的DCR、CBR和TTP均达到或接近统计学差异。本研究75例患者中38例为一线化疗,37例为二线及以上化疗。在一线化疗与二线及以上化疗中GX与NX两方案的ORR、DCR、CBR和TTP均无统计学差异(P>0.05)。
3 安全性分析 GX与NX方案在白细胞下降、胃肠道反应、肝功能损伤、血小板下降及手足综合征等不良反应方面均无统计学差异。见表4。
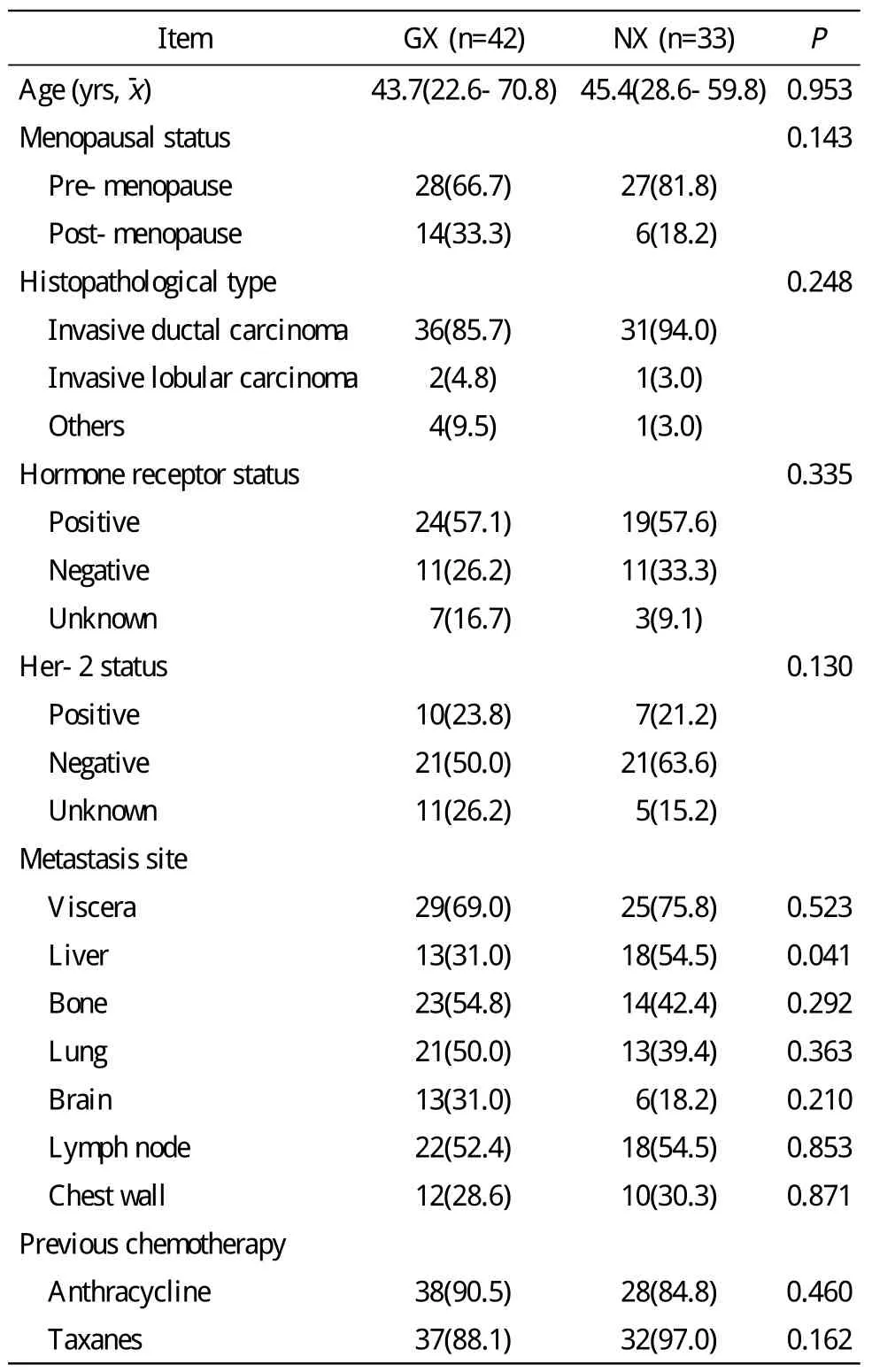
表1 75例晚期乳腺癌患者临床基线特征Tab. 1 Baseline data of 75 patients with metastatic breast cancer (n, %)
讨 论
晚期乳腺癌是一种不可治愈的恶性肿瘤,因此治疗多围绕“延长生存时间,提高生活质量”这一目标进行。晚期乳腺癌治疗中,化疗、靶向治疗、内分泌治疗、放疗等多种治疗方法的综合应用尤为重要[9]。蒽环类药物与紫杉类药物在乳腺癌患者的治疗中具有“基石”的地位,氟尿嘧啶类药物也是乳腺癌治疗的基础药物[10]。卡培他滨是一种选择性细胞内作用的氟尿嘧啶类抗代谢药物,口服方便且安全性较好,对于蒽环类或紫杉醇类化疗失败的转移性乳腺癌单药二线有效率为20% ~ 36%[11]。此外吉西他滨与长春瑞滨均为既往曾接受蒽环类与紫杉类药物治疗的晚期乳腺癌患者可选择的化疗药物[12-15]。
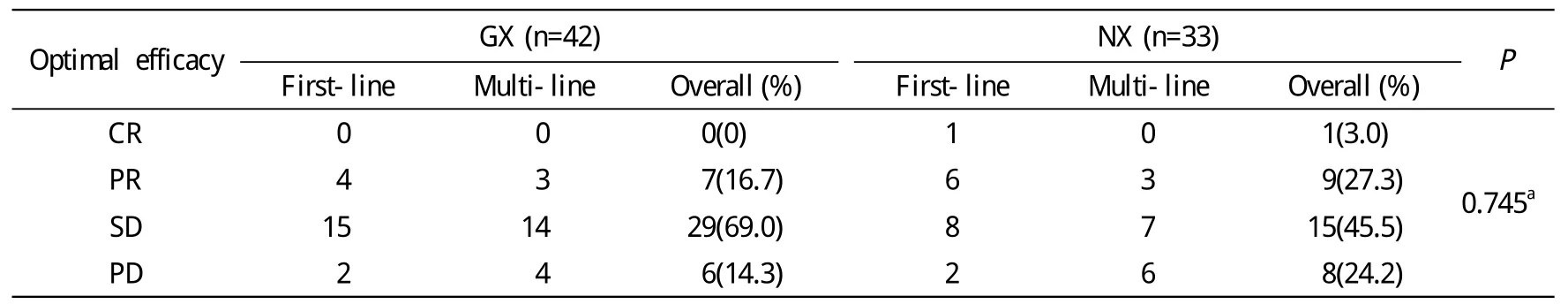
表2 GX方案与NX方案的疗效比较Tab. 2 Comparison of eff i cacy between GX and NX chemotherapeutic regimens (n, %)
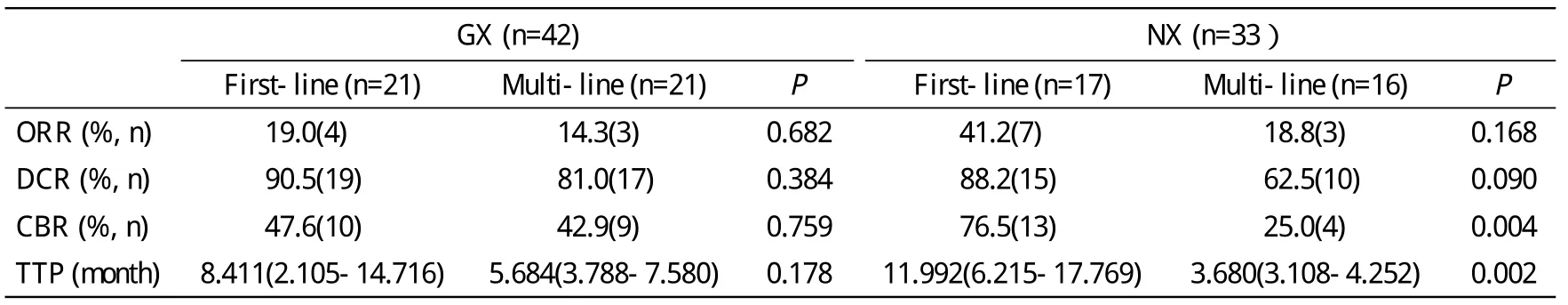
表3 GX、NX方案不同化疗线数的ORR、DCR、CBR和TTPTab. 3 Comparison of ORR, DCR, CBR and TTP between GX and NX chemotherapeutic regimens
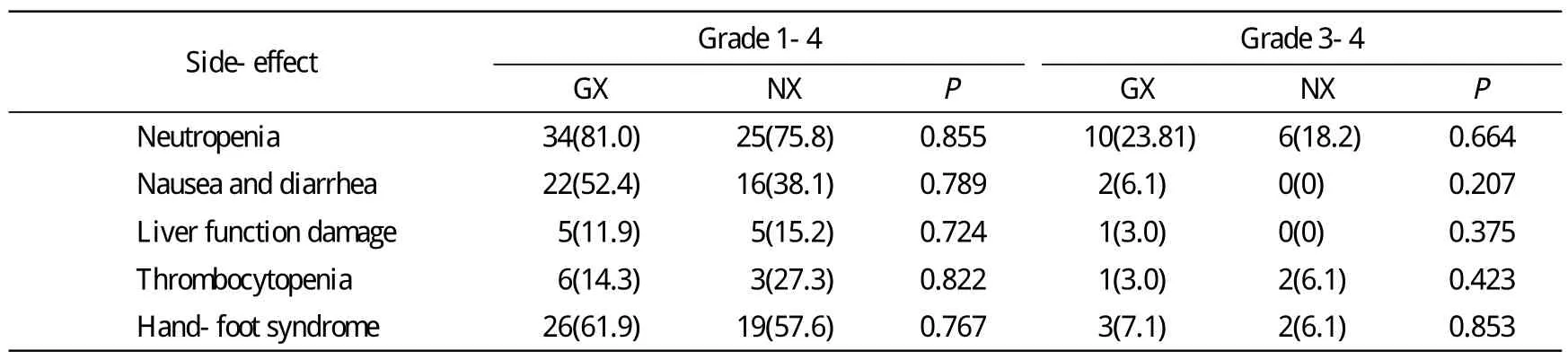
表4 GX与NX方案的近期不良反应比较Tab. 4 Comparison of side-effects between GX and NX chemotherapeutic regimens (n, %)
Park等[16]报道了GX方案治疗既往接受蒽环类与紫杉类药物治疗的晚期乳腺癌患者可获得39.0%的ORR、78.0%的DCR和68.3%的CBR,TTP为10.0个 月(95% CI:7.8 ~ 12.1)。Fan等[17]报道了NX方案治疗既往接受蒽环类与紫杉类药物治疗的晚期乳腺癌患者可获得45.8%的ORR,一线ORR为63.3%,二线ORR为33.3%,TTP为7.7个月(95% CI:5.5 ~ 10.0)。本研究的研究对象为临床中收治的既往行蒽环类与紫杉类药物治疗后发生耐药疾病进展的晚期乳腺癌患者。GX方案组的ORR、DCR和CBR分别为16.7%、85.7%和45.2%,DCR的结果与上述报道结果较为接近;TTP为5.68个月(95% CI:3.679 ~ 7.689),GX方案用于一线TTP时间(8.411个月)与文献报道相近。NX方案组的ORR为30.3%,一线ORR为41.2%,二线及以上治疗ORR为18.8%。ORR略低于文献报道的结果;TTP为8.25个月(95% CI:3.717 ~12.776),与文献报道相近。两方案总体的疗效未见明显统计学差异。此外我们进一步分析了GX和NX方案在不同化疗线数中的疗效,但由于病例数较少,所得到的结果代表性有限,但仍提示了GX方案在一线化疗中的TTP略优于二线及以上治疗的TTP,NX方案用于一线化疗疗效优于二线及以上化疗。这一结果可能提示早期应用NX方案的疗效优于多线的后续化疗疗效,GX方案则可能在多线化疗中也取得较好的疗效。
肖华伍和欧阳取长[18]研究了GX方案和NX方案治疗晚期乳腺癌患者疗效和不良反应,结果表明,两方案均为晚期乳腺癌治疗中安全有效的治疗方案[12]。本研究中GX方案和NX方案的总体疗效比较无统计学差异,但在一线化疗中,两方案ORR和CBR接近统计学差异,但由于样本含量的限制未达到统计学差异,但仍提示一线治疗中NX方案可能优于GX方案,NX方案在既往接受过蒽环类与紫杉类药物的晚期乳腺癌患者的治疗中应较早使用。而在化疗导致的不良反应比较中,两方案化疗常见不良反应的发生率相近,均无统计学差异。所有不良反应中,不同程度的骨髓抑制发生率相对较高,GX与NX方案3 ~ 4级骨髓抑制的发生率分别为23.81%和18.2%,因此在临床中化疗后血常规检测尤为重要。除骨髓抑制外,其他各类不良反应3 ~ 4级的发生率均较低,安全性及耐受性良好。
总之,对于既往接受过蒽环类与紫杉类药物的晚期乳腺癌患者,GX方案与NX均为其后续治疗中可选择的化疗方案。NX方案在晚期患者的治疗中早期应用效果优于后期应用,GX方案在多线化疗中也可以取得较好的疗效。两方案总体疗效及不良反应率均无统计学差异,安全性及耐受性较好,在临床实践中均可使晚期乳腺癌患者受益。
1 Cardoso F, Fallowfield L, Costa A, et al. Locally recurrent or metastatic breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2011, 22(Suppl 6): vi25-vi30.
2 李莹,杨俊兰.乳腺癌内分泌治疗联用新型靶向药物研究进展[J].解放军医学院学报,2013,34(10):1092-1094.
3 Hutchins LF, Green SJ, Ravdin PM, et al. Randomized, controlled trial of cyclophosphamide, methotrexate, and fluorouracil versus cyclophosphamide, doxorubicin, and fluorouracil with and without tamoxifen for high-risk, node-negative breast cancer: Treatment results of intergroup protocol INT-0102[J]. J Clin Oncol, 2005,23(33): 8313-8321.
4 Sledge GW, Neuberg D, Bernardo P, et al. Phase III trial of doxorubicin, paclitaxel, and the combination of doxorubicin and paclitaxel as front-line chemotherapy for metastatic breast cancer:An intergroup trial (E1193)[J]. J Clin Oncol 2003, 21(4):588-592.
5 Mamounas EP, Bryant J, Lembersky B, et al. Paclitaxel after doxorubicin plus cyclophosphamide as adjuvant chemotherapy for node-positive breast cancer: results from NSABP B-28[J]. J Clin Oncol, 2005, 23(16): 3686-3696.
6 Mackey JR, Martin M, Pienkowski T, et al. Adjuvant docetaxel,doxorubicin, and cyclophosphamide in node-positive breast cancer:10-year follow-up of the phase 3 randomised BCIRG 001 trial[J].Lancet Oncol. 2013, 14(1):72-80.
7 Ciruelos EM, Cortés J, Cortés-Funes H, et al. Gemcitabine and capecitabine in previously anthracycline-treated metastatic breast cancer: a multicenter phase II study (SOLTI 0301 trial)[J]. Ann Oncol, 2010, 21(7):1442-1447.
8 Estevez LG, Batista N, Sanchez-Rovira PA, et al. A phase II study of capecitabine and vinorelbine in patients with metastatic breast cancer pretreated with anthracyclines and taxanes[J]. Clin Breast Cancer,2008, 8(2): 149-154.
9 徐兵河.晚期乳腺癌的治疗原则与策略[J].中国医药导报,2010,7(6):6-8.
10 Bonadonna G, Moliterni A, Zambetti M, et al. 30 years’ follow up of randomised studies of adjuvant CMF in operable breast cancer:cohort study[J]. Br Med J, 2005, 330(7485): 217-220.
11 Fumoleau P, Largillier R, Clippe C, et al. Multicentre, phase II study evaluating capecitabine monotherapy in patients with anthracycline- and taxane-pretreated metastatic breast cancer[J].Eur J Cancer, 2004, 40(4):536-542.
12 Jerusalem G, Rorive A, Collignon J. Chemotherapy options for patients suffering from heavily pretreated metastatic breast cancer[J].Future Oncol, 2015, 11(12): 1775-1789.
13 Jones J, Takeda A, Tan SC, et al. Gemcitabine for the treatment of metastatic breast cancer[J]. Health Technol Assess (Rockv),2009, 13: 1-7.
14 Zelek L, Barthier S, Riofrio M, et al. Weekly vinorelbine is an effective palliative regimen after failure with anthracyclines and taxanes in metastatic breast carcinoma[J]. Cancer, 2001, 92(9):2267-2272.
15 林潇,胡倩,姚和瑞.转移性乳腺癌的化疗策略[J].中华临床医师杂志:电子版,2015,9(6):966-971.
16 Park JS, Jeung HC, Rha SY, et al. Phase II gemcitabine and capecitabine combination therapy in recurrent or metastatic breast cancer patients pretreated with anthracycline and taxane[J]. Cancer Chemother Pharmacol, 2014, 74(4): 799-808.
17 Fan Y, Xu BH, Yuan P, et al. Prospective study of vinorelbine and capecitabine combination therapy in Chinese patients with metastatic breast cancer pretreated with anthracyclines and taxanes[J].Chemotherapy, 2010, 56(4): 340-347.
18 肖华伍,欧阳取长.含卡培他滨方案治疗复发转移性乳腺癌的临床观察[J].中国肿瘤临床与康复,2012,19(3):221-223.

