托珠单抗对心衰大鼠辅助性T细胞17介导的心肌炎症反应的影响*
张海宁,尹园,柳玉梅,张维文
(广州医科大学 药理教研室,广东 广州 511436)
托珠单抗对心衰大鼠辅助性T细胞17介导的心肌炎症反应的影响*
张海宁,尹园,柳玉梅,张维文
(广州医科大学 药理教研室,广东 广州 511436)
目的探讨托珠单抗对心衰大鼠辅助性T细胞17(Th17)介导的心肌炎症反应的影响及对心功能的保护作用。方法利用冠状动脉左前降支结扎法制备心衰模型,于术后第2天腹腔注射5 mg/kg托珠单抗,4周注射1次,连续注射3次。实验结束后,左心室插管检测大鼠左心室血流动力学变化;酶联免疫吸附(ELISA)法测定心肌或脾脏组织中肿瘤坏死因子-α(TNF-α)、白介素-17(IL-17)、白介素-1β(IL-1β)、白介素-6(IL-6)及白介素-23(IL-23)水平;流式细胞仪检测脾脏Th17细胞比例;实时荧光定量聚合酶链反应(RT-qPCR)检测脾脏维A酸相关孤儿受体γ t(RORγ t)及维A酸相关孤儿受体α(RORα)mRNA的表达水平;Western blot检测核转录因子-κB(NF-κB)p65核蛋白表达水平。结果托珠单抗治疗降低心衰大鼠死亡率及心脏体重比(HW/BW)比值,改善心衰大鼠血流动力学参数,包括降低平均血压(MBP)及左心室舒张末期压(LVEDP),升高左心室舒张压最大上升和下降速率(±dp/dt)及左心室收缩压(LVSP)。模型组大鼠脾组织IL-23、IL-17蛋白表达水平、Th17细胞频率、Th17细胞活化的特征性转录因子RORγ t及RORαmRNA表达水平较对照组明显升高,并且心肌IL-1β、IL-6、TNF-α含量及NF-κB p65表达水平亦显著高于对照组。与模型组比较,托珠单抗治疗使上述指标明显降低。结论托珠单抗可能通过抑制Th17细胞介导的炎症反应发挥心肌保护作用。
心衰;炎症;托珠单抗;NF-κB
慢性炎症反应是心衰发展过程中的主要病理特征,在心衰的发病机制中可能起关键作用[1-2]。新近研究表明,以分泌白介素 -17(Interleukin-17,IL-17)为主要特征的辅助性T细胞17(T helper cells 17,Th17)过度活化在促进炎症反应并介导炎症损伤中发挥重要作用。研究显示,IL-17在患者血清和靶组织中高表达,与慢性感染、自身免疫疾病、移植排斥反应及肿瘤等疾病的发生、发展密切相关[3-4]。近年来对心衰的研究显示,慢性心力衰竭患者存在Th17细胞功能亢进及IL-17高表达[5-7],提示Th17细胞可能介导心衰发展过程中的慢性炎症反应。
托珠单抗(Tocilizumab)是近年美国食品药品管理局批准的首个治疗中至重度活动性类风湿关节炎(rheumatoid arthritis,RA)的人源化白介素 -6(Interleukin-6,IL-6)受体的单克隆抗体类药物。其临床及动物实验研究表明,托珠单抗参与下调IL-17介导的炎症反应,对缓解RA患者的全身炎症状态表现出良好的疗效[8-12]。目前,托珠单抗是否可以改善心衰患者的体内炎症状态,延缓心衰的发展未见报道。本文利用冠状动脉左前降支(left anterior descending,LAD)结扎法建立慢性心衰大鼠模型,观察长期接受托珠单抗治疗对大鼠心衰发展过程中炎症反应及心功能的改善作用,并初步探讨其可能的机制。
1 材料与方法
1.1 实验动物和主要试剂
无特定病原体(specefic pathogen free,SPF)级Sprague-Dawley(SD)大鼠,体重 250g 左右,雄性,由广东省实验动物中心提供,批号:SCXK(粤)2014-0005,200 mg/10 ml托珠单抗购自美国罗氏制药公司,Trizol试剂、First Strand cDNA Synthesis Kit购自日本TaKaRa公司,异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的抗鼠CD4单克隆抗体、藻胆素(Phycoerythrin,PE)标记的IL-17单克隆抗体、同型对照大鼠IgG1κ抗体、破膜剂由美国BD Bioscience公司提供。二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒购自美国Pierce公司。肿瘤坏死因子 -α(tumor necrosis factor-a,TNF-α)试剂盒购自美国 R&D公司。IL-17、IL-6、IL-23、IL-1β试剂盒购自美国eBioScience公司。Lamin B1、P65抗体购自美国Cell Signaling Technology公司,聚合酶链反应(polymerase chain reaction,PCR)引物由美国Invitrogen公司合成。
1.2 方法
1.2.1 LAD冠状动脉结扎制备慢性心衰动物模型及药物干预 SD大鼠戊巴比妥钠麻醉后,仰卧固定于手术台上,经左前胸廓旁第4、5肋间开胸,暴露心脏,在冠脉下穿6号丝线结扎LAD近端,关胸并挤出胸腔空气,心电图检查出现ST段明显弓背状抬高或压低,即初步认为心梗模型已建立。实验时设立假手术组作为对照组,假手术组大鼠行开胸,但不结扎冠状动脉左前降支。给药组于术后第2天腹腔注射5 mg/kg托珠单抗,4周注射1次,连续注射3次。给药期间,观察大鼠的一般情况,记录各组大鼠死亡数。于最后一次给药的第2天,处死大鼠,摘取心脏,称心脏重量(heart weight,HW),计算心脏体重比(HW/BW),并提取心肌组织蛋白。摘取脾脏,部分用于提取蛋白及总RNA,其余用于分离脾细胞进行流式检测。
1.2.2 大鼠左心室血流动力学测定 大鼠戊巴比妥麻醉后,仰卧固定,经右颈总动脉切口插入注满0.1%肝素并连接压力换能器的PE50导管,导管与PowerLab相连,边插入边观察屏幕上的波形,当波幅明显增大且导管剧烈抖动时,表明导管已进入左心室。左心室血流动力学参数由PowerLab 8通道电生理记录仪自动采集,分析获得。
1.2.3 酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)法测定细胞因子浓度 冰浴下制备心肌及脾脏组织匀浆,按照ELISA试剂盒说明书测定 TNF-α、IL-1β、IL-6、IL-17 及 IL-23 水平,结果以pg/mg表示。
1.2.4 流式细胞仪检测Th17细胞频率 药物干预结束的第2天杀死大鼠,取出脾脏,制备脾细胞悬液,置于红细胞裂解液(0.83%NH4Cl;0.01 mmol Tris-HCl,pH=7.2),清洗重悬细胞,进行 APC-anti-CD3,FITC-anti-CD4免疫染色;破膜,进行PE-anti-IL-17(1∶50)细胞内染色,同型对照管加PE-anti-IgG1κ作为同型阴性对照,用流式细胞仪(FACSDIVA;Becton Dickinson Biosciences,San Jose,CA)检测 CD4+T细胞中Th17细胞频率。
1.2.5 实时荧光定量聚合酶链反应(real timequantitative polymerase chain reaction,RT-qPCR)利用Trizol试剂提取大鼠脾脏总RNA,用逆转录试剂盒合成cDNA。取逆转录产物进行PCR扩增,反应条件:94℃预变性 3 min,94℃变性 45 s,55℃退火30 s,72℃延伸60 s,共35个循环。溶解曲线分析表明,PCR反应产物为单独的双链DNA。用ΔΔCt值法,以β-actin表达为内参定量维A酸相关孤儿受体γt(retinoid-related or-phan nuclear receptorγt,RORγt)及维A酸相关孤儿受体α(retinoid-related or-phan nuclear receptor α,ROR α)mRNA 的表达水平。
1.2.6 蛋白电泳 用放射免疫沉淀(radio-immunoprecipitation assay,RIPA)裂解液提取心肌组织总蛋白,经BCA蛋白定量后,取等量蛋白质样品进行十二烷基硫酸钠-聚丙烯酰胺(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)凝胶电泳,将电泳分离的蛋白转移到聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,室温下用含5%脱脂奶粉的三羟甲基氨基甲烷缓冲盐溶液(tris buffered saline and tween 20,TBST) 封闭 PVDF 膜1 h,加入一抗(1∶1 000)4℃孵育过夜。TBST洗膜,加入相应的二抗室温孵育1 h,TBST洗膜后用化学发光法检测蛋白水平,用凝胶成像系统扫描分析结果。
1.3 统计学方法
采用SSPS 18.0统计软件进行数据分析,计量资料用均数±标准差(±s)表示,两组比较用t检验,多组比较用方差分析(one-way,ANVOA),方差齐时,两两比较用LSD-t法,P<0.05为差异有统计学意义。
2 结果
2.1 托珠单抗对心衰大鼠一般情况、死亡率及HW/BW的影响
直至实验结束,对照组大鼠精神状态、饮食、活动正常。与对照组比较,模型组大鼠从8周开始陆续出现少动、松毛、进食减少、端坐呼吸及四肢皮下水肿等症状,托珠单抗组大鼠上述症状明显减轻。实验过程中,对照组大鼠无死亡。托珠单抗组死亡率、HW/BW较模型组明显降低,差异有统计学意义(P=0.021和0.038)。见表1。
2.2 托珠单抗对心衰大鼠心功能的影响
与对照组比较,模型组大鼠心率改变不明显(P=0.987),而 MBP、LVEDP 升高(P=0.007和 0.002),±dp/dt、LVSP降低(P=0.023、0.037 和 0.025)。托珠单抗组与模型组比较,MBP、LVEDP降低(P=0.038和 0.006),LVSP、±dp/dt升高(P=0.041、0.033 和0.043)。见表 2。
2.3 托珠单抗对心衰大鼠脾脏IL-17、IL-6、IL-23水平及Th17细胞比率的影响
表2 各组左室血流动力学参数比较 (±s)

表2 各组左室血流动力学参数比较 (±s)
注:1)与对照组比较,P<0.01;2)与对照组比较,P<0.05;3)与模型组比较,P<0.05;4)与模型组比较,P<0.01
组别心率/(次/min)MBP/(mmHg)LVSP/(mmHg)LVEDP/(mmHg)+dp/dt/(mmHg/s)-dp/dt/(mmHg/s)对照组 372.0±25.1 118.2±5.7 132.1±6.2 2.8±5.4 5908.0±854.6 -5362.1±998.7模型组 392.0±32.3 154.7±7.21) 78.4±3.82) 17.7±3.91) 3769.4±823.52) -3173.7±856.92)托珠单抗组 381.0±28.4 128.5±4.73) 126.6±3.93) 5.9±4.54) 4802.6±711.23) -4687.5±423.13)
为观察心衰过程中是否存在Th17细胞的免疫激活,本实验首先检测体内最主要的免疫器官脾脏中Th17细胞激活相关细胞因子及转录因子的表达。模型组大鼠脾脏IL-17、IL-6、IL-23水平及Th17细胞频率较对照组明显增加,差异有统计学意义(P=0.005、0.006、0.017 和 0.035)(见图 1 和表 3),脾脏RORγ t和RORα mRNA表达水平也明显上调,差异有统计学意义(P=0.032和0.003)(见图2),提示心衰发展过程中存在Th17细胞活化。托珠单抗组与模型组比较,可显著降低IL-17、IL-6、IL-23蛋白水平,减少脾脏Th17细胞频率及下调ROR γ t和 RORα mRNA 表达 (P=0.017、0.013、0.021、0.042、0.038 和 0.022)(见图 2 和表 3)。
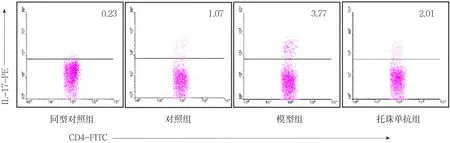
图1 各组脾脏Th17细胞比例
2.4 托珠单抗对心衰大鼠心肌炎症细胞因子表达的影响
表3 各组脾脏IL-23、IL-6、IL-17水平及Th17细胞频率比较 (±s)

表3 各组脾脏IL-23、IL-6、IL-17水平及Th17细胞频率比较 (±s)
注:1)与对照组比较,P<0.05;2)与对照组比较,P<0.01;3)与模型组比较,P<0.05
组别例数IL-23/(pg/mg)IL-17/(pg/mg)IL-6/(pg/mg)Th17细胞频率/%对照组 12 27.33±0.39 32.89±8.31 40.01±9.35 0.90±0.18模型组 7 63.52±1.081) 87.90±11.342) 337.23±24.542) 3.89±0.211)托珠单抗组 10 47.65±2.353) 61.22±8.233) 135.78±25.113) 1.96±0.253)

图2 各组脾脏ROR γ t和RORα mRNA表达
表4 各组心肌IL-1β、IL-6、IL-17、TNF-α含量比较 (±s)

表4 各组心肌IL-1β、IL-6、IL-17、TNF-α含量比较 (±s)
注:1)与对照组比较,P<0.01;2)与对照组比较,P<0.05;3)与模型组比较,P<0.01;4)与模型组比较,P<0.05
组别例数IL-6/(pg/mg)IL-1β/(pg/mg)IL-17/(pg/mg)TNF-α/(pg/mg)对照组 12 37.33±1.37 21.14±3.54 22.45±2.98 18.23±1.56模型组 7 263.52±35.661) 167.54±10.391) 52.07±9.872) 67.32±10.411)托珠单抗组 10 107.44±11.353) 98.64±10.454) 29.43±4.634) 38.23±8.574)
ELISA检测心肌组织炎症因子水平。模型组大鼠心肌组织 IL-17、TNF-α、IL-1β、IL-6水平明显高于对照组大鼠,差异有统计学意义(P=0.023、0.004、0.002和0.002)。而给予托珠单抗治疗后心肌组织IL-17、TNF-α、IL-1β、IL-6 水平较模型组降低,差异有统计学意义(P=0.031、0.019、0.022 和0.007)。见表4。
2.5 托珠单抗抑制心衰过程中核转录因子-κB的活化
Western blot检测结果显示,模型组大鼠心肌组织核转录因子-κB(nuclear transcription factor-κB,NF-κB)p65核蛋白表达水平明显增加(P=0.028)。而给予托珠单抗治疗后,心肌组织NF-κB p65核蛋白表达水平显著下调(P=0.033)。见图3。

图3 各组心肌细胞NF-κB p65核蛋白表达
3 讨论
1990年LEVINE等[13]发现慢性心衰患者循环中TNF-α水平明显升高。随后人们注意到包括TNF-α、IL-6、IL-1β等在内的大量前炎症细胞因子在外周血及心肌局部大量活化介导的慢性炎症反应是心衰发病进程中的主要病理学特征,并在心衰的发病机制中起关键作用[1-2],因此提出抗炎和免疫调节治疗有望成为延缓心衰的新策略。托珠单抗是首个被美国食品药品管理局批准的IL-6受体的单克隆抗体。目前,其主要用于中至重度活动性类风湿关节炎的药物治疗,通过缓解RA患者全身炎症状态,可改善患者疲乏、疼痛及晨僵症状,延缓关节损伤,进而改善躯体功能。本实验观察托珠单抗对冠状动脉结扎诱导的心衰的治疗作用,结果显示,托珠单抗组大鼠死亡率、HW/BW较模型组明显降低,左室血流动力学参数如LVEDP,±dp/dt等有显著改善,表明托珠单抗对心衰大鼠产生良好的保护作用。
免疫系统激活是多种前炎症细胞因子产生的主要机制。既往研究认为,过度活化Th1细胞通过分泌 TNF-α、干扰素 γ(interferonγ,IFNγ)、IL-2等致炎因子与介导炎症反应有关。近年来研究发现,Th17细胞在防御胞外细菌感染、介导慢性炎症以及自身免疫疾病中发挥更加重要的作用[3-4]。Th17细胞主要产生 IL-17A、IL-17F、IL-21和 IL-22,其中IL-17是主要的炎症介导因子,通过与其受体IL-17R结合,促进炎症反应,参与多种疾病的病理过程。新近LI等[6]报道,心衰患者循环血中IL-17表达量及Th17细胞频率明显增加,并与心肌损害程度密切相关,提示Th17细胞参与心衰的发生、发展。本研究结果显示,心衰组大鼠体内最主要的免疫器官脾脏中IL-17表达水平以及Th17细胞频率显著增高,Th17细胞活化的特征性转录因子RORγ t和RORα mRNA表达水平也明显上调。同时本研究发现,维持Th17细胞扩增及功能的最主要的正调控因子IL-23在脾脏的分泌亦明显增加,表明心衰发展中存在Th17细胞的免疫激活,也进一步证实心衰的发生、发展与Th17细胞过度活化密切相关。
IL-6是活化的T细胞和成纤维细胞产生的前炎症细胞因子,参与广泛的生物学功能,包括急性期炎症反应、干扰铁的重吸收和再利用、诱导血管内皮生长因子表达等[14]。新近研究表明,通过作用于其受体,IL-6还参与调控Th17细胞的活化过程。有研究显示,IL-6在介导类风湿性关节炎患者体内Th17细胞活化过程中起关键作用,而给予抗IL-6受体的抗体明显抑制由6-磷酸葡萄糖异构酶及胶原诱导的关节炎动物体内Th17细胞及IL-17的产生[10-11]。本研究发现,心衰组大鼠脾脏中IL-6水平显著升高,Th17细胞明显活化,给予IL-6受体的抗体托珠单抗干预处理后,Th17细胞活化相关指标较模型组明显降低。以上结果提示,抑制Th17细胞活化亦可能是托珠单抗抑制心衰发生、发展的重要机制之一。
研究显示,Th17细胞介导的炎症反应与活化前炎症转录因子诱导多种炎症介质释放密切相关。NF-κB是普遍存在于细胞浆中的一种快反应转录因子,在介导细胞增殖与分化、肿瘤、炎症和免疫反应等多种病理生理过程中发挥重要作用。NF-κB由p50和RelA(p65)组成,非活性状态时与抑制性蛋白IκB结合存在于胞浆中,而当NF-κB激活时,IκB被降解,使NF-κB p65亚单位释放,转入核内与靶基因的κB基序结合,从而启动靶基因的表达。众多研究表明,NF-κB介导的细胞因子、趋化因子、黏附分子等多种炎性蛋白的表达是引起哮喘、类风湿性关节炎、牛皮癣、肠炎等许多慢性炎症性疾病的关键因素[15-16]。本研究结果显示,心衰模型组大鼠心肌组织IL-17表达水平明显升高,核NF-κB明显活化,同时心肌组织炎症因子TNF-α、IL-1β、IL-6水平亦明显高于对照组,而经托珠单抗干预治疗后,胞核NF-κB p65表达水平及心肌匀浆液中IL-17、IL-1β、IL-6、TNF-α含量较模型组降低,提示托珠单抗可能通过拮抗IL-17的产生阻碍NF-κB活化及NF-κB活化介导的IL-1β、IL-6、TNF-α释放,从而抑制由Th17细胞过度活化导致的炎症反应及炎症损伤,最终延缓心衰的发展,然而其具体机制尚需在后续的研究中深入探讨。
综上所述,本研究表明,托珠单抗作为一个新型的抗炎药物,长期应用可缓解心衰大鼠心肌炎症反应,改善心功能并延缓心衰的发展,其机制可能与抑制Th17细胞过度活化介导的NF-κB转录活性的下调有关。本研究结果将为托珠单抗在心血管相关疾病及心衰中的应用提供实验依据。
[1]BOLTON AE.Biologic effects and basic science of a novel immune-modulation therapy[J].Am J Cardiol,2005,95(11):24-29.
[2]GENTH-ZOTZ S,VON HAEHLING S,BLANKENBERG S.Immunactivation in chronic heart failure.Inflammatory mediators[J].Z Kardiol,2004,93(4):24-30.
[3]KORN T,OUKKA M,KUCHROO V,et al.Th17 cells:effector T cells with inflammatory properties[J].Semin Immunol,2007,19(6):362-371.
[4]MARTINEZ GJ,NURIEVA RI,YANG XO,et al.Regulation and function of proinflammatory TH17 cells[J].Ann New York Acad Sci,2008,1143(1):188-211.
[5]彭芝斌,邓世磊,杨泽敏,等.慢性心力衰竭患者Th17/Treg失衡的研究及其意义[J].中华中医学杂志,2009,33(6):316-318.
[6]LI J,WANG L,WANG S,et al.The Treg/Th17 imbalance in patient with idiopathic dilated cardiomyopathy[J].Scand J Immunol,2010,71(4):298-303.
[7]TANG TT,DING YJ,LIAO YH,et al.Defective circulating CD4+CD25+Foxp3+CD127 (low)regulatory T-cells in patients with chronic heart failure[J].Cell Physiol Biochem,2010,25(4/5):451-458.
[8]NISHIMOTO N,MIYASAKA N,YAMAMOTO K,et al.Study of active controlled tocilizumab monotherapy for rheumatoid arthritis patients with an inadequate response to methotrexate(SATORI):significant reduction in disease activity and serum vascular endothelial growth factor by IL-6 receptor inhibition therapy[J].Mod Rheumatol,2009,19(1):12-19.
[9]NISHIMOTO N,HASHIMOTO J,MIYASAKA N,et al.Study of active controlled monotherapy used for rheumatoid arthritis,an IL-6 inhibitor(SAMURAI):evidence of clinical and radiographic benefit from an X ray reader-blinded randomised,controlled trial of tocilizumab[J].Ann Rheum Dis,2007,66(9):1162-1167.
[10]IWANAMI K,MATSUMOTO I,TANAKA-WATANABE Y,et al.Crucial role of the interleukin-6/interleukin-17 cytokine axis in the induction of arthritis by glucose-6-phosphate isomerase[J].Arthritis Rheum,2008,58(3):754-763.
[11]FUJIMOTO M,SERADA S,MIHARA M,et al.Interleukin-6 blockade suppresses autoimmune arthritis in mice by the inhi bition of inflammatory Th17 responses[J].Arthritis Rheum,2008,58(12):3710-3719.
[12]YOSHIDA H,HASHIZUME M,MIHARA M.IL-6 blockade preferentially inhibits Th17 differentiation in collagen-induced arthritis[J].Rheumatol Int,2011,31(1):127-131.
[13]LEVINE B,KALMAN J,MAYER L,et al.Elevated circulating levels of tumor necrosis factor in severe chronic heart failure[J].N Engl J Med,1990,323(4):236-241.
[14]AKIRA S,TAGA T,KISHIMOTO T.Interleukin-6 in biology and medicine[J].Adv Immunol,1993,54:1-78.
[15]TERGAONKAR V.NF kappa B pathway:a goodsignaling paradigm and therapeutic target[J].Int J Biochem Cell Biol,2006,38(10):1647-1653.
[16]MELISI D,NIU J,CHANG Z,et al.Secreted interleukin-1 alpha induces a metastatic phenotype in pancreatic cancer by sustaining a constitutive activation of nuclear factor-kappa B[J].Mol Cancer Res,2009,7(5):624-633.
(申海菊 编辑)
Effects of Tocilizumab on myocardial inflammation mediated by Th17 cells in rats with chronic heart failure*
Hai-ning ZHANG,Yuan YIN,Yu-mei LIU,Wei-wen ZHANG
(Department of Pharmacology,Guangzhou Medical University,Guangzhou,Guangdong 511436,P.R.China)
【Objectives】To observe the effect of Tocilizumab on the myocardial inflammation mediated by T helper cells 17 (Th17)in rats with chronic heart failure,and to explore the possible protective action of Tocilizumab on heart function.【Methods】Male Sprague-Dawley (SD)rats were subjected to the permanent ligation of the left anterior descending coronary artery (LAD)to induce chronic heart failure.One day later,the rats in the Tocilizumab group
an intraperitoneal injection of 5 mg/kg of Tocilizumab once every four weeks for 12 weeks.Cardiac function parameters of the rats were measured by left ventricular catheterization at the end of experiments.The levels of proinflammatory cytokines such as tumor necrosis factor α(TNF-α),interleukin 1β (IL-1β),interleukin 6(IL-6),interleukin 17(IL-17)and interleukin 23(IL-23)in the heart and the spleen were measured by ELISA.The mRNA expressions of retinoid related orphan receptor t(ROR t)and retinoid related orphan receptor α (ROR α)were detected by real-time quantitative PCR.Th17 cell frequency was analyzed by flow cytometry and the expression level of nuclear factor-κB (NF-κB)p65 in the cardiomyocyte nuclei was examined using Western blot.【Results】Tocilizumab treatment significantly decreased the rat mortality and the heart-to-body weight ratio(HW/BW),and ameliorated rat cardiac function,as evidenced by decreasing mean blood pressure(MBP)and left ventricular end-diastolic pressure(LVEDP)and increasing the maximum ascending and descending rates of left ventricular diastolic pressure(±dp/dt)and left ventricular systolic pressure(LVSP).Moreover,the rats in the model group exhibited significantly increased IL-23 and IL-17 expressions,Th17 cell frequency,mRNA levels of RORt and RORα in the rat spleen,as well as increased cardiomyocyte NF-κB p65 expression and myocardial content of IL-1β,IL-6 and TNF-α as compared with those in the control group;but all of them were reduced by Tocilizumab treatment.【Conclusions】Tocilizumab may exert a myocardial protective effect by inhibiting the inflammation mediated by Th17 cells.
chronic heart failure;inflammation;Tocilizumab;nuclear factor-κB
R541.6
A
1005-8982(2015)35-0007-06
2015-02-11
广州市教育局基金(No:10A179)

