包埋菌启动厌氧氨氧化反应器及其动力学性能
陈光辉,李军,邓海亮,张彦灼,赵白航,郑照明
(北京工业大学水质科学与水环境恢复工程北京市重点实验室,北京 100124)
引 言
厌氧氨氧化(anaerobic ammonium oxidation,Anammox)是指在厌氧或缺氧条件下,一类浮霉菌属细菌以亚硝酸盐为电子受体,将铵盐氧化产生氮气和少量硝酸盐的过程
[1]。与传统生物脱氮工艺相比,厌氧氨氧化工艺经济高效,总氮去除负荷(nitrogen removal rate,NRR)达9.50 kg·m-3·d-1,远高于传统工艺(<0.50 kg·m-3·d-1)[2],同时可节省约60%的曝气量和100%的有机碳源[3-4],受到研究者的高度关注[5-7]。但是,厌氧氨氧化菌作为自养型生物,生长缓慢,世代周期长,导致反应器的启动时间很长[8-10]。
向反应器中投加高效Anammox 菌种作为流加菌,可以加快厌氧氨氧化反应器的启动(即菌种流加技术)[11-12]。对于流加菌种,一般选用高效的厌氧氨氧化颗粒污泥( high-rate Anammox granules,HAG),但从絮状厌氧氨氧化污泥(flocculent Anammox sludge,FAS)培养至HAG 的过程非常缓慢,Helio等[13]和Dapena-Mora 等[14]均采用序批式(sequencing batch reactor,SBR)反应器培养厌氧氨氧化颗粒污泥,培养时间较长,大于200 d,且总氮去除负荷在2.0 kg·m-3·d-1以下;唐崇俭等[15]采用膨胀颗粒污泥床(expanded granular sludge bed,EGSB)反应器,经过230 d 的稳定运行,得到的厌氧氨氧化颗粒污泥,平均粒径为(2.51±0.91)mm;从岩等[4]同样以EGSB 反应器,接种好氧颗粒污泥和厌氧氨氧化菌混合物,经80 d 培养,总氮去除负荷达到4.758 kg·m-3·d-1,同时观察到颗粒状厌氧氨氧化污泥,但平均粒径只有0.556 mm。这些研究表明,经过一定时间的培养,可以实现厌氧氨氧化污泥的颗粒化,但耗时较长,不利于实际工程应用。如何快速得到高效的厌氧氨氧化流加菌,是菌种流加技术面临的主要问题。
包埋固定化技术是现代生物工程领域中一项新兴的微生物固定化技术,它通过包埋材料将游离细胞或者酶定位于限定的区域,使其保持活性并可反复利用[16-17]。本研究将包埋固定化技术与厌氧氨氧化流加工艺相结合,用普通絮状厌氧氨氧化污泥(FAS)制取固定化包埋颗粒,以包埋颗粒代替HAG作为流加菌加入厌氧氨氧化反应器,研究反应器的启动过程,并对厌氧氨氧化包埋颗粒的动力学特征进行研究,以期为新的Anammox 菌种流加工艺提供理论依据。
1 材料和方法
1.1 实验装置
实验采用有机玻璃制造升流式厌氧污泥床反应器(up-flow anaerobic sludge bed,UASB),上部设有三相分离器,有效容积为17 L,如图1所示,反应器内部填充塑料大孔球(直径8 cm),大孔球内包裹了环状辫带式纤维填料。塑料大孔球的间隙有利于水的流动和扩散,纤维填料有利于减少污泥的流失。反应器外部设有水浴层,通过水浴加热保持反应器内温度维持在32℃。
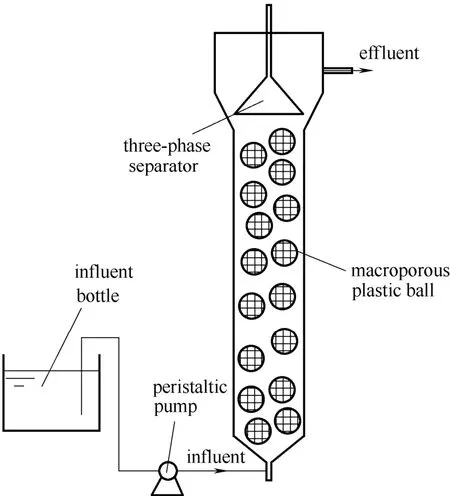
图1 厌氧氨氧化UASB 反应器Fig.1 Schematic diagram of Anammox UASB reactor system
1.2 接种污泥
启动反应器的接种污泥取自北京某污水处理厂曝气池活性污泥,其MLSS 为3480 mg·L-1,MLVSS 为2850 mg·L-1,MLVSS /MLSS 为83.9%,表现出良好硝化性能。
1.3 包埋颗粒的制备
实验用厌氧氨氧化包埋污泥取自实验室稳定运行2年的UASB 反应器[18]中部絮状污泥(FAS;VSS 2817 mg·L-1;MLVSS /MLSS 81.4%),取出的污泥经PBS(0.1 mol·L-1,pH 7.4)冲洗干净后,4000 r·min-1转速离心浓缩10 min,弃清液,得浓缩污泥。以质量百分比计,取10%的水性聚氨酯(WPU)溶液与等体积浓缩污泥混合,加入2%粉末活性炭(粒径38~74 μm),再加入0.24%N,N-亚甲基双丙烯酰胺和1.5% KPS,并迅速搅拌均匀,约30 min后混合液凝胶成固态,将固态胶体切割成3 mm× 3 mm×3 mm 立方体,即得厌氧氨氧化包埋颗粒。制得的包埋颗粒为黑色,密度约为1.16 g·cm-3,在水中呈均相,具有良好的物理强度和化学稳定性。包埋剂(WPU)和交联剂/引发剂(N,N-亚甲基双丙烯酰胺、KPS)均为分析纯。
1.4 实验水质
实验采用人工配水,主要成分组成见表1,NH+4-N 和NO-2-N 分别以NH4Cl 和NaNO2提供,浓度按需配制;微量元素Ⅰ和Ⅱ参照文献[19],各1 ml·L-1。
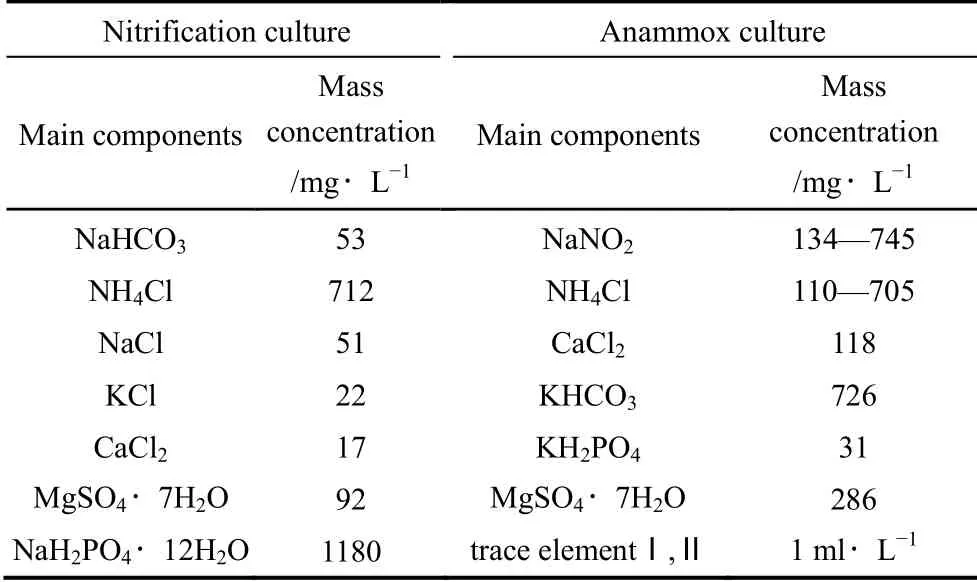
表1 人工模拟废水成分组成Table 1 Compositions of artificial wastewater
1.5 反应动力学测定
取20 ml 厌氧氨氧化包埋颗粒(含0.4 g 厌氧氨氧化污泥)和180 ml 模拟废水加入300 ml 血清瓶中,模拟废水中NH+4-N 和NO-2-N 浓度根据要求配成相应浓度,其余组分同表1厌氧氨氧化阶段。混合液用高纯N2吹脱20 min 置换掉其中的溶解氧(DO),之后血清瓶用丁基橡胶塞盖紧,黑色反光纸包裹,放入32℃恒温振荡培养箱中,80 r·min-1振荡培养。间隔6 h 取样测定,计算NH+4-N 和NO-2-N去除速率,所有测试设3 个重复。
1.6 分析方法
NH+4-N:纳氏试剂光度法;NO-2-N:N-(1-萘基)-乙二胺分光光度法;NO-3-N:麝香草酚分光光度法;TN:过硫酸钾氧化-紫外分光光度计法;MLSS、MLVSS:重量法[20];pH/温度:WTW/Multi 3420测定仪;扫描电镜(SEM)分析:取出污泥清洗后,经25%戊二醇固定1.5 h,PBS 清洗3 遍,随后经体积分数为50%、70%、80%、90%、100%乙醇梯度脱水,每次10~15 min,最后用乙酸异戊酯置换,冷冻干燥24 h 后在样品表面镀上一层1500 nm 厚的金属膜,采用Hitachi S-4300 型扫描电镜进行观察。
2 实验结果
2.1 硝化反应器的启动
厌氧氨氧化反应器启动方式有多种,但实质上都是微生物的活化和扩增过程,对于厌氧氨氧化菌这类生长缓慢的微生物,关键是减少菌体流失,使生物量尽快达到要求,成为反应器内的优势菌种。本研究采用以硝化反应器启动厌氧氨氧化的方式,接种硝化污泥,同时利用塑料大孔球上形成的好氧生物膜,以硝化污泥和硝化生物膜共同作用的方式,加快启动厌氧氨氧化反应器。
在硝化反应器的启动中,既可以利用生态学上的K 对策,通过对反应器施加低负荷(即低负荷法)来富集培养对基质亲和力较高的微生物,也可以采用R 对策,通过对反应器施加高负荷(即高负荷法)来富集培养生长较快的微生物,本研究采取R 对策(高负荷法),进水中添加NH4Cl 使ρ(NH+4-N)保持在200 mg·L-1,其余成分见表1。反应器中用曝气头充分曝气,使DO 保持在7 mg·L-1以上,水力停留时间(HRT)为6 h,到第14 天,反应器对NH+4-N的去除率达到90.3%,塑料大孔球内辫式填料上有污泥附着,并观察到有生物膜形成,表明硝化反应器启动成功,此时反应器内MLSS 为4358 mg·L-1,MLVSS/MLSS=86.2%,将反应器由好氧运行转变为厌氧运行。
2.2 厌氧氨氧化反应器的启动
反应器由好氧运行转入厌氧运行后,先采用低负荷,水力停留时间(HRT)8 h,控制进水ρ(NH+4-N)为30~50 mg·L-1,随着去除负荷的升高,逐渐提高进水NH+4-N 质量浓度(60~200 mg·L-1),结果如图2所示。图2(a)是NH+4-N 浓度随时间的变化。前3 天与其他厌氧氨氧化反应器启动相似,出水NH+4-N 高于进水,这主要是由于反应器由好氧运行转变为厌氧运行后,一部分菌体死亡水解,有机氨转化为无机氨,使出水NH+4-N 升高[21];之后由于厌氧氨氧化作用,出水NH+4-N 降低,但去除效果并不明显,NH+4-N 去除率在1%以下,在第11 天 NH+4-N 的去除负荷只有0.0046 kg·m-3·d-1。在第12 天向反应器中投加500 ml 厌氧氨氧化包埋颗粒,反应器立刻显现出厌氧氨氧化功能,之后NH+4-N 去负荷从 0.0489 kg·m-3·d-1升高到 0.3064 除率开始逐渐升高,在第20~50 天,NH+4-N 去除增加,厌氧氨氧化性能增强。到第65 天,NH+4-N kg·m-3·d-1,这表明反应器内参与反应的生物量去除率达到 85.8%,相应的去除负荷 0.4961 kg·m-3·d-1,反应器表现出较强的厌氧氨氧化性能。NO-2-N 的变化与NH+4-N 基本相似,如图2(b)所示,随着包埋颗粒的加入,NO-2-N 去除率从第11天的2.1%增加到第65 天的88.7%,相应的去除负荷也从0.0025 kg·m-3·d-1升高到0.4951 kg·m-3·d-1。Anammox 反应的基质为NH+4-N 和NO-2-N,基质浓度决定反应速度,因此为加快厌氧氨氧化启动,本研究一直通过增加进水NH+4-N 和NO-2-N 浓度的方式提高进水负荷,但NO-2-N 浓度过高同时也会对厌氧氨氧化过程产生抑制。Strous 等[22]在对SBR 反应器内的厌氧氨氧化菌研究时发现,当ρ(NO-2-N)大于100 mg·L-1时,能完全抑制厌氧氨氧化反应;Jetten等[23]的研究发现,当ρ(NO-2-N)大于280 mg·L-1时厌氧氨氧化过程才会被抑制,但当ρ(NO-2-N)大于140 mg·L-1时厌氧氨氧化反应过程就会受到影响。由图2(b)可以看出,随着进水亚硝酸盐浓度的升高,反应器对NO-2-N 的去除负荷也逐步提高,在第53~65 天,进水ρ(NO-2-N)从146 mg·L-1升高到186 mg·L-1,反应器在长时间内保持着较高的亚硝酸盐进水浓度,但反应器内并没有出现NO-2-N 的积累,出水ρ(NO-2-N)保持在20 mg·L-1左右,系统对NH+4-N 和NO-2-N 的去除负荷并没有降低,说明反应器内厌氧氨氧化反应没有受到高进水NO-2-N 浓度的影响。
图2(c)是反应器NO-3-N 的变化,厌氧氨氧化菌在将NO-2-N 转化为NO-3-N 的过程中获得还原力用于同化CO2,因此NO-3-N 的增量可以反映厌氧氨氧化菌的增殖情况。由图中可以看出,随着NH+4-N 和亚硝酸盐去除负荷的升高,NO-3-N 的增量也逐渐升高,在第65 天高达44.32 mg·L-1,这也说明反应器中厌氧氨氧化菌的活性是逐渐增加的。厌氧氨氧化反应器启动成功的报道已经有很多:Zhang 等[24]通过上流式生物膜反应器(UBF),接种反硝化污泥经过100 d 的运行,培育出具有厌氧氨氧化的生物膜,总氮去除负荷达0.14 kg·m-3·d-1,成功启动厌氧氨氧化反应器;Yu 等[25]通过分别接种两种不同类型的活性污泥,成功启动两组序批式生物膜反应器,总氮去除负荷分别为1.62 kg·m-3·d-1和1.43 kg·m-3·d-1;金仁村等[26]成功启动厌氧氨氧化固定床反应器,总氮去除负荷达到0.915 kg·m-3·d-1。虽然上述厌氧氨氧化反应器成功启动时的去除性能并不相同,但对于启动成功的标志都是一致的,即当反应器以厌氧氨氧化反应为主,进行稳定的生物脱氮时认为反应器启动成功。本研究反应器内,在第12 天添加厌氧氨氧化包埋颗粒后就开始显现厌氧氨氧化性能,在第49 天,反应器内NH+4-N 和NO-2-N 的去除率都达到80%以上,总氮去除负荷0.505 kg·m-3·d-1,并且逐步提高,经计算,第49天反应过程计量比 NH+4-N:NO-2-N:NO-3-N 为1:1.11:0.28,接近厌氧氨氧化反应的理论比值1:1.32:0.26,说明反应器内进行着稳定的厌氧氨氧化反应,因此可以认为经过49 d,厌氧氨氧化反应器启动成功。
2.3 厌氧氨氧化反应动力学
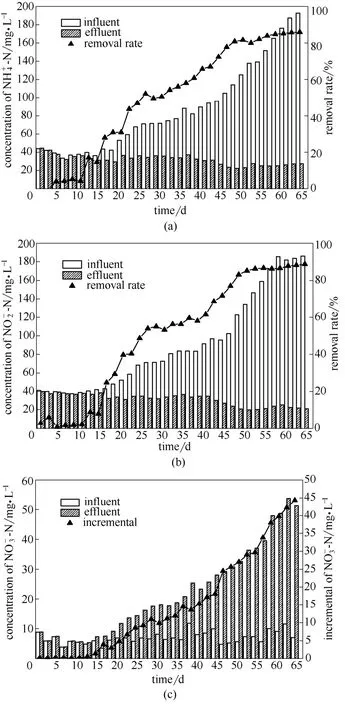
图2 NH+4-N、NO-2-N、NO-3-N 浓度变化Fig.2 Time courses of NH+4-N,NO-2-N,NO-3-N
为研究包埋颗粒的动力学特性以及包埋后FAS 的变化,采用批次试验对包埋颗粒进行动力学测定。实验测得,包埋颗粒厌氧氨氧化速率与基质浓度的对应关系见表2。
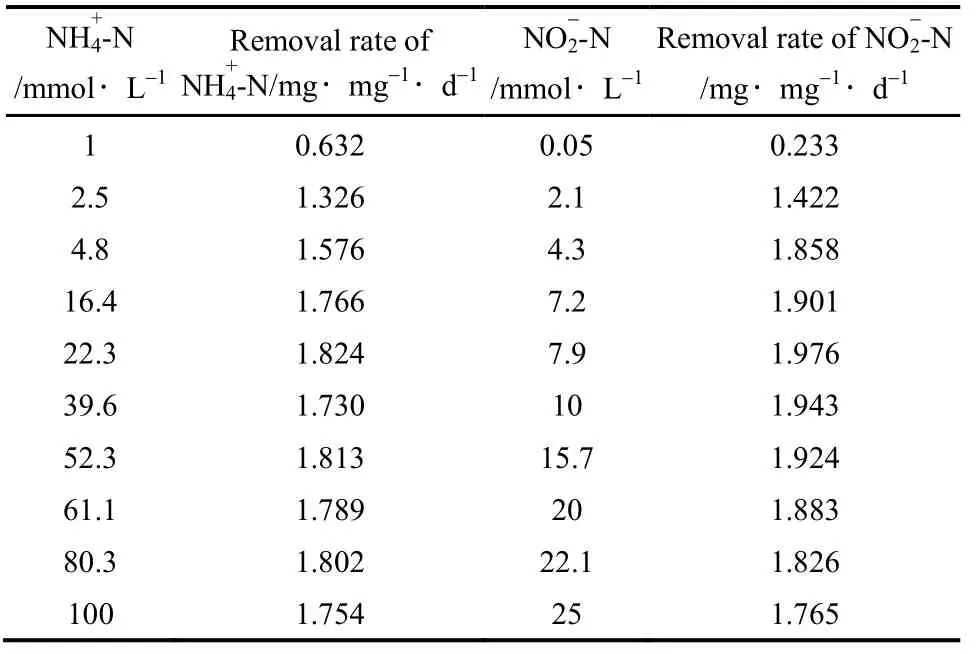
表2 基质浓度对厌氧氨氧化反应影响Table 2 Effect of substrate concentration on Anammox
厌氧氨氧化动力学过程受 NH+4-N 浓度和NO-2-N 浓度两个因素的限制,假设在实验过程中厌氧氨氧化菌细胞数量不发生变化,且反应器内始终处于完全混合状态,那么可以用Haldane 模型[27][式(1)]对厌氧氨氧化的反应动力学进行描述
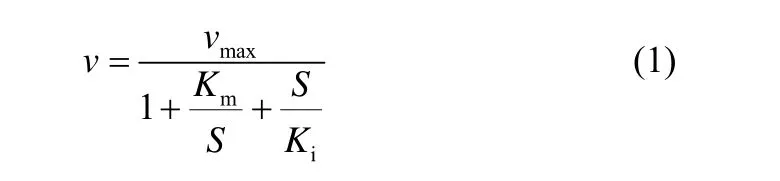
式中,v为反应速率;S为基质浓度;vmax为最大反应速率;Km为半速率常数;Ki为半抑制常数。用Origin8.0,以Haldane 模型对表3中实验数据进行非线性拟合,分别得包埋颗粒对NH+4-N[图3(a)]和NO-2-N[图3(b)]的动力学方程,拟合常数R2分别为0.949 和0.983,表现出良好的相关性。
由图3(a)可得包埋颗粒最大氨反应速率(SAA-NH+4-N)为1.99 mg·mg-1·d-1,对氨的半速率常数为 1.57 mmol·L-1,氨的半抑制常数为 724.2 mmol·L-1;由图3(b)得最大亚硝酸盐反应速率为2.55 mg·mg-1·d-1,最大亚硝酸盐反应速率(SAA-NO-2-N)为2.55 mg·mg-1·d-1,对亚硝酸盐的半速率常数为1.505 mmol·L-1,亚硝酸盐的半抑制常数为66.62 mmol·L-1。
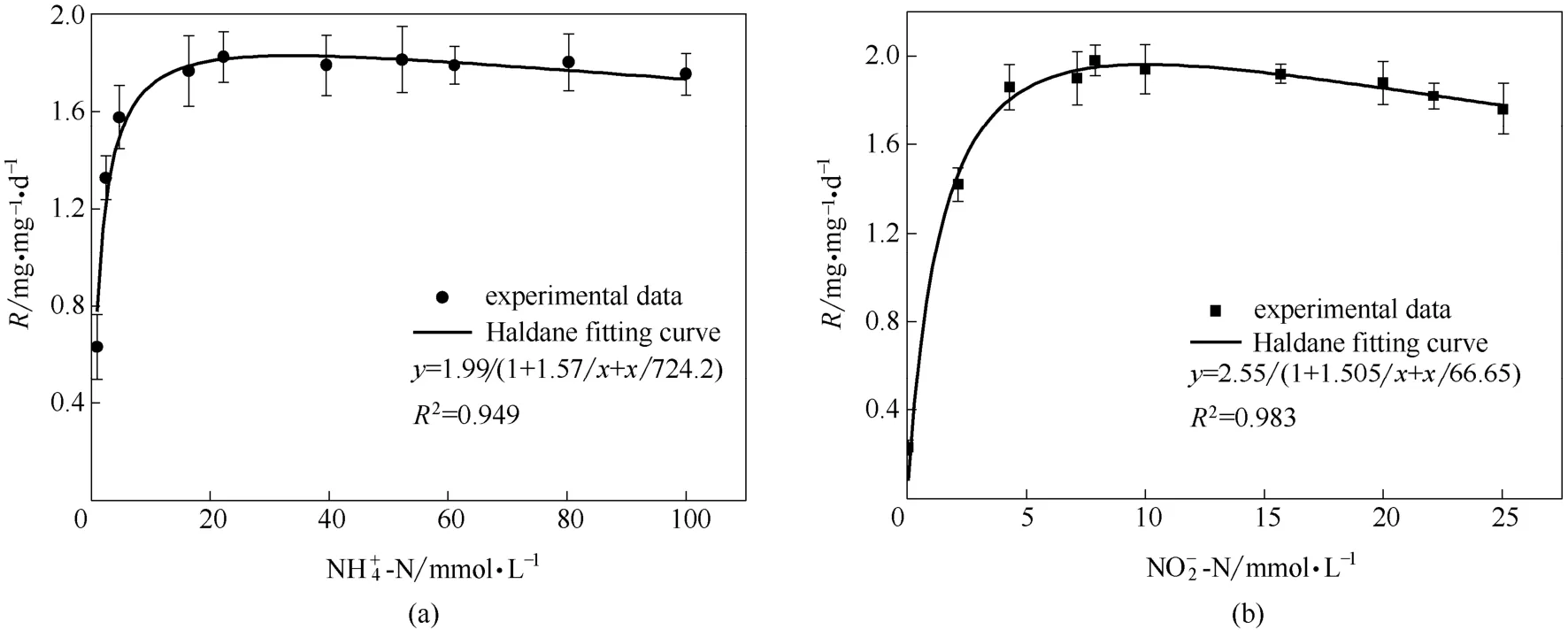
图3 包埋颗粒的厌氧氨氧化动力学特性Fig.3 Anammox kinetics of immobilized granules
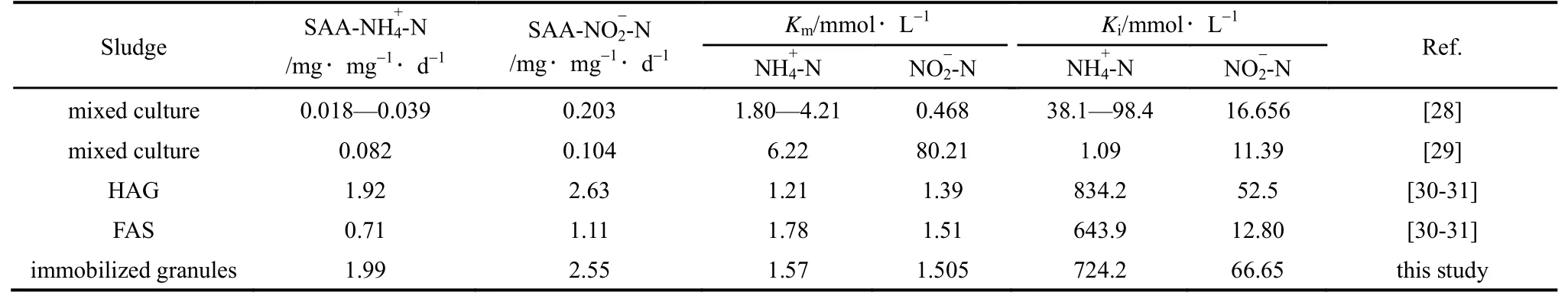
表3 不同厌氧氨氧化污泥动力学特性Table 3 Comparison of kinetic parameters of different Anammox sludge
包埋颗粒与其他形式厌氧氨氧化污泥的动力学特性相比见表3。郑平等[28]和祖波等[29]分别对生物脱氮流化床反应器和EGSB 反应器内的厌氧氨氧化混培物进行动力学研究,得到的动力学特性参数差别较大,分析主要是由于混培污泥中的菌种成分较为复杂,除厌氧氨氧化菌外还存在大量的反硝化菌和厌氧甲烷菌,对动力学性能测定产生一定影响。Tang 等[30-31]分别研究了UASB 反应器中培养的HAG 和FAS,并对它们的动力学性能进行了测定。本研究通过对包埋颗粒动力学性能分析发现,包埋颗粒的动力学特性与HAG 相似,最大反应速率和半抑制常数大于(半速率常数小于)其他形式的厌氧氨氧化污泥,具有更好的厌氧氨氧化动力学性能。
3 讨 论
厌氧氨氧化细菌与好氧氨氧化细菌(Ammonia oxidation bacteria,AOB)具有很多通性,van de Graaf等[32]发现一些好氧氨氧化细菌是兼性菌,可以在无氧条件下进行厌氧氨氧化反应,将氨氮转化为N2,从中获得能量。一般硝化污泥中Anammox 菌的含量约为1.7×106拷贝/mg 干污泥[6],因此以硝化污泥作为厌氧氨氧化接种污泥是可行的,但在本研究过程中发现,经过一段时间的培养,接种的硝化污泥并未显现出厌氧氨氧化性能,如图2所示,直到在第12 天加入500 ml 的厌氧氨氧化包埋颗粒(约10 g 厌氧氨氧化污泥),反应器中才出现NH+4-N 和NO-2-N 的同步去除,之后厌氧氨氧化功能逐渐增强,并在第65 天总氮去效率达到0.86 kg·m-3·d-1。相对于反应器内的污泥量,所投加的包埋厌氧氨氧化污泥并不多(污泥投加比约为7%)。Tang 等[33]在中试规模条件下,以硝化污泥启动厌氧氨氧化反应器,发现了同样现象,在反应器运行200 d 后仍没有NH+4-N 去除现象,于是在第214 天向反应器内投加高效厌氧氨氧化颗粒污泥,成功启动厌氧氨氧化反应器。这表明,虽然反应器内已经积累了一定数量的厌氧氨氧化菌,但是由于某些因素的限制不能表现出厌氧氨氧化功能。有研究表明,厌氧氨氧化菌只有在细胞密度达到1010个·ml-1以上时,才能显现出厌氧氨氧化活性[34],而厌氧氨氧化菌本身生长缓慢,倍增时间长达11 d,最大比生长率仅为0.06 d-1[35],因此,反应器内虽然富集了一定的厌氧氨氧化菌,但厌氧氨氧化菌的细胞密度很难提高,厌氧氨氧化活性无法体现。
图4是第65 天在反应器中取出的包埋颗粒和塑料大孔球,从图4(a)可以看到,包埋颗粒表面形成了很多颗粒状红色污泥,并从图4(b)中可以看到,大孔球内的辫式填料上污泥也开始发红,并且在离包埋颗粒较近的地方也有颗粒状红色污泥产生。将这一部分红色污泥取出,进行电镜扫描,放大8000倍[图4(c)]后,可以看到这些细菌为球形,两面有凹陷,呈火山口型,是典型的厌氧氨氧化菌[36]。因此,向反应器内投加厌氧氨氧化包埋颗粒,可以在反应器局部空间提高厌氧氨氧化菌细胞密度,从而显现出厌氧氨氧化活性,进而带动反应器内其他厌氧氨氧化菌的代谢作用,最终在较短的时间内成功启动厌氧氨氧化反应器,厌氧氨氧化包埋颗粒作为流加菌效应显著。
在表3中,通过对比不同厌氧氨氧化污泥的动力学特性,可以看出,通过将FAS 进行包埋,制作成固定化颗粒,动力学性能有了显著提高。包埋颗粒最大氨反应速率约为FAS 的2.8 倍,最大亚硝酸盐反应速率约为FAS 的2.3 倍,较高的反应速率可促使基质快速转化,缓解基质的自抑制作用,也可提高Anammox 污泥的产量。实验还测得包埋颗粒对于氨和亚硝酸盐的半速率常数均低于FAS,表明包埋颗粒对基质的亲和力也相对较大,更容易在竞争环境中竞争基质,利于厌氧氨氧化的进行。而一般认为,由于包埋材料的存在会阻碍传质作用,其半速率常数会大于絮状污泥,而本研究中的半速率常数较FAS 低,这可能是由于包埋后的厌氧氨氧化污泥拥有相对更集中的生物量,Anammox 菌含量更高。包埋颗粒的亚硝酸盐半抑制常数为FAS 的5.2倍,并且高于HAG,为66.65 mmol·L-1(933.1 mg·L-1),表明包埋后的厌氧氨氧化污泥能承受更高的亚硝酸盐浓度,如果将式(1)进行求导,并令一阶导数为零,可得到求得最大反应速率时的基质浓度

图4 反应器内包埋颗粒、辫式填料照片以及污泥SEM 图片(×8000)Fig.4 Photograph of immobilized granules(a),Ribbon-type filler(b) and SEM image of sludge(c) in reactor(×8000)

利用式(2)求得,当包埋颗粒达到最大亚硝酸盐反应速率时,ρ(NO-2-N)为140 mg·L-1,因此,当第53天以后,进水ρ(NO-2-N)浓度高于140 mg·L-1,反应器中厌氧氨氧化反应并没有受到抑制,并且在后续实验中,去除负荷随着进水基质浓度的升高而逐渐提高。因此包埋颗粒的加入能增强系统对亚硝酸盐耐受能力,有助于厌氧氨氧化反应器的高效、稳定运行。
4 结 论
本研究以厌氧氨氧化包埋颗粒代替HAG 作为流加菌,成功实现了厌氧氨氧化反应器的快速启动,并对包埋颗粒的动力学特征进行了研究,为厌氧氨氧化菌种流加技术提供了新的思路和重要理论依据,并得出以下结论。
(1)以硝化膜和硝化污泥启动厌氧氨氧化反应器,添加厌氧氨氧化包埋颗粒作为流加菌,可以在49 d 内启动厌氧氨氧化反应器,并能维持稳定运行。此时反应器对NH+4-N 和NO-2-N 的去除率分别为80.7%和 83.1%,相应的去除负荷为 0.276 kg·m-3·d-1和0.306 kg·m-3·d-1。
(2)硝化污泥中的兼性菌会在包埋颗粒表面和附近形成厌氧氨氧化颗粒污泥,增加反应器局部厌氧氨氧化菌浓度,进而带动反应器内其他厌氧氨氧化菌的代谢作用,加快反应器启动,厌氧氨氧化包埋颗粒作为流加菌效应显著。
(3)厌氧氨氧化包埋颗粒具有与HAG 相似的动力学性能,对基质氨和亚硝酸的半速率常数(Km) 分别为1.57 mmol·L-1(21.98 mg·L-1)和1.505 mmol·L-1(21.05 mg·L-1),低于常规絮状厌氧氨氧化污泥的对应值,更容易在不利环境中获得基质;对氨和亚硝酸的抑制常数(Ki) 分别为 724.2 mmol·L-1(10138.8 mg·L-1)和66.65 mmol·L-1(933.1 mg·),远高于常规絮状厌氧氨氧化污泥的对应值,能承受更高的基质浓度,有利于缓解基质的自抑制作用。
[1]van de Graaf A A,de Bruijn P,Robertson L A,Jetten M S,Kuenen J G.Metabolic pathway of anaerobic ammonium oxidation on the basis of 15N studies in a fluidized bed reactor [J].Microbiology,1997,143:2415-2421
[2]Tang Chongjian(唐崇俭),Zheng Ping(郑平),Chen Tingting(陈婷婷).Inoculum,start-up and performance of Anammox process [J].CIESC Journal(化工学报),2010,61:2510-2516
[3]Jetten M S M,Wagner M,Fuerst J,van Loosdrecht M,Kuenen G,Strous M.Microbiology and application of the anaerobic ammonium oxidation (‘anammox’) process [J].Current Opinion in Biotechnology,2001,12:283-288
[4]Cong Yan(丛岩),Huang Xiaoli(黄晓丽),Wang Xiaolong(王小龙),Gao Dawen(高大文).Faster formation of Anammox granular sludge [J].CIESC Journal(化工学报),2014,65:664-671
[5]Hendrickx T L,Kampman C,Zeeman G,Temmink H,Hu Z,Kartal B,Buisman C J.High specific activity for anammox bacteria enriched from activated sludge at 10℃ [J].Bioresource Technology,2014,163:214-221
[6]Tsushima I,Ogasawara Y,Kindaichi T,Satoh H,Okabe S.Development of high-rate anaerobic ammonium-oxidizing (anammox) biofilm reactors [J].Water Research,2007,41:1623-1634
[7]Jin R C,Yang G F,Zhang Q Q,Ma C,Yu J J,Xing B S.The effect of sulfide inhibition on the ANAMMOX process [J].Water Research,2013,47:1459-1469
[8]Tang C J,Zheng P,Chen T T,Zhang J Q,Mahmood Q,Ding S,Chen X G,Chen J W,Wu D T.Enhanced nitrogen removal from pharmaceutical wastewater using SBA-ANAMMOX process [J].Water Research,2011,45:201-210
[9]Gilbert E M,Agrawal S,Karst S M,Horn H,Nielsen P H,Lackner S.Low temperature partial nitritation/anammox in a moving bed biofilm reactor treating low strength wastewater [J].Environmental Science & Technology,2014
[10]Dosta J,Fernandez I,Vazquez Padin J,Mosquera Corral A,Campos J,Mata Alvarez J,Mendez R.Short-and long-term effects of temperature on the Anammox process [J].Journal of Hazardous Materials,2008,154:688-693
[11]van der Star W R,Abma W R,Blommers D,Mulder J W,Tokutomi T,Strous M,Picioreanu C,van Loosdrecht M.Startup of reactors for anoxic ammonium oxidation:experiences from the first full-scale anammox reactor in Rotterdam [J].Water Research,2007,41:4149-4163
[12]Wett B.Solved upscaling problems for implementing deammonification of rejection water [J].Water Science & Technology,2006,53:121-128
[13]López H,Puig S,Ganigué R,Ruscalleda M,Balaguer M D,Colprim J.Start-up and enrichment of a granular anammox SBR to treat high nitrogen load wastewaters [J].Journal of Chemical Technology and Biotechnology,2008,83:233-241
[14]Dapena-Mora A,Campos J L,Mosquera-Corral A,Jetten M,Méndez R.Stability of the ANAMMOX process in a gas-lift reactor and a SBR [J].Journal of Biotechnology,2004,110:159-170
[15]Tang Chongjian(唐崇俭),Zheng Ping(郑平),Wang Caihua(汪彩华),Zhang Jiqiang(张吉强),Chen Jianwei(陈建伟),Ding Shuang(丁爽).Granulation and characteristics of extracellular polymers of Anammox sludge in high-load EGSB reactor [J].CIESC Journal(化工学报),2010,61:732-739
[16]Chen Y,Zhou T,Yao S,Wu J L.Ethanol production by repeated batch and continuous fermentations bySaccharomyces cerevisiaeimmobilized in a fibrous bed bioreactor [J].Journal of Microbiology and Biotechnology,2013,23:511-517
[17]Dong Y,Zhang Z,Jin Y,Lu J,Cheng X,Li J,Deng Y Y,Feng Y N,Chen D.Nitrification characteristics of nitrobacteria immobilized in waterborne polyurethane in wastewater of corn-based ethanol fuel production [J].Journal of Environmental Sciences,2012,24:999-1005
[18]Li Zebing(李泽兵),Liu Changjing(刘常敬),Zhao Baihang(赵白航),Ma Jiaxuan(马家轩),Wang Xiaoyi(王晓毅),Li Jun(李军).Activity and inhibition characteristics of Anammox and heterotrophic denitrifier bacteria in a multi-substrate system [J].China Environmental Science(中国环境科学),2013,4:648-654
[19]Strous M,van Gerven E,Zheng P,Kuenen J G,Jetten M S.Ammonium removal from concentrated waste streams with the anaerobic ammonium oxidation (anammox) process in different reactor configurations [J].Water Research,1997,31:1955-1962
[20]Eaton A D,Franson M A H.Standard Methods for the Examination of Water & Wastewater[M].Washington,DC:American Public Health Association (APHA),2005:2001-3710
[21]Patureau D,Bernet N,Bouchez T,Dabert P,Delgenes J,Moletta R.Biological nitrogen removal in a single aerobic reactor by association of a nitrifying ecosystem to an aerobic denitrifier [J].Journal of Molecular Catalysis B:Enzymatic,1998,5:435-439
[22]Strous M,Kuenen J G,Jetten M S.Key physiology of anaerobic ammonium oxidation [J].Appl Environ Microb,1999,65:3248-3250
[23]Jetten M S,Strous M,Pas Schoonen K T,Schalk J,Dongen U G,Graaf A A,Logemann S,Muyzer G,Loosdrecht M,Kuenen J G.The anaerobic oxidation of ammonium [J].FEMS Microbiology Reviews,1998,22:421-437
[24]Zhang S H,Zheng P,Hua Y M.Anammox transited from denitrification in upflow biofilm reactor [J].Journal of Environmental Sciences,2004,16:1041-1045
[25]Yu Y C,Gao D W,Tao Y.Anammox start-up in sequencing batch biofilm reactors using different inoculating sludge [J].AppliedMicrobiology and Biotechnology,2013,97:6057-6064
[26]Jin Rencun(金仁村),Zheng Ping(郑平),Tang Chongjian(唐崇俭).Performance and process kinetics characteristics of ANAMMOX fixed-bed reactor [J].Journal of Chemical Industry and Engineering(China)(化工学报),2008,59:2518-2525
[27]Gee C S,Suidan M T,Pfeffer J T.Modeling of nitrification under substrate-inhibiting conditions [J].Journal of Environmental Engineering,1990,116:18-31
[28]Zheng Ping(郑平),Hu Baolan(胡宝兰).Kinetics of anaerobic ammonia oxidation [J].Chinese Journal of Biotechnology(生物工程学报),2001,17:193-198
[29]Zu Bo(祖波),Zhang Daijun(张代钧),Yan Qing(阎青).Effect of trace NO2and kinetic characteristics for anaerobic ammonium oxidation of granular sludge [J].Environmental Science(环境科学),2008,29:683-687
[30]Tang Chongjian(唐崇俭),Xiong Lei(熊蕾),Wang Yunyan(王云燕),Zheng Ping(郑平).Kinetic characteristics of high-rate ANAMMOX granules [J].Environmental Science(环境科学),2013,34:3544-3551
[31]Tang C J,Zheng P,Wang C H,Mahmood Q,Zhang J Q,Chen X G,Zhang L,Chen J W.Performance of high-loaded ANAMMOX UASB reactors containing granular sludge [J].Water Research,2011,45:135-144
[32]van de Graaf A A,de Bruijn P,Robertson L A,Jetten M S,Kuenen J G.Autotrophic growth of anaerobic ammonium-oxidizing micro-organisms in a fluidized bed reactor [J].Microbiology,1996,142:2187-2196
[33]Tang C J,Zheng P,Mahmood Q,Chen J W.Start-up and inhibition analysis of the Anammox process seeded with anaerobic granular sludge [J].Journal of Industrial Microbiology & Biotechnology,2009,36:1093-1100
[34]Zheng Ping(郑平),Xu Xiangyang(徐向阳),Hu Baolan(胡宝兰).Novel Biological Nitrogen Removal:Theory and Technology(新型生物脱氮理论与技术)[M].Beijing:Science Press,2004:76-112
[35]Bock E,Schmidt I,Stüven R,Zart D.Nitrogen loss caused by denitrifying Nitrosomonas cells using ammonium or hydrogen as electron donors and nitrite as electron acceptor [J].Archives of Microbiology,1995,163:16-20
[36]Zhu G L,Hu Y Y,Wang Q R.Nitrogen removal performance of anaerobic ammonia oxidation co-culture immobilized in different gel carriers [J].Water Science and Technology:A Journal of the International Association on Water Pollution Research,2009,59:2379-2386

