多西紫杉醇联合方案经动脉介入治疗结直肠癌肝转移的临床研究*
马友龙,郑海燕,祁海艳
(承德医学院附属医院 1.外四科,2.手术室 河北 承德 067000)
·新进展研究·
多西紫杉醇联合方案经动脉介入治疗结直肠癌肝转移的临床研究*
马友龙1,郑海燕1,祁海艳2
(承德医学院附属医院 1.外四科,2.手术室 河北 承德 067000)
目的探讨多西紫杉醇联合方案经动脉介入治疗结直肠癌肝转移的临床疗效及安全性。方法选取2009年1月-2011年12月期间该院收治的60例无法进行手术切除的结直肠癌肝转移患者作为研究对象,随机分为实验组和对照组,两组各30例。实验组患者经腹腔动脉缓慢灌注5-FU 750 mg/m2、亚叶酸钙200 mg/m2、奥沙利铂120 mg/m2,然后将超液化碘油+50 mg表柔吡星缓慢注入肿瘤的靶血管,第2天从股动脉穿刺管缓慢泵入多西紫杉醇75 mg/m2,4周为1个疗程,对照组采用同一个化疗方案进行全身静脉化疗。全部患者均进行随访,截止至2014年9月。比较两组的近期疗效、生存状况及不良反应。结果57例(实验组29例+对照组28例)患者至少完成2个疗程,其中实验组的整体疗效显著优于对照组(P<0.05)。实验组的临床受益率(CBR)为79.3%,显著优于对照组的50.0%(P<0.05);全部患者的中位生存时间是19.2个月,实验组第1、2及3年的总生存率为79.3%、51.7%和37.9%,其中3年生存率显著高于对照组的14.3%(P<0.05)。全部患者最常见的不良反应是白细胞减少,未出现严重的心、肝、肾等脏器损害及超敏反应。实验组的白细胞减少的发生率显著低于对照组(P<0.05),其余不良反应比较差异无统计学意义(P>0.05)。结论与全身静脉化疗相比,采用多西紫杉醇联合方案进行经动脉介入治疗可显著提高化疗药物在肿瘤组织中的有效浓度,肿瘤的近期控制效果及远期生存状况更令人满意,更加安全可靠,值得临床推广应用。
肝动脉栓塞化疗;多西紫杉醇;结直肠癌肝转移
结直肠癌是临床上常见的消化道恶性肿瘤,随着人们生活水平的提高及饮食习惯的改变,其发病率呈逐年上升的趋势。容易发生远处转移是结直肠癌的一大特征,而肝脏是其最常见的转移部位,结直肠癌常通过门静脉血流转移至肝脏,有研究报道约有20%的结直肠癌患者确诊时已存在肝转移,且肝转移是导致患者死亡的首要因素。手术切除是孤立性肝转移患者的首要治疗选择,但只有10%~20%的患者符合手术指征,故对于无法手术切除的肝转移患者常采用肝动脉栓塞化疗(transhepatic arterial chemotherapy and embolization,TACE)、全身化疗、射频治疗、中医中药等辅助治疗手段,其中TACE这种经动脉介入治疗是首选的非手术治疗选择,如何选择疗效好、毒性小、新的介入化疗方案来改善结直肠癌肝转移患者的预后,一直是国内外的研究热点。紫杉烷类药物是国际上一种新型一线抗癌药物,具有疗效好、广谱性强、副作用小等优势。通常紫杉烷类药物应用于结直肠癌肝转移患者的静脉全身化疗,但近年来其动脉灌注治疗越来越受到临床重视,国内已有研究[1-3],将紫杉烷类药物动脉灌注治疗应用于非细胞肺癌、宫颈癌、胃癌肝转移等,应用效果均较满意。本研究属于前瞻性的随机对照临床研究,将60例的结直肠癌肝转移患者随机分为观察组和对照组,分别给予TACE和全身静脉化疗,2组均采用多西紫杉醇联合方案,旨在比较经动脉介入途径治疗与全身化疗对结直肠癌肝转移患者的疗效及安全性,为临床治疗提供参考依据。
1 资料与方法
1.1研究对象
选取2009年1月-2011年12月承德医学院附属医院收治的结直肠癌肝转移患者60例。入选标准:①经组织病理学、细胞学及影像学等检查确诊为结直肠癌肝转移,影像学上均有可测量的肿瘤病灶,且均无法行手术切除者;②既往未接受任何化疗;③肝功能评级为ChildA或B级,KPS评分>80分。排除标准:①存在手术切除指征;②有严重的恶液质表现,无法耐受化疗;③随访条件很差,或治疗依从性较差,不配合本研究的治疗及随访。所有患者均自愿参加本研究,已将本研究的主要内容充分告知患者及其家属,并签署知情同意书,本研究已得到本院医院伦理审查委员会批准。所有患者根据随机数字表分为实验组和对照组。两组各30例。
1.2治疗方法
实验组患者采用经动脉介入治疗,选经股动脉穿刺法,插管行肝动脉数字化减影血管造影术(digital subtraction angiography,DSA)检查,根据DSA表现,证实肝内病变后经腹腔动脉缓慢灌注5-FU 750 mg/m2、亚叶酸钙200 mg/m2、奥沙利铂120 mg/m2,然后进行选择或超选择至肿瘤靶血管,将超液化碘油与50 mg表柔吡星充分混合成乳剂,缓慢注入肿瘤的靶血管,剂量以肿瘤完全充填为标准,术后保留股动脉穿刺管,第2天经输液泵缓慢泵入(>1 h)多西紫杉醇75 mg/m2,上述方案每4周为1个疗程。对照组患者采用全身静脉化疗,化疗方案、周期及剂量与实验组的一致。
1.3观察指标及随访
1.3.1近期疗效评价在2个疗程后通过观察患者治疗前后的影响学表现来评价其近期疗效,若患者肝脏有多个可测量的病灶但无法全部进行评价时,选择其中5个病灶来进行评价。疗效标准参考实体瘤近期疗效评价标准,分为完全缓解(complete remission,CR)、部分缓解(partial response,PR)、稳定(stable disease,SD)和进展(progress disease,PD),计算有效率(response rate,RR)=(CR例数+PR例数)/总例数×100%;临床受益率(clinical benifit rate,CBR)=(CR例数+PR例数+SD例数)/总例数×100%。
1.3.2生存状况所有患者出院后均通过门诊、电话、书信等方式进行随访,将患者死亡作为随访终点,随访截止时间是2014年9月,计算患者的总生存时间,即结直肠癌肝转移确诊日期至死亡或随访截止时间之间的时间,以月为单位进行计算。
1.3.3不良反应根据WHO制定的抗癌药物急性和亚急性毒性表现及分级标准来观察并评价患者的不良反应,严重程度分为0~Ⅳ级,Ⅳ级最严重。
1.4统计学方法
采用SPSS 18.0统计软件进行数据处理,计量资料以均数±标准差(x±s)表示,计数资料用χ2检验并行t检验,等级资料用Wilcox秩和检验,用Kaplan-Meier法方法评估生存状况并用Log-rank方法进行检验,P<0.05为差异有统计学意义。

表1 两组基线资料比较 例(%)

表2 两组近期疗效比较 例(%)
2 结果
2.1基线资料
2组的性别、年龄、原发肿瘤部位等基线资料比较,差异无统计学意义(P>0.05),具有可比性。其中实验组的3例肝外转移患者分别为肺转移2例,肝门淋巴结转移1例;对照组的2例肝外转移患者分别为肝门淋巴结及腹腔转移各1例。见表1。
2.2近期疗效评价
60例患者中有3例患者(实验组1例+对照组2例)在治疗1个疗程后因其他原因未继续接受治疗,无法评价其近期疗效。结果表明,实验组的整体疗效显著优于对照组,差异有统计学意义(P=0.045)。实验组、对照组的RR分别为44.8%、28.6%,两组比较差异无统计学意义(χ2=1.618,P=0.156),而实验组的CBR为79.3%,显著优于对照组的50.0%,差异有统计学意义(χ2=5.373,P=0.024)。见表2。
2.3生存状况
在57例至少完成2个疗程的患者(实验组29 例+对照组28例)中,实验组和对照组患者的中位疗程数分别为6.0和5.5个,其总生存时间为6~68个月不等,中位生存时间是19.2个月,其中实验组1、2年的总生存率与对照组比较,差异无统计学意义(P=0.125和0.075),而实验组患者3年总生存率为37.9%,显著高于对照组的14.3%,差异有统计学意义(P=0.043)。见表3。
2.4不良反应
57例至少完成2个疗程的患者(实验组29例+对照组28例)中最常见的不良反应是白细胞减少,其次是脱发、血小板减少、恶心呕吐,其他如腹泻、便秘、腹胀、腹痛等均很少发生,且均轻微,无需特殊处理。全部患者中未出现严重的心、肝、肾等脏器损害及超敏反应。两组不良反应发生率比较,实验组的白细胞减少的发生率显著低于对照组,差异有统计学意义(P=0.038),其余不良反应比较差异无统计学意义(P>0.05)。见表4。

表3 两组生存状况比较 %
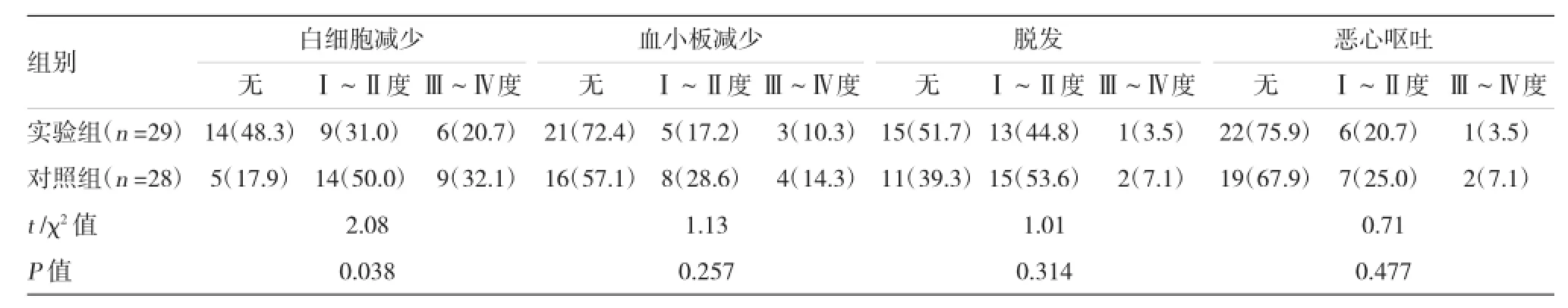
表4 两组主要不良反应比较 例(%)
3 讨论
肝脏是结直肠癌最常见的血行转移部位,目前认为手术切除仍然是首选治疗方案,但手术切除对患者影响较大。同时术后再次复发的也较为常见,对于某些小的转移灶,CT等影像学检查不易检出,故手术切除存在不彻底性,并且多数肝转移癌患者已经无手术指征,故多数研究的重点在TACE、全身静脉化疗等非手术治疗方法上,其中化疗药物仍然是目前杀死癌细胞的主要工具,其作用的效果取决于化疗药物的有效浓度及其在癌灶内的存留时间,肿瘤组织中的化疗药物有效浓度越高,其对癌细胞的活性抑制作用更强,有利于其杀伤癌细胞,疗效更显著。单一的全身静脉化疗时,抗癌药物主要随血流在全身静脉内大量分布,而进入肝动脉的药物较少,有效浓度较低,疗效欠佳,难以显著改善患者的生存质量及预后。
正常情况下,肝脏组织75%的血供来自门静脉,但对于肝转移癌而言,超过90%的血供来自肝动脉,并且肿瘤体积越大,动脉血供的应得越多,巨大的肝转移癌几乎只被肝动脉的分支所供应,这就为经肝动脉进行局部介入治疗(包括肝动脉栓塞术等)提供了理论基础,已有研究[4]报道经肝动脉灌注化疗在结直肠癌肝转移瘤患者的疗效,使部分无法手术患者变为可接受治疗,总体生存状况令人满意。TACE是在肝动脉灌注化疗的基础上联合肝动脉栓塞术,发挥了两者的协同作用。在进行TACE之前,首先通过造影了解该患者的肝动脉走形及肿瘤血供,再将高浓度的化疗药物直接灌注到肿瘤所在部位,提高其在肿瘤内部的有效浓度,延长化疗药物在肝脏的作用时间,同时高浓度的化疗药物也直接作用于肝动脉及其分支,损伤血管内膜,引起充血水肿并缩窄血管腔,减少或部分阻断肿瘤的血供,从而促进肿瘤细胞的变形坏死。并且,超选择性碘油或微球栓塞术可使栓塞剂聚集在超选的血管内,长期滞留在肿瘤组织内,直到血管完全栓塞为止,配合高浓度化疗药物可提高化疗药物对肿瘤细胞的杀伤效果,可缩小部分瘤体的体积,甚至可达到“可切除的标准”。与全身化疗比较,TACE不仅有效提高化疗药物在肿瘤组织的局部浓度,减少抗癌药物在血液中与血浆蛋白结合的机会,显著降低其在外周血液中的药物浓度,减少其全身毒副作用的发生风险,提高其有效性和安全性。除此之外,此法对于肝脏内潜在的转移性病灶及其周围的淋巴系统转移同样有杀灭或抑制作用,有望减少肝脏转移的风险,并且经动脉注入的化疗药物还能再次进入体循环,对全身的临床或亚临床转移灶也能起到一定的作用,同时可通过静脉回流再次流入肿瘤部位起到第2次化疗作用[5-8]。VOGL等[9]的研究对化疗失败的结直肠癌肝转移瘤患者进行TACE,结果表明62.9%的患者的病情得到一定的控制,TACE治疗后的中位生存期达到14个月,肝转移瘤确诊后中位生存期达到38个月,1、2年的生存率为62%和28%,临床疗效令人满意。2012年意大利的一项多中心临床试验[10]采用包被伊立替康的药物洗脱微球进行TACE治疗结直肠癌肝转移瘤,结果表明与单纯全身静脉化疗比较,TACE组的无进展生存时间从4个月提高到7个月,总生存时间也从15个月提高到22个月,明显改善患者的预后。
紫杉类药物是由紫衫的树皮、树干或针叶中提取出来的或半合成的有效成分制成,目前临床上主要采用紫杉醇和多西紫杉醇两种药物,前者是天然药物,后者是一种半合成的紫杉烷类抗肿瘤药物,主要作用在细胞的微管,通过促进微管聚合,阻断微管的正常解聚及重组,使细胞不能进行正常的有丝分裂而停止在G2/M期,且能抑制bcl-2的基因表达,抑制血管内皮生长因子的分泌及成纤维细胞生长因子的表达[11]。由于其独特的作用机制及在不断进行的临床研究中显现出来的优于多数标准化疗方案疗效的优势,多西紫杉醇已经成为临床上广泛应用的化疗药物之一,主要应用在非小细胞肺癌、乳腺癌、前列腺癌等恶性肿瘤中,在临床应用中也常联合其他化疗药物,以进一步提高疗效,降低全身毒副作用。目前,紫杉烷类主要应用在肿瘤的全身静脉化疗中,经动脉灌注治疗的研究较少,主要在非细胞肺癌[1]、宫颈癌[2]、胃癌肝转移等[3]肿瘤中有所应用,其研究结果均令人满意,安全可靠。本研究采用多西紫杉醇联合奥沙利铂、5-FU、亚叶酸钙的方案进行TACE,以往已有研究[12]采用奥沙利铂联合5-FU、亚叶酸钙进行TACE治疗中晚期原发性肝癌患者,疗效和安全性均令人满意。本研究在此基础上加用多西紫杉醇,并以同一种方案进行全身经脉化疗,结果表明实验组的整体疗效显著优于对照组(P<0.05)。实验组的CBR为79.3%,显著优于对照组的50.0%(P=0.024)。实验组3年总生存率为37.9%,显著高于对照组的14.3%(P=0.043)。故与单纯全身静脉化疗比较,TACE无论是在近期疗效方面,还是在远期生存状况方面均有显著优势,可在短期内控制肿瘤的进展,提高疗效。不良反应方面,实验组的白细胞减少的发生率显著低于对照组(P=0.038),但多数不良反应发生率及严重程度方面两组比较,差异无统计学意义,这可能与本研究的例数较少有关,故更有说服力的结果有待大样本的多中心临床研究所证实。值得注意的是TACE是一个有创的医源性操作,虽然本研究中实验组患者无严重的心、肝、肾等脏器的不良反应,但其仍然存在一定的风险,如果局部化疗药物剂量过大同样可引起肝癌栓塞后综合征(发热、腹痛、恶心、呕吐等)、肝衰竭、肾衰竭等不良反应[13],本研究建议在局部灌注化疗药物的剂量方面尽早进行明确统一的规定,以此来保证TACE的安全性。
综上所述,与全身静脉化疗相比,采用多西紫杉醇联合方案进行经动脉介入治疗可显著提高化疗药物在肿瘤组织中的有效浓度,肿瘤的近期控制效果及远期生存状况更令人满意,更加安全可靠,值得临床推广应用。
[1]王宏,王卫中,孙媛媛.紫杉醇动脉灌注治疗非小细胞肺癌疗效观察[J].中国肿瘤临床与康复,2008(5):445-446.
[2]黄兴华.多西紫杉醇联合奥沙利铂经动脉给药治疗局部晚期子宫颈癌疗效观察[J].现代中西医结合杂志,2014,23:2582-2583.
[3]冯龙,郭武华,李凌.多西紫杉醇联合顺铂和5-Fu化疗栓塞联合CF/5-Fu静脉化疗治疗胃癌肝转移的临床观察[J].重庆医学,2012,32:3428-3429.
[4]KEMENY NE1,MELENDEZ FD,CAPANU M,et al.Conversion toresectabilityusinghepaticarteryinfusionplussystemic chemotherapy for the treatment of unresectable liver metastases from colorectal carcinoma[J].J Clin Oncol.2009,27(21):3465-3471.
[5]POWER DG,KEMENY NE.The role of floxuridine in metastatic liver disease[J].Mol Cancer Ther,2009,8(5):1015-1025.
[6]YATSUOKA T,NISHIMURA Y,SAKAMOTO H,et al.A case of recurrent rectal cancer with paraaortic lymph node metastasis treated by FOLFIRI therapy leading to complete response[J].Gan To Kagaku Ryoho,2011,38(12):2057-2059.
[7]KRIDEL R,COCHET S,ROCHE B,et al.Successful closure of anal cancer-related fistulas with upfront intra-arterial chemotherapy:a report of 8 cases[J].Dis Colon Rectum,2011,54(5):566-569.
[8]MORISEZ,SUGIOKAA,KATOR,etal.Transarterialchemoembolization with degradable starch microspheres,irinotecan,and mitomycin-C in patients with liver metastases[J].J Gastrointest Surg,2006,10(2):249-258.
[9]VOGL TJ,GRUBER T,BALZER JO,et al.Repeated transarterial chemoembolization in the treatment of liver metastases of colorectal cancer:prospective study[J].Radiology.2009,250(1): 281-289.
[10]FIORENTINI GI,ALIBERTI C,TILLI M,et al.Intra-arterial infusion of irinotecan-loaded drug-eluting beads(DEBIRI)versus intravenous therapy(FOLFIRI)for hepatic metastases from colorectal cancer:final results of a phaseⅢ study[J].Anticancer Res,2012,32(4):1387-1395.
[11]张明军.降低多西紫杉醇不良反应的可行性临床研究[D].安徽医科大学,2009.
[12]高嵩,朱旭,杨仁杰.TACE联合奥沙利铂、氟尿嘧啶、亚叶酸钙肝动脉化疗治疗中晚期原发性肝癌 [J].介入放射学杂志,2012(5): 377-383.
[13]DEL PRETE M,FIORE F,MODICA R,et al.Hepatic arterial embolization in patients with neuroendocrine tumors[J].J Exp Clin Cancer Res,2014,33:43.
(张蕾 编辑)
Clinical research of Docetaxel combination regimen by artery interventional treatment for liver metastasis from colorectal cancer*
You-long MA1,Hai-yan ZHENG1,Hai-yan QI2
(1.The Fourth Department of Surgery,2.Operation Room,the Affiliated Hospital of Chengde Medical College,Chengde,Hebei 067000,P.R.China)
【Objective】To investigate the clinical effect and safety of Docetaxel combination regimen by artery interventional treatment for patients with liver metastasis from colorectal cancer.【Methods】A total of 60 patients with unresectable liver metastasis from colorectal cancer from Jan.2009 to Dec.2011 were enrolled for the study and randomly divided into experimental group and control group with 30 cases in each group.The patients in the experimental group were given 5-FU 750 mg/m2,calcium folinate 200 mg/m2and Oxaliplatin 120 mg/m2by perfusion of celiac artery,then lipiodol emulsion and Epirubicin 50 mg were slowly injected into the target vessels of the tumor.On the second day,Docetaxel 75 mg/m2was slowly pumped into femoral artery puncture tube,and the treatment course was 4 weeks.The cases in the control group were given the same regimen by systemic vein chemotherapy.All the cases were followed up till Sep.2014.The recent curative effect,survival condition and adverse reactions were compared between both groups.【Results】Among the 60 patients,57 cases(29 cases in the experimental group and 28 cases in the control group)
at least two courses of complete treatment.In them,the overall curative effect of the experimental group was superior to that of the control group(P<0.05).The clinical benefit rate(CBR)in the experimental group was 79.3%,which was significantly higher than 50.0%in the controls(P<0.05).The median survival time of all the cases was 19.2 months;and one-year,two-year and three-year survival rates in the experimentalgroupwere79.3%,51.7%and37.9%respectively.Thethree-yearsurvivalrateinthe experimental group was significantly higher than that in the control group(14.3%,P<0.05).Leukopenia was the most common adverse reaction.There was no serious heart,liver,kidney or other viscera damage or allergic reaction.The incidence of leukopenia in the experimental group was significantly lower than that in the control group(P<0.05),and there were no significant differences in incidences of other adverse reactions between both groups(P>0.05).【Conclusions】 Compared with systemic vein chemotherapy,Docetaxel combination regimen via artery interventional treatment could significantly raise the effective concentration of chemotherapeutic drugs in tumor tissue,have more satisfied short-term tumor control effect and long-term survival condition,which is safer,more reliable and worthy of clinical promotion and application.
transhepaticarterialchemotherapyandembolization;Docetaxel;livermetastasisfrom colorectal cancer
R735.3
B
1005-8982(2015)33-0065-06
2015-06-29
河北省卫生厅科研项目(No:20122127)

