重组人促红细胞生成素对急性脑损伤大鼠的神经保护作用研究
于代华,孙绪德,柴 伟,高昌俊
(第四军医大学唐都医院麻醉科,西安 710038)
针对急性脑损伤神经保护的研究虽然很多,但是目前尚没有一种理想的药物应用于临床,因此,寻找新型高效的脑保护药物以防治急性脑损伤是临床上亟待解决的难题。近年研究发现,重组人促红细胞生成素(recombinant human erythropoietin,rh-EPO)不仅对肾脏具有保护作用[1-3],对心脏[4-7]和中枢神经系统同样具有良好的保护作用,是对预防和治疗急性脑损伤具有很好的临床应用前景[8-9]。研究表明rh-EPO可降低缺血缺氧导致的细胞外谷氨酸浓度升高、降低谷氨酸诱导的神经细胞死亡、减轻中枢神经系统(CNS)的缺血再灌注损伤,在基础与临床研究中均表现出对脑缺血再灌注的保护作用[10]。但rh-EPO并非通过增加红细胞容积来发挥神经保护作用[11],目前其作用机制,尤其是细胞内信号机制还不明确,为临床的进一步应用带来困难,成为一个亟待解决的涉及基础理论的临床问题。
本实验拟在大鼠急性脑损伤模型的基础上,以谷氨酸转运体GLT-1和GLAST信号通路为切入点,研究rh-EPO对急性脑损伤的保护作用及对GLT-1和GLAST表达的影响,以阐明GLT-1和GLAST信号通路在rh-EPO诱导急性脑损伤保护机制中的作用,为探讨急性脑损伤保护提供新的手段和理论依据。
1 材料与方法
1.1 主要药品和试剂 rh-EPO注射液(国药准字号S20010001,10000国际单位/支)由沈阳三生制药股份有限公司生产。大鼠GLT-1、GLAST ELISA试剂盒购自上海酶联生物科技有限公司。Bio-Rad蛋白定量试剂盒、荧光染料SYBR GreenⅡ购自上海宝曼生物科技有限公司。
1.2 实验分组 60只SD大鼠(300~350g,雌雄不限,由第四军医大学动物实验中心提供)分为3组:对照组(n=18)、急性脑损伤组(n=22)和rh-EPO处理组(n=20),急性脑损伤组和EPO处理组用自由落体打击器制作脑外伤模型,rh-EPO处理组在制作脑损伤模型15min后经腹腔注射rh-EPO 3000 U/kg。各组大鼠实验完成48h后,3%戊巴比妥(10mg/kg)过量麻醉,立即断头取脑。
1.3 急性脑损伤模型的制备[12]采用改良Feeney′s自由落体打击器制作急性脑损伤模型。将大鼠提前3d单独喂养,术前禁食8h。实验时用10%水合氯醛以350mg/kg体质量腹腔注射进行麻醉,俯卧位固定于脑立体定向仪(江湾1型)上。消毒皮肤,正中切开,剥离骨膜,暴露右顶骨,用牙科钻在冠状缝后1.5mm,中线旁2.5mm处钻一直径5.0mm骨窗,保持硬膜完整。将撞杆置于硬膜上,用20g砝码于30cm高处沿外周导管坠落,撞击撞杆从而撞击硬膜,致右顶叶轻度脑挫裂伤,致伤冲击力大小为600g/cm。打击后切口内滴注4×104U硫酸庆大霉素4~5滴,骨蜡封闭骨窗,缝合头皮。对照组仅开颅窗后用骨蜡封闭,不施加打击。
1.4 RT-PCR 检测 GLT-1和 GLAST mRNA表达量变化提取各组组织匀浆总RNA,行反转录获得cDNA模板。引物设计采用Primer Express(ABI公司,美国),在Prism 7500real time-PCR仪(ABI公司,美国)上进行反应扩增。设计GLT-1引物序列:上 游 5′-CAG AGG GAC AAC AGC AAT GA-3′,下游5′-CCG TGT AAA CCA AAG CCT A-3′,扩增片段长度为299bp。退火温度为51℃,32次循环。用β-actin作为内参照,采用荧光染料SYBR GreenⅡ进行标记,用ABI Prism 7500SDS软件分析PCR反应获得的数据。
1.5 Western blot检测GLT-1和GLAST蛋白量的变化 将收集的组织匀浆用含蛋白酶抑制剂的RIPA缓冲液裂解,然后用Bio-Rad蛋白定量试剂盒(Bio-Rad公司,美国)进行蛋白定量。取20μg处理好的蛋白样品行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析,然后转移至聚偏氟乙烯(PVDF)膜,5%脱脂奶粉室温封闭1h,将PVDF膜与第一抗体(1∶1000)4℃孵育过夜;PBST缓冲液洗膜3次,每次10 min,加入第二抗体室温孵育1h,再次洗膜3次,每次10min。使用化学发光法显影检测目的蛋白的条带变化,并以β-actin作为对照。
1.6 统计学处理 采用SPSS15.0软件进行统计和数据分析,计量资料以表示,组间比较采用方差分析(ANOVA)处理,组内比较采用t检验,以P<0.05为差异有统计学意义。
2 结 果
大鼠脑损伤区GLT-1和GLAST mRNA表达量以相对端粒酶活性表示,与对照组比较,急性脑损伤后48h,急性脑损伤组脑损伤区GLT-1和GLAST mRNA表达较对照组均显著降低(P<0.01);与急性脑损伤组比较,rh-EPO处理组 GLT-1和GLAST mRNA表达均显著增加(P<0.01)。见图1。
与对照组比较,急性脑损伤后48h,急性脑损伤组脑损伤区GLT-1和GLAST蛋白表达均显著降低(P<0.01);与急性脑损伤组比较,rh-EPO处理组GLT-1和GLAST蛋白表达均显著增加(P<0.01)。见图2。

图1 RT-PCR检测各组GLT-1和GLAST mRNA表达变化(n=10)
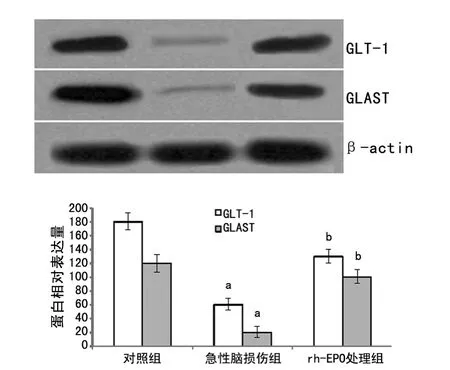
图2 Western blot检测各组GLT-1和GLAST蛋白表达变化(n=10)
3 讨 论
一般认为,EPO作为一种促红细胞生长因子,可促进造血干细胞的增殖与分化。近年来许多研究均表明EPO除了增加红细胞容积之外,对重要器官如肾脏、心脏和神经系统的缺血缺氧性损伤具有明确的保护作用。此前对于EPO是否能透过血脑屏障的问题也曾有过争议,有学者提出,EPO是一种分子量巨大的糖蛋白,静脉注射不能透过血脑屏障到达脑部,但Brines等[13]研究表明,EPO是一种能被选择性转运的大分子物质,在缺乏神经损伤时,EPO可以由血液循环透过血脑屏障进入脑实质。将rh-EPO进行生物素标记后发现,静脉注射5 h后可在动物血脑屏障微血管周围观察到生物素标记的rh-EPO并且进入了脑实质,说明rh-EPO是可以透过血脑屏障的。另外,血脑屏障受损也可使rh-EPO加速通过血脑屏障。
大量动物和临床实验证实,缺血缺氧时脑内兴奋性神经递质谷氨酸大量释放,细胞外高谷氨酸浓度与神经损伤密切有关,这也可能是导致脑细胞损伤的主要原因[14]。谷氨酸既是一种神经递质,同时也具有兴奋性神经毒性,细胞外过高的谷氨酸产生的神经毒性可导致神经细胞死亡。在正常情况下,谷氨酸储存于突触前的囊泡内,当动作电位到达神经接头时,谷氨酸被释放到突触间隙,将神经冲动的信号传递到突触后神经元。通常,释放到突触间隙的谷氨酸主要由星型胶质细胞的谷氨酸转运体GLT-1和GLAST回收到细胞内,在星形胶质细胞内被转变成谷氨酰胺,然后安全地转运到神经元。过表达GLT-1可明显降低缺氧导致的脑损伤[15]。在多种表达于中枢神经系统的谷氨酸转运体中,GLT-1和GLAST主要表达在星形胶质细胞,类似于离子通道样作用的GLT-1和GLAST回吸收了90%的递质性谷氨酸,在调节突出间隙兴奋性谷氨酸浓度中起重要作用。用GFAP启动子控制的星形胶质细胞特异过表达GLT-1,在氧糖剥夺实验性脑片中对神经细胞具有明显保护作用[16-17]。在病理条件下,如果 GLT-1和 GLAST的转运活性下降或表达下调,可导致胞外谷氨酸浓度升高并引起兴奋性神经毒性。此时,谷氨酸转运体也可能发生双向转运,将细胞内的谷氨酸转运到胞外,增加谷氨酸的神经毒性[18]。除胶质细胞外,神经元也少量表达GLT-1和GLAST,转运少量谷氨酸进入细胞。
EPO对急性脑损伤的保护作用是目前国内外研究的热点,但目前机制仍不十分清晰[19-22]。本研究结果表明,急性脑损伤后48h,大鼠脑损伤区GLT-1和GLAST表达显著降低,而rh-EPO处理后GLT-1和GLAST较急性脑损伤组显著增加,说明GLT-1/GLAST信号机制在rh-EPO对急性脑损伤的保护作用中发挥重要作用。
综上所述,rh-EPO可以有效减轻急性脑损伤,减少损伤区神经细胞凋亡的数量,具有明确的脑保护作用。但rh-EPO的这种急性脑保护作用并非来源于rh-EPO本身的促红细胞生成活性,可能与上调GLT-1和GLAST的转运活性和表达水平有关。
[1]MatějkováS,Scheuerle A,Wagner F,et al.Carbamylated erythropoietin-FC fusion protein and recombinant human erythropoietin during porcine kidney ischemia/reperfusion injury[J].Intensive Care Med,2013,39(3):497-510.
[2]Yang C,Zhao T,Lin M,et al.Helix B surface peptide administered after insult of ischemia reperfusion improved renal function,structure and apoptosis through beta common receptor/erythropoietin receptor and PI3k/Akt pathway in a murine model[J].Exp Biol Med,2013,238(1):111-119.
[3]Han X,Zhao L,Lu G,et al.Improving outcomes of acute kidney injury using mouse renal progenitor cells alone or in combination with erythropoietin or suramin[J].Stem Cell Res Ther,2013,4(3):74.
[4]Kagaya Y,Asaumi Y,Wang WT,et al.Current perspectives on protective roles of erythropoietin in cardiovascular system:erythropoietin receptor as a novel therapeutic target[J].Tohoku J Exp Med,2012,227(2):83-91.
[5]Watson AJ,Gao L,Sun L,et al.Enhanced preservation of the rat heart after prolonged hypothermic ischemia with erythropoietin-supplemented Celsior solution[J].J Heart Lung Transplant,2013,32(6):633-640.
[6]Roubille F,Micheau A,Combes SA,et al.Intracoronary administration of darbepoetin-alpha at onset of reperfusion in acute myocardial infarction:results of the randomized Intra-Co-EpoMI trial[J].Arch Cardiovasc Dis,2013,106(3):135-145.
[7]Talan MI,Latini R.Myocardial infarction:cardioprotection by erythropoietin[J].Methods Mol Biol,2013,982:265-302.
[8]丁倩,熊利泽.促红细胞生成素对中枢神经系统的保护作用[J].医学新知杂志,2005,15(2):53-55.
[9]Nandra KK,Collino M,Rogazzo M,et al.Pharmacological preconditioning with erythropoietin attenuates the organ injury and dysfunction induced in a rat model of hemorrhagic shock[J].Dis Model Mech,2013,6(3):701-709.
[10]Grewer C,Gameiro A,Zhang Z,et al.Glutamate forward and reverse transport:From molecular mechanism to transporter-mediated release after ischemia[J].IUBMB Life,2008,60(9):609-619.
[11]Tang Z,Sun X,Shi Q,et al.Beneficial effects of carbamylated erythropoietin against oxygen-glucose deprivation/reperfusion-induced astrocyte swelling:proposed molecular mechanisms of action[J].Neurosci Lett,2012;530(1):23-28.
[12]高燕,孙骏谟,田志雄,等.大鼠自由落体脑外伤模型的制作[J].浙江创伤外科,2004,9(5):283-285.
[13]Brines M,Ghezzi P,Keenan S,et al.Erythropoietin crosses the blood-brain barrier to protect against experimental brain injury[J].Proc Natl Acad Sci U S A,2000,97(19):10526-10531.
[14]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[15]Persson M,Rönnbäck L.Microglial self-defence mediated through GLT-1and glutathione[J].Amino Acids,2012,42(1):207-219.
[16]Harvey BK,Airavaara M,Hinzman J,et al.Targeted over-expression of glutamate transporter 1 (GLT-1)reduces ischemic brain injury in a rat model of stroke[J].PLoS One,2011,6(8):e22135.
[17]Weller ML,Stone IM,Goss A,et al.Selective overexpression of excitatory amino acid transporter 2(EAAT2)in astrocytes enhances neuroprotection from moderate but not severe hypoxia-ischemia[J].Neuroscience,2008,155(4):1204-1211.
[18]曾雯,屈艺,毛萌.脑缺血缺氧对谷氨酸转运体的影响[J].生物医学工程学杂志,2010,01(1):202-205.
[19]Tang ZH,Sun XC,Shi QH,et al.Beneficial effects of carbamylated erythropoietin against oxygen-glucose deprivation/reperfusion-induced astrocyte swelling:Proposed molecular mechanisms of action[J].Neurosci Lett,2012,530(1):23-28.
[20]Benderro GF,LaManna JC.Kidney EPO expression during chronic hypoxia in aged mice[J].Adv Exp Med Biol,2013,765:9-14.
[21]Ardalan MR,Estakhri R,Hajipour BA,et al.Erythropoietin ameliorates oxidative stress and tissue injury following renal ischemia/reperfusion in rat kidney and lung[J].Med Princ Pract,2013,22(1):70-74.
[22]Jun JH,Shin EJ,Kim JH,et al.Erythropoietin prevents Hypoxia-Induced GATA-4ubiquitination via phosphorylation of serine 105of GATA-4[J].Biol Pharm Bull,2013,36(7):1126-1133.

