不同血运重建方法对陈旧前壁心肌梗死合并左心室室壁瘤患者预后的影响
吕昀 曾亚莉 郭晔炳 柳景华 赵东晖 黄方炯 王盛宇 谢进生
室壁瘤是心脏局部室壁运动减弱或消失,呈瘤样膨出于心室表面的病理改变,为急性心肌梗死(acute myocardial infarction,AMI)后主要并发症之一。其90%以上于左前降支单支供血的左心室前壁发生大面积透壁性心肌梗死后形成,左心室室壁瘤常导致心功能不全、恶性心律失常、全身动脉栓塞甚至心脏破裂等严重后果。既往研究认为,冠状动脉旁路移植术(coronary artery bypass grafting,CABG)时合并行室壁瘤切除为左心室室壁瘤病变的首选治疗方式[1-3]。但随着经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)技术的不断改进,其与CABG 治疗相比疗效如何,目前国内外研究较少。本研究旨在比较两种血运重建方式对陈旧前壁心肌梗死伴左心室室壁瘤形成患者心功能的改善情况以及远期预后的影响,为临床治疗方式的选择提供依据。
1 对象与方法
1.1 研究对象
连续入选2005 年1 月至2010 年1 月在首都医科大学附属北京安贞医院住院、明确诊断为陈旧前壁心肌梗死伴室壁瘤形成、经EuroScore 评分系统[4]评分为中低危的患者223 例。其中129 例接受PCI 治疗,为PCI 组;94 例接受CABG 治疗(CABG合并室壁瘤切除、左心室成形术),为CABG 组。入选标准:(1)既往前壁AMI 史,即①持续胸痛≥30 min,含服硝酸酯类药物未缓解;②心电图超过2个相邻胸前导联ST 段抬高≥0.2 mV,和(或)心肌酶学升高超过正常上线值2 倍;③起病至入组时间≥3个月。(2)本次入院经超声心动图检查或心室造影证实存在左心室室壁瘤(内径<5 cm)。(3)EuroScore评分为中低危。排除标准:(1)近期有活动性出血。(2)曾行PCI 或CABG 治疗。(3)心功能Ⅳ级或心原性休克,接受过有创性心肺复苏。(4)主动脉夹层。(5)就诊前1 ~2 周内接受过其他手术或创伤性操作。(6)左心室室壁瘤内径≥5 cm。(7)合并左心室附壁血栓。(8)与室壁瘤显著相关的其他异常情况。(9)对比剂过敏或严重肺、肝、肾功能不全,预期寿命不超过6 个月的晚期肿瘤患者。
1.2 方法
1.2.1 超声心动图检查(UCG) 使用美国ACUSON 超声心动图仪,探头频率3.5 MHz,采用Simpson 法测量左心室射血分数(left ventricular ejection fraction,LVEF)、M 型超声技术测量左心室舒张末期内径(left ventricular end-diastolic diameter,LVEDd)、左心室舒张末期厚度、室间隔舒张末期厚度,根据Devereux 校正公式[5]计算左心室心肌质量,以体表面积校正为左心室心肌质量指数(left ventricular mass index,LVMI)。每一测量值均连续测量三个心动周期,取其平均数。上述测量所有入选患者均于术前、术后6 个月各进行一次。
1.2.2 PCI 成功标准 (1)操作成功:冠状动脉支架置入术后残余狭窄≤20%,TIMI 血流Ⅲ级且无手术期严重并发症(死亡、再次心肌梗死、急诊CABG)。(2)临床成功:操作成功后,患者心肌缺血症状和(或)体征缓解持续6 个月以上。
1. 2. 3 CABG 成功标准 患者均在全麻、体外循环支持下行CABG 合并室壁瘤切除、左心室成形术。手术成功定义为无围术期严重后果及并发症(死亡、出血、卒中、心肌梗死后心绞痛、再次心肌梗死)。
1.2.4 常规药物治疗 所有入选患者术后根据临床情况接受抗血小板聚集、降脂、血管紧张素转化酶抑制剂、β 阻滞剂等药物治疗。
1.3 随访
通过病历查询、电话、门诊复诊进行随访,登记患者一般情况、危险因素、术后用药情况、术前及术后6 个月超声心动图各项指标数值、术后平均36 个月主要终点事件(全因死亡、脑卒中、心肌梗死)及主要不良心脏事件(major adverse cardiac event,MACE,包括心原性死亡、非致死性心肌梗死、靶血管再次血运重建)发生情况等。
1.4 统计学分析
所有数据资料采用SPSS 19.0 统计软件进行分析。计量资料方差齐且符合正态分布的数据采用 珋x±s 表示,采用独立样本t 检验;方差不齐或非正态分布数据采用四分位数[M(Q)]表示,采用秩和检验。计数资料以频数(频率)表示,组间比较采用χ2检验。多因素分析采用Logistic 回归分析,生存分析采用Kaplan-Meier 曲线。以P <0.05 为差异有统计学意义。
2 结果
2.1 两组患者的一般资料比较
两组患者的年龄、性别构成、各项危险因素、室壁瘤大小、病变血管支数、随访时间、术后用药情况等一般资料比较,差异均无统计学意义(均P >0.05,表1)。
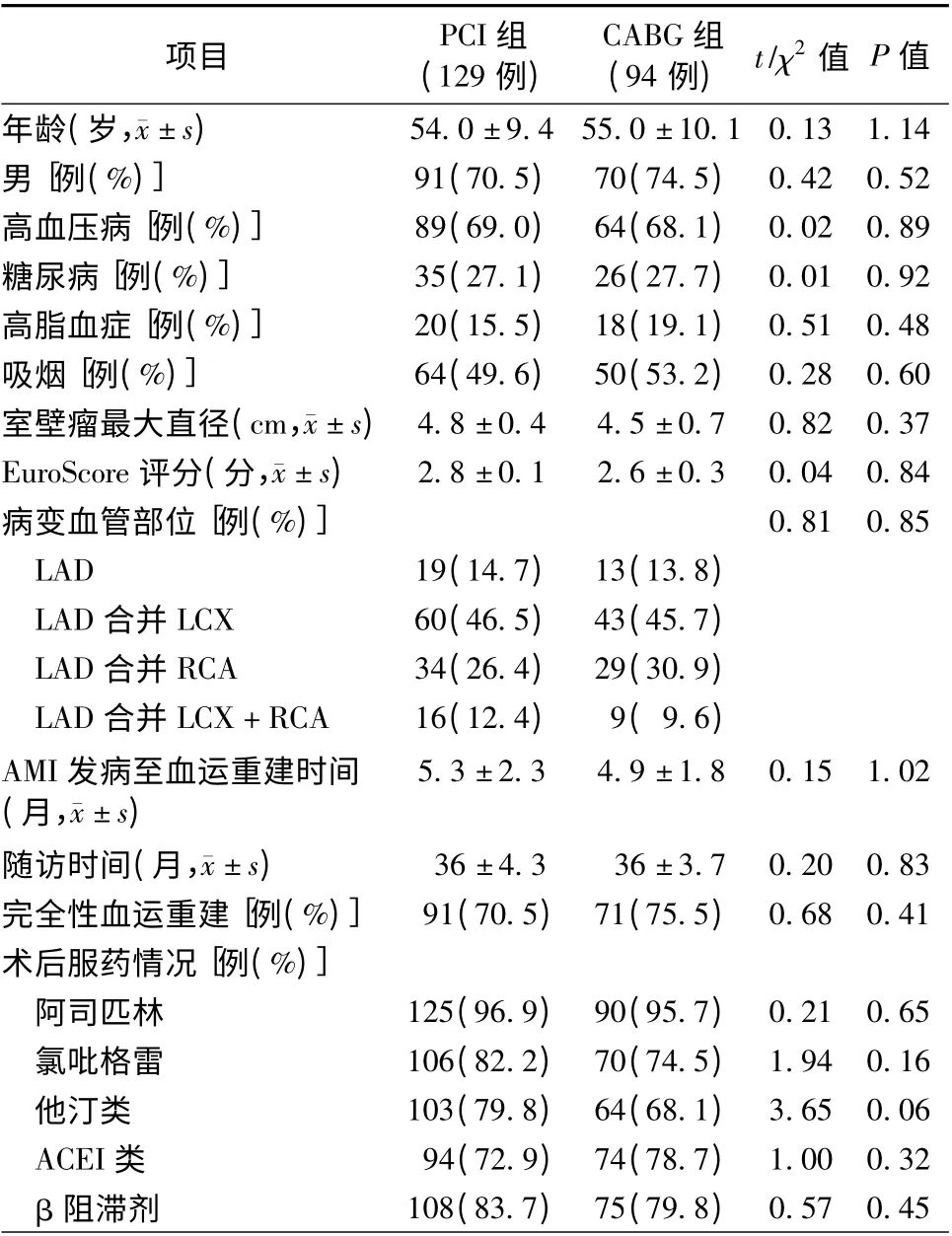
表1 两组患者的一般资料比较
2.2 两组患者超声心动图检查结果比较
(1)接受血运重建术前,PCI 组与CABG 组患者左心室舒张末期内径(LVEDd)[(58.12 ±10.01)mm比(61.75 ±5.85)mm]、左心室射血分数(LVEF)[(43.57 ±9.41)%比(42.98 ±10.98)%]、左心室质量指数(LVMI)[(122.47 ±15.36)g/m2比(126.22 ±16.58)g/m2]比较,差异均无统计学意义(均P >0.05)。(2)PCI 组术后6 个月较术前LVEDd[(52.32 ±4.23)mm 比(58.12 ±10.01)mm,P <0.05]、LVEF[(56.56 ± 9.65)% 比(43.57 ±9.41)%,P <0.05]和LVMI[(107.54 ±15.25)g/m2比(122.47 ±15.36)g/m2,P <0.05]显著改善。(3)CABG 组术后6 个月较术前LVEDd[(53. 65 ±3. 72)mm 比(61. 75 ± 5. 85)mm,P <0. 05]、LVEF [(57. 70 ± 10. 65 )% 比 (42. 98 ±10. 98)%,P <0. 05]和 LVMI [(109. 43 ±14. 35)g/m2比(126. 22 ± 16. 58)g/m2,P <0. 05]也显著改善。(4)术后6 个月,PCI 组患者心功能及左心室重塑改善程度低于CABG 组,但差异无统计学意义(P >0. 05)。
2.3 两组患者的随访结果比较
两组患者平均随访36 个月。Kaplan-Meier 生存曲线分析结果显示,PCI 组主要终点事件和MACE发生率高于CABG 组,但差异无统计学意义(13.2%比12.8%,χ2= 0.29,P >0.05;12.4% 比6.4%,χ2=2.22,P >0.05)。两组患者全因死亡(7.8% 比7.4%,χ2= 0.29)、脑卒中(1.6% 比4.3%,χ2=1.52)、心原性死亡(4.7%比4.3%,χ2=0.02)、非致死性心肌梗死(3.1% 比2.1%,χ2=0.19)、靶血管再次血运重建(6.2%比1.1%,χ2=3.70)的发生率比较,差异均无统计学意义(均P >0.05,表2、图1、图2)。
3 讨论
左心室室壁瘤形成是前壁AMI 后临床中常见的并发症,主要发生于失去收缩力的梗死区域与非梗死区域间的矛盾运动,坏死心肌在心腔压力作用下向外形成瘤样膨出,对梗死边缘心肌的牵拉导致进行性左心室重塑、心室扩大、左心功能下降,显著增加AMI 后恶性心脏事件的发生[6]。
血运重建治疗可以通过促进梗死愈合,减轻梗死室壁段扩展,使大量冬眠心肌恢复收缩功能,减轻室壁运动障碍,从而逆转左心室重塑,改善左心功能,对降低心肌梗死后MACE 事件的发生率和改善患者的预后至关重要。既往研究认为,外科行室壁瘤切除加CABG 术治疗,可使有血流动力学障碍的患者显著获益,被认为是陈旧前壁心肌梗死伴左心室室壁瘤形成最主要的治疗手段[7-12]。
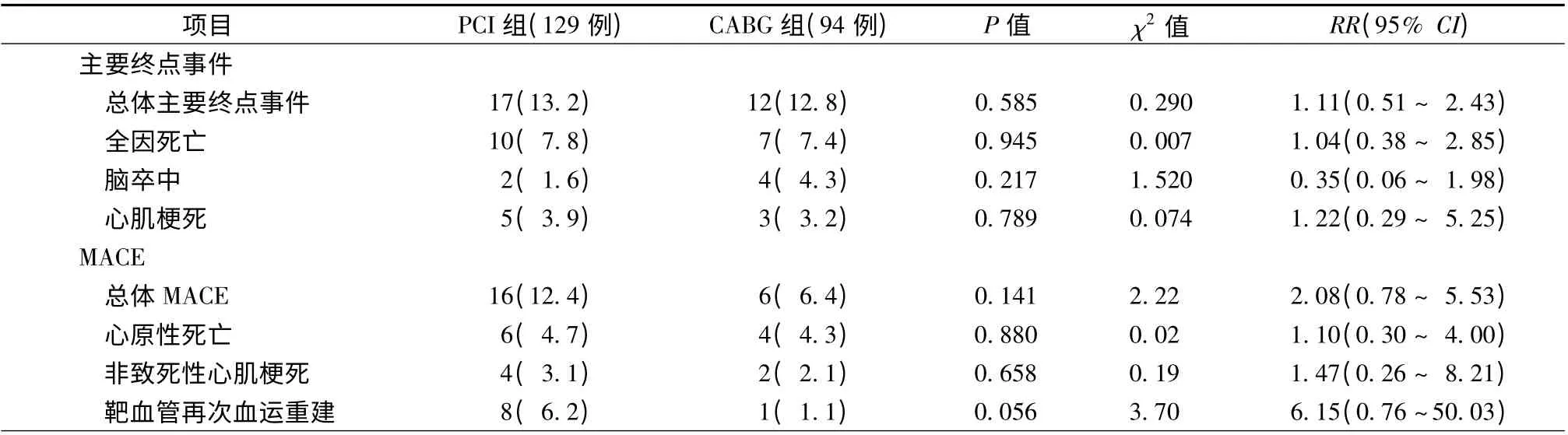
表2 两组患者的随访结果比较[例(%)]
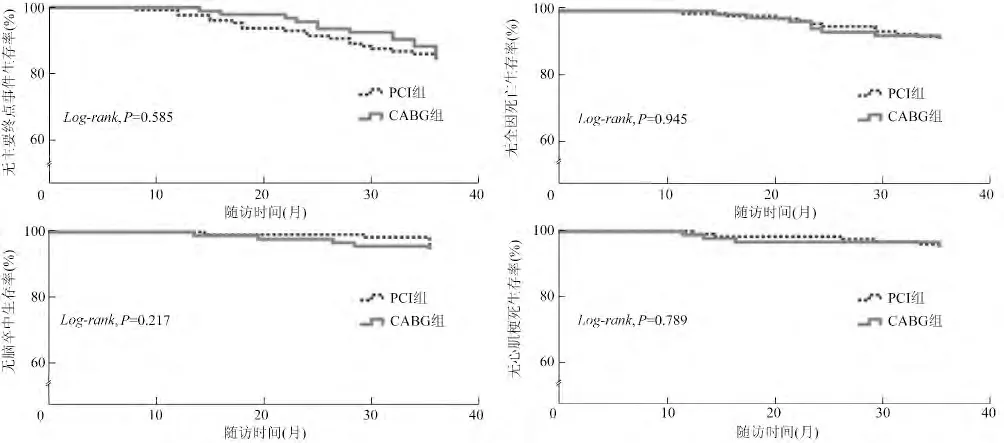
图1 两组患者平均随访36 个月无主要终点事件Kaplan-Meier 生存曲线
左心室室壁瘤伴有左心室增大、LVEF 降低和严重冠状动脉病变的患者,其预后不佳。尽管现代药物,包括血管紧张素转化酶抑制剂可有效控制此病的症状,但几年后就会出现心功能失代偿,此后病情恶化迅速,甚至发生死亡,5 年生存率为47%,10年生存率仅为18%[11]。因此,对心肌梗死后疑为左心室室壁瘤的患者,应密切随访,一旦出现心绞痛、充血性心力衰竭、室性心律失常或反复栓塞等症状,应建议患者接受手术。此外,对左心室室壁瘤伴有严重冠状动脉病变且有迹象表明左心室功能渐渐恶化(左心室舒张末期容积增大、LVEF 下降、二尖瓣反流增加)的患者,目前亦主张行手术治疗[13]。
需要手术治疗的左心室室壁瘤,正确地选择手术方式和切除范围是治疗成功的关键。切除范围的界定应从四方面考虑,即异常运动的室壁、瘢痕组织的分布、心室腔的几何结构及重建后左心室腔的大小。临床上,以术者用手指触摸心肌的收缩性来判断,显著变薄的穿壁瘢痕组织要切除,不能收缩的部分即使4 ~5 mm 厚也要切除,而显著收缩或增厚的部分则保留,然后行心肌再血管化。手术分两部分进行,首先处理室壁瘤、左心室成形,然后进行CABG 术。
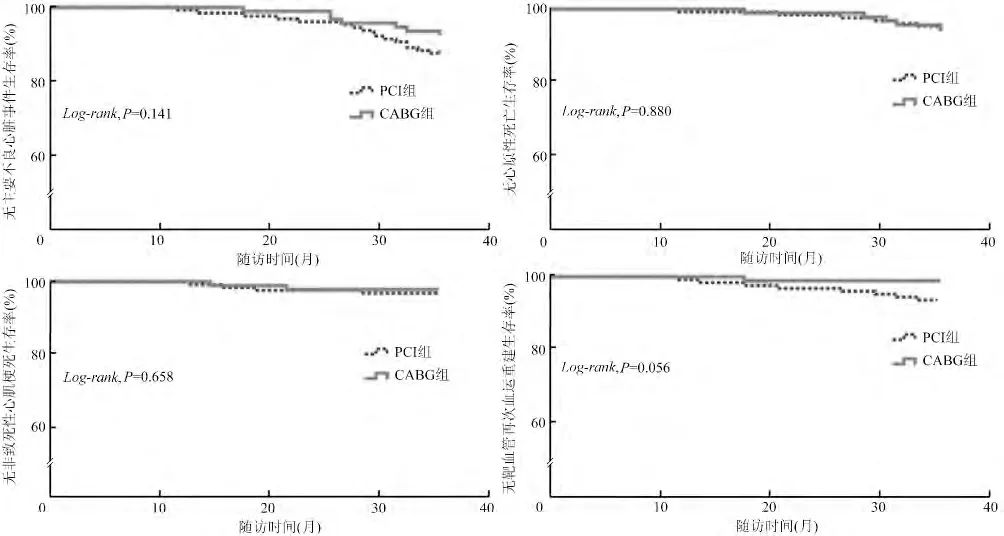
图2 两组患者平均随访36 个月无主要不良心脏事件Kaplan-Meier 生存曲线
实际临床工作中,由于CABG 创伤大、围术期死亡率高等原因,一些陈旧前壁心肌梗死伴左心室室壁瘤患者坚持选择PCI 治疗。近年来,随着PCI 技术的不断成熟及药物洗脱支架再狭窄率的降低,PCI术后室壁瘤患者的心功能改善及远期预后同样优于药物治疗。本研究结果显示,PCI 组和CABG 组患者均在术后6 个月LVEF 升高、LVMI 降低,但在心功能及左心室重塑改善方面,CABG 术有优于PCI的趋势。同时,对随访36 个月的结果进行Kaplan-Meier 生存曲线分析发现,PCI 术后患者主要终点事件的发生率较CABG 组差异无统计学意义(P >0.05)。
对于低中危陈旧前壁心肌梗死合并左心室室壁瘤患者,积极地血运重建(PCI 或CABG)均可在一定程度上抑制左心室负性重塑,提高LVEF,从而改善患者预后。
[1] Kucuker A,Cetin L, Kucuker SA, et al. Single-centre experience with perioperative use of intraaortic balloon pump in cardiac surgery. Heart lung Cric,2014,23:475-481.
[2] Castelvecchio S,Menicanti L. Left ventricular reconstruction:update to left ventricular aneurysm/reshaping techniques.Multimed Man Cardiothorac Surg,2013.
[3] Mori M,Sakakura K,Wada H,et al. Left ventricular apical aneurysm following primary percutaneous coronary intervention.Heart Vessels,2013,28:677-683.
[4] Nashef SA,Roques F,Michel P,et al. European system for cardiac operative risk evaluation (EuroSCORE ). Eur J Cardiothorac Surg,1999,16:9-13.
[5] Devereux RB,Alonso DR,Lutas EM,et al. Echocardiographic assessment of left ventricular hypertrophy:comparison to necropsy findings. Am J Cardiol,1986,57:450-458.
[6] Balsam LB,Grossi EA. Surgical ventricular reconstruction has a role in surgical remodeling in patients with LV systolic dysfunction even post-STICH?Prog Cardiovasc Dis,2013,55:481-486.
[7] 朱华刚,贾若飞,孟帅,等. 侧支循环对ST 段抬高急性心肌梗死再灌注治疗后心功能的影响. 中国介入心脏病学杂志,2014,22:149-152.
[8] Harchandani B,Reyentovich A. Medical management is the way to go for ventricular reconstruction post STICH?Prog Cardiovasc Dis,2013,55:476-480.
[9] Michler RE,Rouleau JL,Al-Khalidi HR,et al. Insights from the STICH trial:Change in left ventricular size after coronary artery bypass grafting with and without surgical ventricular reconstruction. J Thorac Cardiovasc Surg,2012,44:1-7.
[10] 马为,洪涛,李建平,等. 经皮心室重建术——附两例病例报告.中国介入心脏病学杂志,2013,21:274-276.
[11] O'Meara E,Mielniczuk LM,Wells GA,et al. Alternative Imaging Modalities in Ischemic Heart Failure (AIMI-HF)IMAGE HF Project I-A:study protocol for a randomized controlled trial. Trials,2013,14:218.
[12] 黄新生,周其文.左室室壁瘤的外科治疗. 心肺血管病杂志,2012,2:220-222.
[13] 樊红光,高歌,张昌伟,等. 左心室下侧壁室壁瘤行左心室重建术后的近中期结果.中国循环杂志,2014,3:220-223.

