冠状动脉慢血流性心绞痛危险因素初步分析
解翠 吕慧 高奋 巩书文 朱国斌 边云飞 杨志明
冠状动脉慢血流(coronary slow flow,CSF)是冠状动脉造影过程中冠状动脉无狭窄状态下出现对比剂缓慢通过管腔的现象。CSF 患者可表现为多种临床症状,包括不稳定型心绞痛,甚至急性心肌梗死,80% ~90%患者因反复出现心绞痛且急性加重,硝酸酯类药物无效而反复住院,严重影响生活质量[1]。鉴于此类心绞痛患者整个病程中未查及心肌损伤标志物的升高,称与CSF 相关的心绞痛为CSF 性心绞痛(coronary slow flow angina,CSFA)。CSFA 的发病机制尚不明确,本文初步探讨CSFA 的危险因素,为临床诊治提供依据。
1 对象与方法
1.1 研究对象
连续入选2008 年5 月至2011 年12 月行冠状动脉造影术的住院患者2842 例,通过阅读其造影资料,计数冠状动脉三支血管[前降支(LAD)、回旋支(LCX)、右冠状动脉(RCA)]TIMI 血流帧数(TFC)。以心绞痛症状为主诉且存在CSF 现象的患者64 例为CSFA 组,同时采用简单随机方法选取冠状动脉血管和血流均正常,无心绞痛患者64 例为正常对照组。两组患者均于造影前静脉或口服使用硝酸酯类药物,排除既往有器质性心脏病患者如心瓣膜病、心肌病、慢性肺源性心脏病、心肌梗死溶栓后、冠状动脉狭窄及血管成形术及NYHA 心功能分级Ⅲ级及以上、心肌桥、冠状动脉夹层,严重肝肾功能障碍,恶性肿瘤,除糖尿病外的其他内分泌疾病。根据世界卫生组织关于吸烟的标准定义为连续或累积吸烟6个月或以上者;饮酒的标准定义为每周饮酒至少2次,连续饮酒1 年以上者。
1.2 研究方法
1.2.1 一般资料 询问患者相关临床资料,包括年龄、性别、吸烟史、饮酒史、心血管或糖尿病家族史,记录患者此次住院时心率及血压数值。
1.2.2 血清尿酸测定及其他资料 所有入选患者均于入院次日采集空腹12 h 肘静脉血测定血清尿酸。血清尿酸以尿酸酶法测定,其他资料包括白细胞计数(WBC)、红细胞计数(RBC)、血小板计数(PLT)、单核细胞计数(MO)、淋巴细胞计数(LY)、谷氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、空腹血糖(FBG)、肌酸酐、总胆固醇(TC)、三酰甘油(TG)、总胆固醇/高密度脂蛋白胆固醇(TC/HDL)、低密度胆脂蛋白/高密度脂蛋白(LDL/HDL)、载脂蛋白A1(ApoA1)、载脂蛋白B100(ApoB100)、载脂蛋白A1/载脂蛋白B100 (ApoA1/ApoB100)、脂蛋白(a)[Lp(a)]、凝血酶原时间(PT)、部分活化的凝血酶原时间(APTT)、D-2 聚体等相关数据。根据心脏超声参数测定计算心输出量=(左心室舒张末期容积-左心室收缩末期容积)×心率。
1.3 判定方法
采用6 F Judkins 导管经桡动脉入径行冠状动脉造影。采用公认TFC 法判定冠状动脉血流速度,即大于已发表的TFC 的2 个标准差为CSF 现象[2]。即LAD(36.2 ±2.6)帧,LCX(21.2 ±2.1)帧,RCA(20.4 ±3.0)帧。因LAD 较长,将LAD 的TFC 除以1.7,即得到校正的TFC(corrected TIMI frame count,CTFC)。
1.4 统计学分析
采用SPSS 17.0 软件进行数据处理。连续数据以(珋x±s)表示,应用独立样本t 检验;计数资料以百分率表示,应用卡方检验;对性别、吸烟史、尿酸、ApoB100、TC/HDL、LDL/HDL、ApoAI/ApoB100 采用非条件Logistic 回归分析。以P <0.05 为差异有统计学意义。
2 结果
2.1 一般临床资料(表1)
CSFA组64 例患者中男49 例(76. 6%),平均年龄(53.2 ±10.3)岁;对照组64 例患者中男38 例(59.4%),平均年龄(55.8 ±10.2)岁。两组患者年龄、家族史、心率、收缩压、舒张压、WBC、RBC、PLT、MO、LY、ALT、AST、FBG、肌酸酐、TC、TG、ApoA1、Lp(a)、PT、APTT 及D-二聚体比较,差异均无统计学意义(P >0.05);性别、吸烟史等比较,差异有统计学意义(P <0.05);血尿酸、ApoB100、TC/HDL、LDL/HDL、ApoA1/ApoB100 比较,差异亦有统计学意义(P <0.01)。

表1 两组患者一般临床资料情况
2.2 冠状动脉造影TFC
CSFA 组冠状动脉各支血管的TFC、校正的LAD 和三支血管的平均TFC 均高于对照组(P <0. 05,表2)。
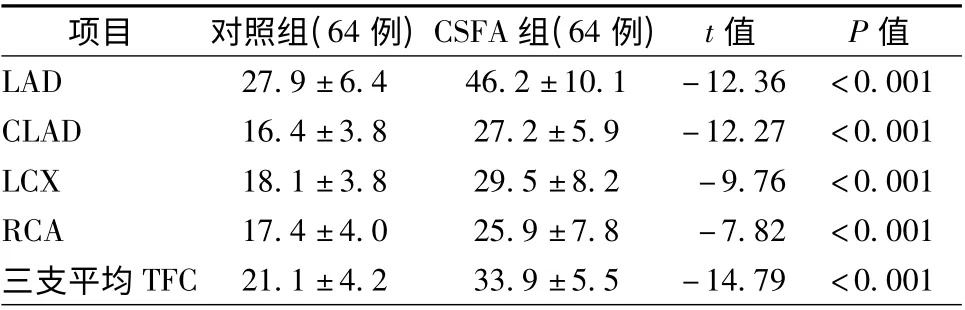
表2 两组患者血流帧数比较(帧,珋x±s)
2.3 CSF 相关因素分析
对性别、吸烟史、尿酸、ApoB100、TC/HDL、LDL/HDL、ApoA1/ApoB100 等危险因素进行非条件Logistic 回归分析,结果显示尿酸水平是CSFA 的独立危险因素(P <0.05,表3)。
3 讨论
CSF 现象是指正常或接近正常的冠状动脉在冠状动脉造影中出现血流灌注延迟的现象,属于无冠状动脉阻塞及心肌疾病的心肌微循环障碍[3-4]。既往研究表明,CSF 现象与内皮功能损伤、血管收缩、微血管障碍、广泛冠状动脉粥样病变及血小板活性增加等多种因素相关。目前,发现代谢综合征、高TC、LDL-C、胰岛素抵抗及糖耐量受损均成为CSF 患者可能的危险因素[5]。
CSFA 与多种危险因素相关。Rudd 等[6]对780例行冠状动脉造影的患者发现,CSFA 较易出现于非吸烟人群中。而Arbel 等[7]研究则提出吸烟是慢血流的唯一相关因素。本研究发现在CSFA 患者中吸烟患者比例确实高于对照组(P <0.05),与Arbel等研究结果一致。目前,吸烟与CSFA 相关性仍需临床大样本进一步证实。本研究还表明,男性、脂质代谢异常的发生率在CSFA 患者中显著升高,尿酸、ApoB100、TC/HDL、LDL/HDL、ApoA1/ApoB100 水平CSFA 组患者显著高于对照组,差异有统计学意义(P <0.05),这与Rudd 等[6]、Mehul 等[8]研究一致。吸烟、脂质代谢异常及男性高发均表明CSFA为系统性疾病,是全身广泛动脉粥样硬化的早期表现,其可能机制为吸烟及脂质对内皮的损伤所致,与动脉粥样硬化的病理生理机制相同[9],确切机制仍待进一步探索。
尿酸是嘌呤核苷酸的最终代谢产物。本研究主要提出尿酸水平可能为CSFA 的危险因素。这与Kalay 等[10]研究结论一致。Xia 等[11]研究也表明尿酸可成功预测CSF 现象的发生。既往研究表明,尿酸水平是心力衰竭生存率的预测因子,同时,高尿酸血症是缺血性心脏病、卒中及外周动脉病的危险因素[12]。目前,高尿酸血症常见于冠状动脉性疾病(coronary artery disease,CAD)患者,与CAD 患者不良心血管事件相关,是许多心血管疾病包括高血压病、血脂异常、肥胖的危险因素,因此尿酸水平可以称之为心血管独立危险因素[13-14]。尿酸可能通过以下途径参与CSFA 的发生,尿酸损伤动脉及毛细血管壁,导致氧化应激状态下内皮功能损伤、血小板黏附及聚集,促进炎症、动脉毛细血管壁重建[15-17]。目前,已经证实尿酸可促进斑块形成,大量沉积于粥样硬化斑块中[18]。
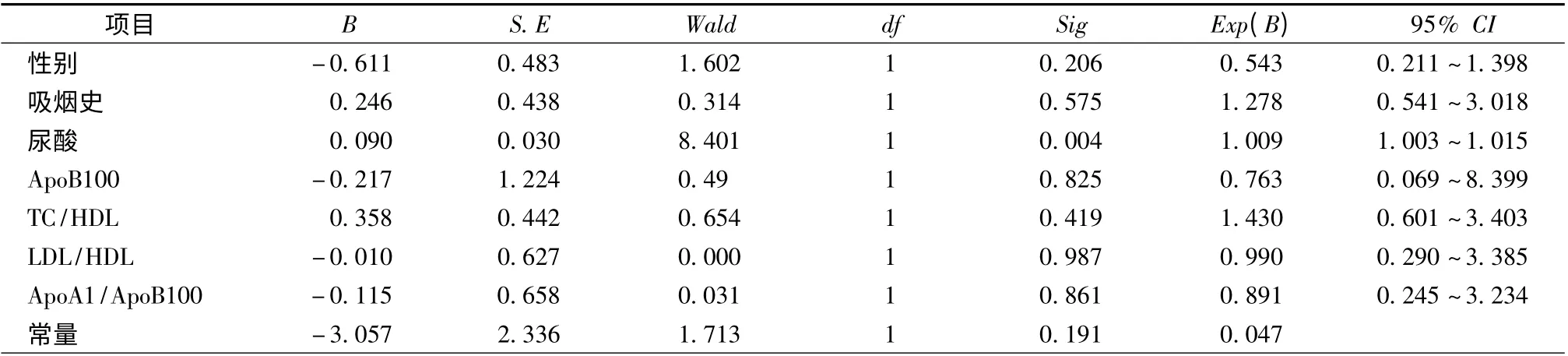
表3 CSFA 现象危险因素的非条件Logistic 回归分析
本研究发现尿酸可能为CSFA 患者的危险因素,提示尿酸升高可能参与CSFA 的病理生理过程。积极针对尿酸采取适当措施可能会降低心绞痛症状的发生。本研究为回顾性研究,样本量较少,CSFA的危险因素需进一步探讨。
[1] Kim HJ,Hong MK,Kim SH,et al. Evaluation of microvascular angina with TIMI frame count using nitroprusside induced hyperemia. Microvasc Res,2013,87:95-99.
[2] Gibson CM,Cannon CP,Daley WL,et al. TIMI frame count:a quantitative method of assessing coronary artery flow.Circulation,1996,93:879-888.
[3] Lanza GA,Crea F. Primary Coronary Microvascular Dysfunction:Clinical Presentation, Pathophysiology, and management.Circulation,2010,121 :2317-2325.
[4] Mosseri M,Yarom R,Gotsman MS,et al. Histologic evidence for small-vessel coronary artery disease in patients with angina pectoris and patent large coronary arteries. Circulation,1986,74:964-972.
[5] 吕慧,柴婵娟,杨志明. 冠状动脉慢血流型心绞痛的研究进展.中国介入心脏病学杂志,2014,22:654-656.
[6] Rudd N,Nadarajah N,Jackson A,et al. Prevalence and Clinical Characteristics of Patients with Coronary Slow Flow Phenomenon(CSFP)and No Significant Coronary Artery Disease. Heart,Lung and Circulation,2012,21(Supplement 1):S48.
[7] Arbel Y,Rind E,Halkin A,et al. Smoking is the main determinant of slow coronary flow in patients with normal coronary arteries. Atherosclerosis,2010,2(Supplement 11):219.
[8] Mehul R,Bhalja,Jose Diez. Clinical predictor of slow coronary flow in a cohort of patients undergoing cardiac catheterization for evaluation of chest pain. JACC,2012,59(Supplement):E531.
[9] Wang X,Geng LL,Nie SP. Coronary slow flow phenomenon:A local or systemic disease?Med Hypotheses,2010,75:334-337.
[10] Kalay N,Aytekin M,Kaya MG,et al. The relationship between inflammation and slow coronary flow: increased red cell distribution width and serum uric acid levels. Turk Kardiyol Dern Ars,2011,39:463-468.
[11] Xia S,Deng SB,Wang Y,et al. Clinical analysis of the risk factors of slow coronary flow. Heart Vessels,2011,26:480-486.
[12] Grassi D,Ferri L,Desideri G,et al. Chronic hyperuricemia,uric acid deposit and cardiovascular risk.Curr Pharm Des,2013,19:2432-2438
[13] Yu J,Han J,Mao J,et al. Association between serum uric acid level and the severity of coronary artery disease in patients with obstructive coronary artery disease.Chin Med J,2014,127:1039-1045.
[14] 王云飞,李小明,薛淞,等. 进口与国产药物洗脱支架治疗急性ST 段抬高心肌梗死的预后分析.中国介入心脏病学杂志,2014,22:35-39.
[15] Niskanen LK,Laaksonen DE,Nyyssonen K,et al. Uric acid level as a risk factor for cardiovascular and all-cause mortality in middle-aged men:a prospective cohort study. Arch Intern Med,2004,164:1546-1551.
[16] Strazzullo P,Puig JG. Uric acid and oxidative stress:relative impact on cardiovascular risk?Nutr Metab Cardiovasc Dis,2007,17,409-414.
[17] Kanellis J,Kang DH. Uric acid as a mediator of endothelial dysfunction, inflammation, and vascular disease. Semin Nephrol,2005,25:39-42.
[18] Suarna C,Dean RT,May J,et al. Human atherosclerotic plaque contains both oxidized lipids and relatively large amounts of alpha-tocopherol and ascorbate. Arterioscler Thromb Vasc Biol,1995,15:1616-1624.

