血流动力学参数对ST 段抬高心肌梗死患者溶栓后早期经皮冠状动脉介入治疗术后心肌灌注水平的预测价值
汪雁博 谷新顺 范卫泽 郝国贞 姜云发 傅向华
对ST 段抬高心肌梗死(ST-segment elevation myocardial infarction,STEMI)患者实施早期再灌注治疗,尽早、充分、持久开通梗死相关动脉(infarction related artery,IRA),是降低STEMI 患者死亡率、改善临床预后的关键[1]。越来越多的循证医学证据表明,溶栓后早期经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)不仅可以提高再灌注治疗的成功率,也可防止IRA 再次闭塞导致的再发心肌梗死,进而改善临床治疗效果[2]。《中国经皮冠状动脉介入治疗指南2012(简本)》建议在溶栓成功后24 h 内实施早期PCI[3]。然而,尽管再灌注治疗方案不断改进,仍有15% ~20%患者在心外膜IRA 机械性梗阻完全解除后,心肌未达到完全灌注水平,导致患者预后不良[4]。
研究发现,年龄[5]、糖尿病[6]、发病至再灌注治疗时间[7]、侧支循环水平[8]、梗死前心绞痛[9]、再灌注后ST 段重新抬高[10]等因素可能与STEMI 患者PCI 术后心肌灌注不良有关。由于冠状动脉灌注主要发生在心动周期的舒张期,因此,舒张压(diastolic blood pressure,DBP)对冠状动脉血流至关重要,在冠心病、冠状动脉自动调节功能受损患者中尤为突出[11]。有研究显示,对于冠状动脉严重狭窄患者,DBP 下降导致致死性和非致死性心肌梗死发生率增加[12],这就是所谓的“J”形曲线关系。后续试验表明,DBP 的自动调节与溶栓药物的治疗效果有关[13]。近期研究也发现,溶栓后DBP 水平过低与溶栓后早期PCI 患者长期预后不良有关[14]。本研究旨在探讨PCI 术前血流动力学状态与溶栓后早期PCI 术后心肌灌注水平的关系。
1 对象与方法
1.1 研究对象
回顾收集2010 年1 月至2013 年6 月于河北医科大学第二医院接受溶栓后早期PCI 的STEMI 患者病例资料。
入选标准:(1)持续胸痛超过30 min;(2)两个或两个以上相邻心电图胸前导联ST 段抬高超过0.2 mV,或肢体导联ST 段抬高超过0.1 mV;(3)症状发作6 h 以内曾接受过静脉溶栓治疗;(4)年龄<75岁;(5)溶栓后24 h 内进行早期PCI;(6)临床病例资料、冠状动脉造影(CAG)和PCI 相关参数完整。
排除标准:(1)阿司匹林、氯吡格雷、肝素或溶栓药物使用禁忌。(2)既往有心肌梗死病史或冠状动脉旁路移植术。(3)肾功能不全[定义为血肌酸酐水平超过2.5 mg/dl(221 mmol/L)]。(4)中性粒细胞减少症、血小板减少症或肝功能不全病史。(5)已知冠状动脉多支病变不适合行PCI 术。(6)心原性休克或心肌梗死后继发性心脏破裂、心肌穿孔、腱索断裂和严重瓣膜病。(7)需植入临时起搏器或应用主动脉球囊反搏(IABP)。
1.2 分组方法
根据患者PCI 术后TIMI 心肌灌注分级(TIMI myocardial perfusion grading,TMPG)评价标准,将患者分为心肌灌注不良组(TMPG≤2 级)和心肌灌注正常组(TMPG=3 级)。
1.3 CAG 及PCI 的主要参数
血管穿刺成功后,应用心导管实验室设备记录患者主动脉收缩压(SBP)、主动脉DBP 和心率(HR)。将患者血流动力学和操作数据输入数据库备用。根据患者CAG 结果,对IRA 血流未达到TIMI 血流分级Ⅲ级或IRA 血流达到TIMI 血流分级Ⅲ级但狭窄>75%的患者行PCI。CAG 和PCI 相关数据输入和整理由专人进行,主要参数包括:IRA 分布、PCI 术前、术后IRA 的TIMI 血流分级、基线血栓积分、术后IRA校正的TIMI 帧数(CTFC)、术后TMPG。
1.4 PCI 术后实验室检查
监测患者心肌损伤标志物变化,以肌酸激酶同工酶(CK-MB)峰值作为心肌梗死面积的估测指标。同时监测患者住院期间肝肾功能、血红蛋白浓度的变化。采用西门子SEQUDIA 心脏超声诊断仪,探头频率为3 ~5 MHz,对所有入选患者在PCI 术后7 d记录左心室射血分数(left ventricular ejection fraction,LVEF)。
1.5 Logistic 回归分析
对两组患者存在差异的基线资料、造影检查参数以及血流动力学参数进行单因素Logistic 回归分析,筛选确定自变量。以TMPG 为因变量,以PCI 术前血流动力学参数为自变量,进行多因素Logistic 回归分析。因变量(TMPG≤2 级记为1,TMPG =3 级记为2)。各自变量的相对危险度以OR 表示,记录95% CI 及P 值。
1.6 溶栓早期PCI 术后心肌灌注水平的预测模型建立
以多因素分析结果得出的独立预测因子构建预测TMPG≤2 级发生风险的Logistic 回归方程。将预测因子代入回归方程,血流动力学参数=1 + exp[-(-4.091 +0.085 ×DBP +0.016 ×SBP-0.037×HR)],计算每例STEMI 患者溶栓早期PCI 术后TMPG≤2 级的发生率。
1.7 受试者工作曲线(ROC)分析
以Logistic 回归方程计算出的每例STEMI 患者溶栓早期PCI 术后TMPG≤2 级的发生率,构建以TMPG 确定的心肌灌注水平为金标准的ROC 曲线,分析ROC 曲线下面积(AUC)及最佳截点值诊断STEMI 患者溶栓早期PCI 术后TMPG≤2 级发生的特异性及敏感性。ROC 曲线最佳截点值定义为ROC 曲线上距参考线最远点所对应的诊断指标数值(Youden 指数)。
1.8 统计学分析
所有数据采用SPSS 19.0 软件进行处理。连续变量采用 珋x ±s 表示,正态分布数据采用非配对t 检验;计数资料采用绝对数值和百分数表示,应用χ2检验进行统计学分析或Fisher 精确概率检验进行校正;等级资料采用趋势卡方检验或秩和检验进行组间比较。以双侧P <0.05 为差异有统计学意义。
2 结果
2.1 两组患者基线资料比较情况
累计入选患者159 例,其中男118 例(74.2%);灌注不良组31 例(19.5%),灌注正常组128 例(80.5%)。灌注不良组患者PCI 术前SBP 和DBP 均低于灌注正常组(均P <0.001)。与灌注正常组患者相比,灌注不良组患者PCI 术前HR 有增加趋势[(74.5±14.1)次/min 比(70.1 ±13.9)次/min,P =0.098];PCI 术后7 d 灌注正常组患者心功能较灌注不良组好[LVEF(52.4 ±4.2)%比(55.1 ±5.0)%,P=0.005],梗死面积有减少趋势[CK-MB 峰值(254.5±64.5)U/L 比(231.3 ±58.6)U/L,P =0.054]。两组患者的其他基线资料比较,差异无统计学意义(均P >0.05,表1)。
2.2 两组患者CAG 和PCI 比较情况
两组患者PCI 术前心功能Killip 分级、IRA 分布、基线TIMI 血流分级以及血栓积分水平比较,差异均无统计学意义(均P >0.05)。PCI 术后灌注正常组TIMI 血流Ⅲ级比例高于灌注不良组(P =0.039),CTFC 水平低于灌注不良组[(24.6 ±1.4)帧比(28.0 ±3.6)帧,P <0.001]。与灌注正常组患者相比,灌注不良组患者应用替罗非班和血栓抽吸的比例较高,差异有统计学意义(均P <0.05)。两组患者参考血管直径、靶血管长度、人均置入支架数以及支架释放压力比较,差异均无统计学意义(均P>0.05,表2)。
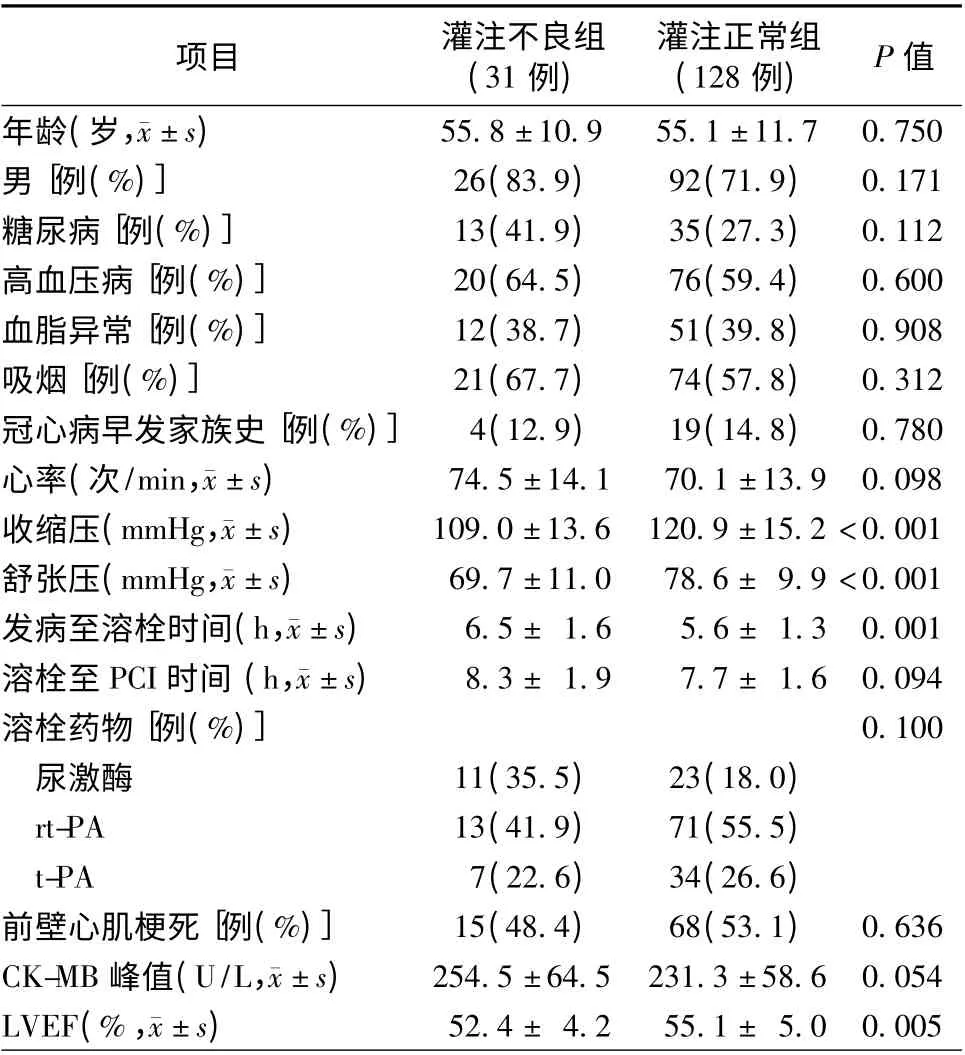
表1 两组患者基线资料比较
2.3 Logistic 回归情况
将患者基线资料、造影检查参数及血流动力学参数进行Logistic 回归分析。单因素分析结果显示,PCI 术前TIMI 血流分级较低(OR 1.807,95% CI 1.135 ~2.877,P =0.013)、SBP(OR 6.088,95% CI 1.103 ~33.607,P =0.038)和DBP(OR 7.711,95%CI 1.976 ~30.097,P=0.003)水平较低是PCI 术后心肌灌注不良的预测因素(表3)。多因素Logistic回归分析发现,PCI 术前DBP 过低(OR 1.089,95%CI 1.009 ~1.175,P =0.028)是PCI 术后心肌灌注不良的独立预测因素(表4)。
2.4 溶栓早期PCI 术后心肌灌注水平的预测模型建立
对数值进行量化,因变量TMPG 3 级:是=2,否=1;对自变量SBP、DBP 和HR 重新赋值(以最佳截点为界值,≥截点值记为2,<截点值记为1)。建立溶栓早期PCI 术后心肌灌注水平预报概率模型,血流动力学参数= 1 + exp[- (-4.091 +0.085 ×DBP+0.016 ×SBP-0.037 ×HR)],求出各个样本TMPG 的综合预报概率,以此作为绘制ROC 曲线的检验变量。ROC 曲线下面积为0.775 (95% CI
0.683 ~0.868,P <0.001)。
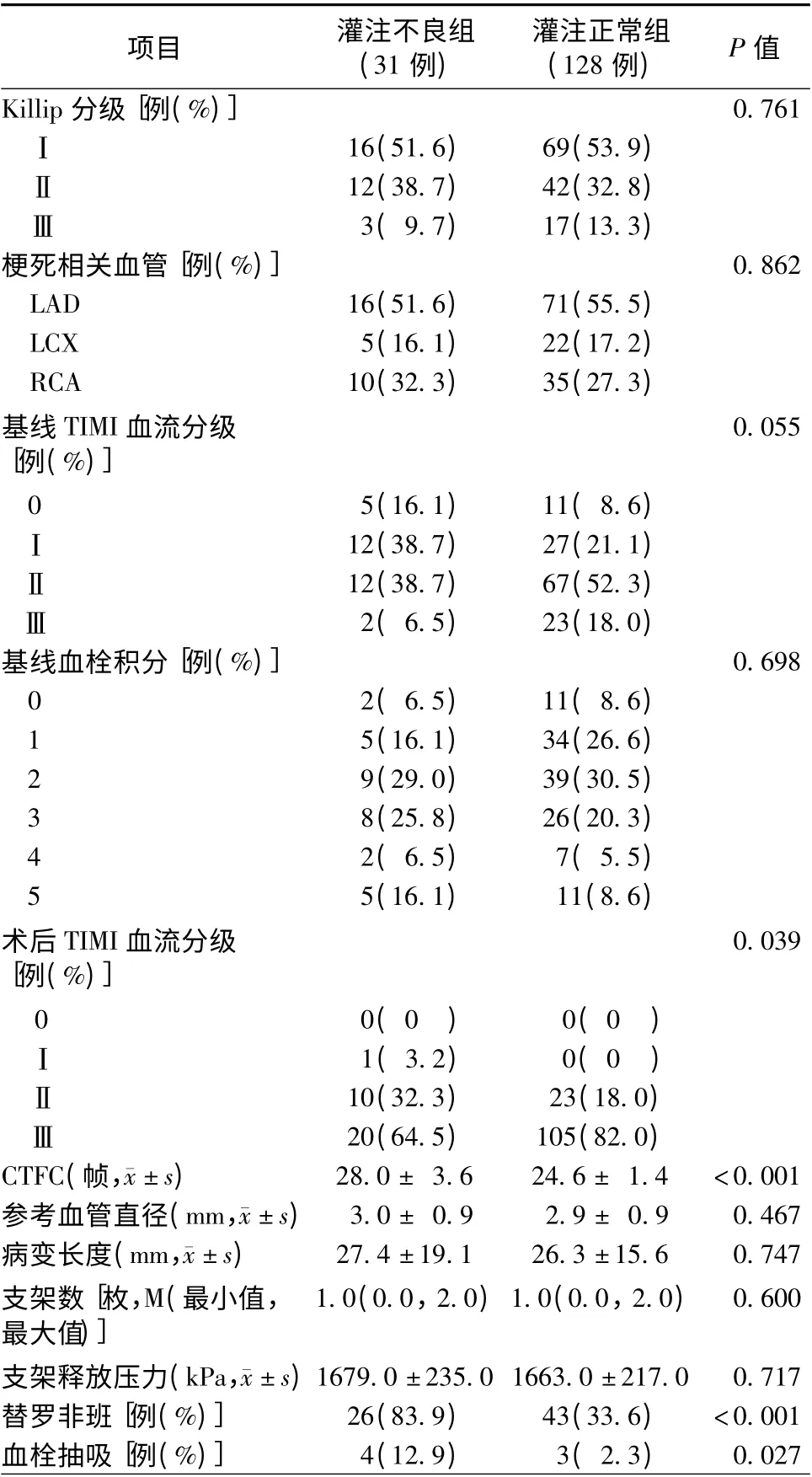
表2 两组患者介入操作相关参数情况
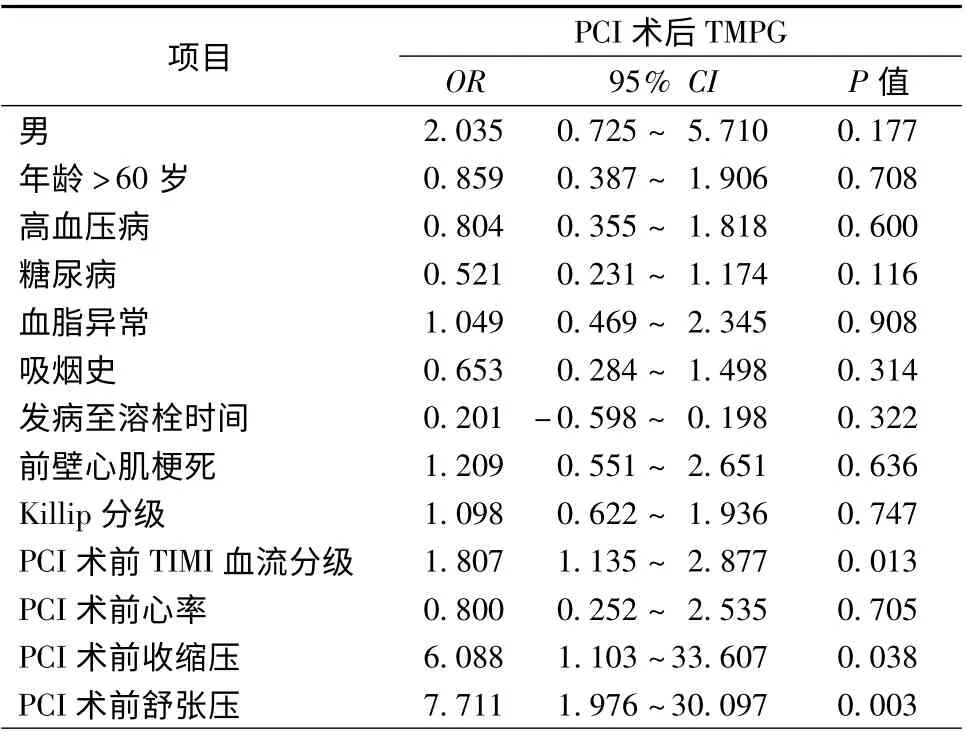
表3 单因素Logistic 回归分析结果
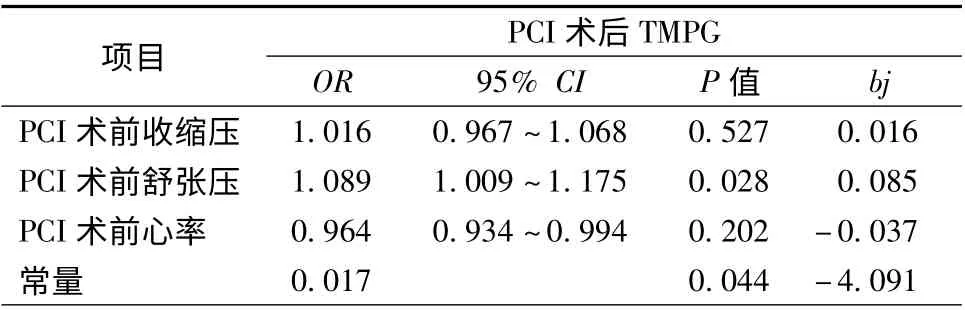
表4 多因素Logistic 回归分析结果
2.5 最佳截点值诊断急性心肌梗死(AMI)的试验评价
当Youden 指数(敏感性+特异性-1)最接近于1 时,为最佳截点(医学决定水平)。综合预报概率的敏感性和特异性见图1。取最佳截点值为0.789 时,诊断敏感性和特异性分别为78.1% 和71.0%。Youden 指数为0.491(图1)。

图1 经皮冠状动脉介入治疗术前血流动力学参数对术后心肌灌注水平的预测价值
3 讨论
急诊直接PCI 是恢复STEMI 患者心肌组织血流灌注的首选治疗方法。但仍有部分患者直接PCI术后心外膜血管血流未能达到TIMI 血流分级Ⅲ级,即使达到TIMI 血流分级Ⅲ级,仍有部分患者未实现完全心肌组织灌注。对于PCI 术后冠状动脉血流达到TIMI 血流分级Ⅲ级,心肌灌注不良(TMPG 0 ~1级)的患者住院病死率高达6.2%,显著高于心肌灌注良好(TMPG 2 ~3 级)的患者(2%)[15]。对于无法在发病早期行直接PCI 的STEMI 患者,国内外指南均推荐确诊后立即进行静脉溶栓治疗,继而在溶栓后24 h 内完成早期PCI,以期防止IRA 再次闭塞导致再发心肌梗死[3]。本研究发现,与直接PCI 相比,溶栓后经桡动脉早期PCI 可获得更佳的心肌灌注,且并未增加出血风险和主要不良心血管事件(MACE)发生率。尽管再灌注治疗方案已改进,但仍有20%患者在IRA 机械性梗阻解除后未获得完全心肌灌注。
国内外对心肌灌注不良的影响因素研究结果不一。Iwakura 等[16]针对199 例前壁AMI 患者的研究发现,心肌损伤程度、室壁运动积分、干预前IRA 血流分级以及无梗死前心绞痛是无复流和慢血流现象的独立预测因素。Takahashi 等[17]则认为无梗死前心绞痛是发生无复流和慢血流现象唯一的预测因素。杨新春等[18]研究表明,症状开始到再灌注的时间、梗死前心绞痛、Killip 心功能分级、Q 波计数是直接PCI 术中无复流和慢血流的相关因素。本研究以TMPG 为标准进行分组,TMPG≤2 级为心肌组织灌注不良组,达TMPG 3 级者为心肌灌注正常组,观察与溶栓早期PCI 术后心肌水平灌注不良的相关因素,结果发现,PCI 术前DBP 和HR 等因素对PCI 术后心肌灌注水平具有显著影响。
由于冠状动脉血流灌注主要依靠舒张期,因此,DBP 对冠状动脉灌注具有重要作用。正常情况下冠状动脉血流能够进行自动调节,在一定范围内冠状动脉灌注压的变化(约为DBP)并不影响心肌血流灌注。冠状动脉血流由小动脉和中动脉的口径变化自动调节,灌注压升高时血管收缩,灌注压降低时血管舒张[11]。低DBP 导致冠状动脉事件的可能机制是:冠状动脉自动调节储备或冠状动脉血流储备不仅受到粥样硬化狭窄的影响,也受到左心室舒张末期压力和HR 等因素的影响。冠状动脉狭窄时冠状动脉血流储备显著下降,冠状动脉灌注压轻度降低,可引起冠状动脉血流减少,导致心肌缺血[19]。早在1991 年,Framingham 研究发现DBP 和心肌梗死患者心血管死亡率间存在“J”形曲线[20]。但在非心肌梗死患者中并未发现类似的“J”形曲线。Lindblad 等[12]同样发现,合并高血压的冠心病患者SBP <95 mmHg(1 mmHg =0.133 kPa)将导致心肌梗死发生率增加。MRFIT 研究也支持在先前患有心肌梗死的男性患者中,DBP 与全因死亡存在“J”形曲线[21]。本研究发现,PCI 术前DBP 较低是PCI术后心肌灌注不良相关的主要危险因素。
为进行PCI 术前充分的准备,通常要给予患者包括降压药在内的药物充分治疗。但尚未有研究证实强化降压在此情况下的必要性。考虑到多数患者在溶栓后冠状动脉仍存在严重残余狭窄,本研究假设过度降低DBP 将导致冠状动脉灌注不足,影响心肌灌注的恢复,导致远期不良事件发生率增加。以往研究多是针对单一血流动力学参数与心肌灌注的关系进行观察,本研究采用多因素Logistic 回归建立血流动力学参数综合预测模型,并应用ROC 曲线对其预测价值进行评价,进而分析综合血流动力学参数对心肌灌注的影响。结果发现,过度降低DBP 可能与PCI 术后心肌灌注不良密切相关。除DBP 外,HR 快也是不良心血管事件的独立相关因素之一。HR 增快将导致心脏舒张期缩短,进一步减少了冠状动脉血流灌注。因此,DBP 降低和HR 增快均将导致心肌灌注减少,进而导致不良心血管事件的发生。本研究采用预测模型对PCI 术前血流动力学参数与PCI 术后心肌灌注的关系进行研究,并采用ROC 曲线进行分析,结果发现以0.789 为截点值,对心肌灌注不良预测的敏感性和特异性分别为78.1%和71.0%。这一截点值与文献中报道的“J”点为80 ~95 mmHg 十分接近[21]。尽管还需大规模前瞻性临床试验加以证实,但是本研究结果在一定程度上提示了药物-介入联合治疗时代“J”点存在及意义。
本研究存在的局限性:本研究为回顾性研究,样本量较小,未对较好反映心肌灌注的参数如MBG 进行分析。此外,患者在应激状态下,其参数并未完全准确反映患者的血流动力学状态。只有进行随机对照研究才能较好地解释这一现象。
[1] Pfeffer MA, Braunwald E. Ventricular remodeling after myocardial infarction. Experimental observations and clinical implications. Circulation,1990,81:1161-1172.
[2] Bhmer E,Hoffmann P,Abdelnoor M,et al. Efficacy and Safety of Immediate Angioplasty Versus Ischemia-Guided Management After Thrombolysis in Acute Myocardial Infarction in Areas With Very Long Transfer Distances:Results of the NORDISTEMI(NORwegian study on District treatment of ST-Elevation Myocardial Infarction). J Am Coll Cardiol,2010,55:102-110.
[3] 中华医学会心血管病学分会介入心脏病学组,中华心血管病杂志编辑委员会. 中国经皮冠状动脉介入治疗指南2012(简本).中华心血管病杂志,2012,40:271-277
[4] Gibson CM,Cannon CP,Murphy SA,et al. Relationship of TIMI Myocardial Perfusion Grade to Mortality After Administration of Thrombolytic Drugs.Circulation,2000,101:125-130.
[5] Lee KL,Woodlief LH,Topol EJ,et al. Predictors of 30-day mortality in the era of reperfusion for acute myocardial infarction.Results from an international trial of 41,021 patients. GUSTO-ⅠInvestigators. Circulation,1995,91:1659-1668.
[6] Norhammar A,Malmberg K,Diderholm E,et al. Diabetes mellitus:the major risk factor in unstable coronary artery disease even after consideration of the extent of coronary artery disease and benefits of revascularization. J Am Coll Cardiol,2004,43:585-591.
[7] Christian TF,Schwartz RS,Gibbons RJ. Determinants of infarct size in reperfusion therapy for acute myocardial infarction.Circulation,1992,86:81-90
[8] Pérez-Castellano N,García EJ,Abeytua M,et al. Influence of collateral circulation on in-hospital death from anterior acute myocardial infarction. J Am Coll Cardiol,1998,31:512-518.
[9] Kloner RA,Shook T,Przyklenk K,et al. Previous angina alters in-hospital outcome in TIMI 4. Circulation,1995,91:37-45.
[10] Kondo M,Tamura K,Tanio H,et al. Is ST segment reelevation associated with reperfusion an indicator of marked myocardial damage after thrombolysis?J Am Coll Cardiol,1993,21:62-67.
[11] Cruickshank JM. The role of coronary perfusion pressure. Eur Heart J,1992,13 (Suppl D):39-43.
[12] Lindblad U,Rstam L,Rydén L,et al. Control of blood pressure and risk of first acute myocardial infarction: Skaraborg hypertension project. BMJ,1994,308:681-686.
[13] Prewitt RM,Gu S, Schick U, et al. Intraaortic balloon counterpulsation enhances coronary thrombolysis induced by intravenous administration of a thrombolytic agent. J Am Coll Cardiol,1994,23:794-798.
[14] Sabol MB,Luippold RS,Hebert J,et al. Association Between Serial Measures of Systemic Blood Pressure and Early Coronary Arterial Perfusion Status Following Intravenous Thrombolytic Therapy. J Thromb Thrombolysis,1994,1:79-84.
[15] 金善祎,周长勇,李佳璐.急性心肌梗死介入治疗中心肌灌注水平的评价技术.中国介入心脏病学杂志,2014,22:459-461.
[16] Iwakura K,Ito H,Kawano S,et al. Predictive factors for development of the no-reflow phenomenon in patients with reperfused anterior wall acute myocardial infarction. JACC,2001,38:472-477.
[17] Takahashi T,Anzai T, Yoshikawa T, et al. Absence of preinfarction angina is associated with a risk of no-reflow phenomenon after primary coronary angioplasty for a first anterior wall acute myocardial infarction. Int J Cardiol,2000,75:253-260.
[18] 杨新春,郭军,王乐丰,等. 急诊经皮冠状动脉介入治疗冠状动脉造影无复流的相关因素.中国介入心脏病学杂志,2004,12:83-86.
[19] 林曙光,冯颖青. 降压治疗中J 型曲线引起的困惑. 岭南心血管病杂志,2010,16:1-4.
[20] D'Agostino RB,Belanger AJ,Kannel WB,et al. Relation of low diastolic blood pressure to coronary heart disease death in presence of myocardial infarction:the Framingham Study. BMJ,1991,303:385-389.
[21] Flack JM,Neaton J,Grimm R Jr,et al. Blood pressure and mortality among men with prior myocardial infarction. Multiple Risk Factor Intervention Trial Research Group. Circulation,1995,92:2437-2445.

