全球重要领域的新药研发与进展
田月,赵志刚
首都医科大学附属北京天坛医院 药剂科,北京 100050
2014年美国食品药品管理局(Food and Drug Adm inistration, FDA)共批准了41个新药(不包括疫苗、血液制品等产品)[1]。FDA 2014年批准的新药远高于2013年的27个和2012年的39个,成为自1996年以来批准新药最多的一年。其中,肿瘤治疗领域有9个药物,是获批药物最多的领域,此外还包括4个糖尿病治疗药物和4个新型抗菌药物。
此外,2014年处于研发状态的药物数量较以往更多,其中很大一部分是已上市但增加适应证的药物,越来越多的企业正通过对已上市产品的后续研发来挖掘其最大的价值。从药物治疗活性谱来看,在癌症类疾病中,肝癌类在研药物显示出了特别的增长态势,其在研药物数量增幅为15.9%;丙肝类在研药物在经历多年的持续增长后出现下滑,因为新一代抗丙肝病毒药物开始进入市场;皮肤病治疗药物出现了明显的增长,主要与银屑病有关;而糖尿病研发领域则仍然处于火热状态。本文即主要介绍抗丙肝、降血脂、糖尿病、银屑病、血友病、黑色素瘤以及肥胖症等7个主要领域的新药上市和药物研发进展情况,为后续药物的研发提供参考借鉴。
1 抗丙肝药物
丙肝是由丙型肝炎病毒(HCV)感染引起的病毒性肝炎。目前,全球约有1.8~2亿人感染HCV,并且每年新增300万~400万患者,每年因丙肝死亡的人数约5万人。我国超过4000万人携带丙肝病毒[2]。
丙肝病毒一般通过血液、性接触和母婴三种途径传播,其中血液传播是最主要的途径。丙肝病毒的潜伏期为2周到6个月,感染丙肝病毒后,约20%的人可以自行清除病毒,而约70%的患者则可能发展为慢性丙肝。经过治疗,大部分的HCV患者能够被治愈。但是如果不治疗,则有10%~15%的患者在感染后20年左右发展为肝硬化。
丙型肝炎治疗药物是一个非常有市场前景的领域,目前各大制药公司和生物技术公司纷纷进入此领域,并不断加大投资力度。总体而言,丙肝病毒的主要作用靶点有NS3、NS5A和NS5B,每个靶点都有很多药物和在研产品。治疗丙肝的主要药物如表1。
在2011年之前,派罗欣联合利巴韦林是最有效的丙肝治疗方案,用药48周。但是这种治疗方法的副作用非常大,而有效率却很低,只有30%~40%。
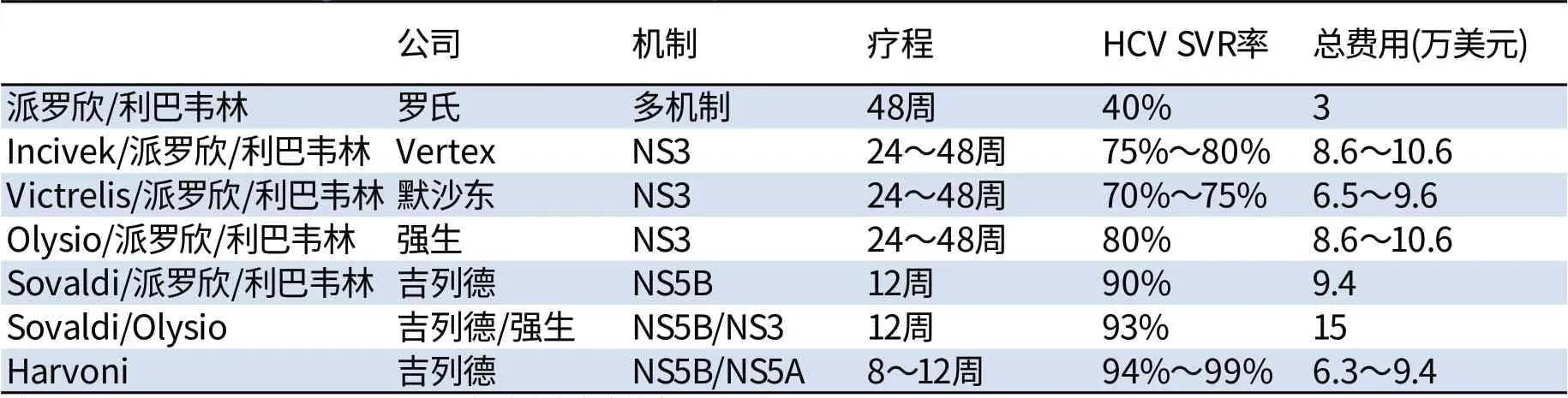
表1 丙肝领域的主要药物Tab1 The m ain d rugs used in the field o f hepatitis C
2011年以后,丙肝药物的研发和上市进程不断加速。2011年5月,丝氨酸蛋白酶抑制剂博赛匹韦(Victrelis)和特拉匹韦(Incivek)上市,这两种药物虽然也需要和派罗欣及利巴韦林联用,但是可以把SVR提高到80%,疗程也可以缩短到24周。其中,特拉匹韦(In civek)是首创药物,其上市后9个月销售额即超过10亿美元,是史上销售最快的新药。但是,随着吉利德科学、艾伯维等公司的全口服药物的上市,特拉匹韦的销售额从2012年起迅速下滑,最终在2013年底1.52亿美元卖给了杨森。
2013年11月,强生公司的蛋白酶抑制剂Olysio联合派罗欣和利巴韦林的治疗方案获得了FDA批准。Olysio和吉利德的Sovald i联用是首个全口服的治疗方案,有着较高的治愈率和较低的副作用。Olysio和Sovald i在2014年第一季度分别创下了将近20亿美元和超过80亿美元的销售额。
2013年12月6日,吉利德科学的首款全口服丙肝药物Sovald i上市,该药物与利巴韦林联用对基因2型的丙肝患者具有很好的疗效,其HCV SVR率达到 90%[3]。但是Sovald i还要和利巴韦林联合使用,而且对占大多数的基因1型的患者还需要同时注射派罗欣。
2014年10月10日,吉利德的真正全口服药物Harvoni上市。Harvoni是sofosbuvir和蛋白酶NS5A抑制剂led ipasvir的复方组合。它是第一个批准用于治疗基因1型丙肝感染且不需要联合用药的全口服抗丙肝方案,可以单药使用,也可以和其它口服制剂联合使用。Harvoni不含干扰素或利巴韦林,耐受性有了极大的提高,且副作用较少,常见不良反应为疲劳、头痛等轻微症状[4]。
Harvoni不仅是第一个真正意义上的全口服丙肝治疗方案,而且疗程也大幅缩短。临床研究显示,HCV-1患者接受Harvon i治疗8周或12周,治愈率可达99%。在用药费用上,采用Harvoni方案用药12周的费用为9.45万美元,和Sovald i方案接近,但若采用8周Harvoni的治疗方案只需要6.3万美元,费用只是原来的2/3。
除此之外,其它多个在研药物也很出色。其中,艾伯维的全口服抗丙肝三联复方(Ombitasvir/ritonavir/dasabuvir)的治愈率就比Harvoni更高。默克、施贵宝和杨森的一些早期结果也同样很出色,这些全口服治疗方案的SVR应答率基本都在95%以上。
2 调血脂药
在调血脂药物中,辉瑞的立普妥上市15年总销售额突破1000亿美元,是全球药品销售的神话。但是自2011年底其专利到期,市场份额迅速被仿制药瓜分。
如今,各大制药巨头正加紧推进与立普妥不同作用机制的非他汀类药物的研发,寻找降低低密度脂蛋白胆固醇(LDL-C)的新靶点和新疗法。在众多新疗法中,前蛋白转化酶枯草杆菌蛋白酶Kexin 9型(PCSK9)抑制剂是最主要的方向。
PCSK9为分泌型丝氨酸蛋白酶,可与低密度脂蛋白胆固醇受体结合并将其内化引导至溶酶体降解,从而减弱肝脏代谢血浆LDL-C的能力,而LDL-C可阻塞血管,是心脏病的罪魁祸首。PCSK9抑制剂提供了一种新的途径来解决LDL-C问题,被视为自他汀类药物之后在心脏疾病药物领域取得的最大进步[5]。
PCSK9抑制剂的潜在市场高达100亿美元。目前,从PCSK9抑制剂研发进程来看,安进和赛诺菲/Regeneron领先于辉瑞、礼来、诺华等其他公司。安进已于2014年8月28日向FDA提交了PCSK9抑制剂evo locum ab的生物制品许可申请,这是全球首个PCSK9抑制剂许可申请。Evo locum ab在他汀不耐受群体、杂合子家族性高胆固醇血症群体和纯合子家族性高胆固醇血症群体具有的良好的疗效。
赛诺菲和Regeneron在2014年7月底宣布其研发的a lirocum ab的III期研究均达到主要疗效终点,同时花了6750万美元从BioMarin公司购买了一张FDA的加速审评券,将alirocum ab的时间从10个月缩短至6个月,最终alirocum ab可能与安进的evolocum ab同时上市。
3 糖尿病药物
据国际糖尿病联盟统计,2013年全球糖尿病在20~79岁成人中的患病率为8.3%,患者总数已达3.82亿,预计到2035年全球将有接近5.92亿人患糖尿病。在糖尿病中,2型糖尿病占了90%~95%。全球2型糖尿病用药市场将以每年10.2%的速度增长,预计至2019年,市场总额将达到388亿美元。目前,2型糖尿病热门程度可以和肿瘤相提并论。
治疗糖尿病常用的口服药主要有磺脲类、双胍类、拜糖平类、格列奈类、胰岛素增敏剂和近几年新上市的胰高血糖素样肽-1(GLP-1)激动剂、二肽基肽酶-4 (DPP-4)抑制剂以及钠-葡萄糖协同转运蛋白2(SGLT-2)抑制剂等,其中前两类降糖药是最传统的药物,二甲双胍是国际一线口服降糖药[6]。而近年来最热的糖尿病治疗新药则是GLP-1激动剂、DPP-4抑制剂和SGLT-2抑制剂[7]。
2005年,礼来的首个GLP-1受体激动剂艾塞那肽上市,此类药物通过激动GLP-1受体增强胰岛素分泌、抑制胰高血糖素分泌并能延缓胃排空,并通过中枢性抑制食欲而减少进食量。2009年,诺和诺德的利拉鲁肽获欧盟批准,2010年获FDA批准,2011年进入中国,2013年利拉鲁肽全球销量116.33亿丹麦克朗。
GLP-1激动剂较早进入中国,不过市场前景不佳。礼来的艾塞那肽“百泌达”于2009年就已进入中国。不过,“百泌达”需要每日注射给药两次,因此很不方便,加之其单独使用降糖效果不强,这使得产品上市后并未得到市场认同。
由于人体自身产生的GLP-1 极易被体内的二肽基肽酶-4降解,因此各大公司研发了DPP-4抑制剂保护GLP-1不被降解。DPP-4抑制剂不良反应少且普遍轻微,但降糖作用不强,一般需要联合治疗。在中国市场获准销售的DPP-4抑制剂主要包括西格列汀、沙格列汀、维格列汀、利格列汀和阿格列汀。
默沙东在DPP-4抑制剂领域为领先者,其产品西格列汀“捷诺维”是全球最畅销的口服糖尿病用药。捷诺维于2006年由默沙东公司成功开发并在美国上市,2010年进入中国市场,近年来已成为上市后销售额增长最快的新药之一,也是历史上年销售额突破10亿美元最快的新药, 2013年全球销售40.04亿美元。西格列汀可以单药治疗或配合饮食控制和运动,用于改善2型糖尿病患者的血糖控制。
诺华的佳维乐(维格列汀片)在2007年获得了欧盟的批准。佳维乐可以与最常用的口服降糖药二甲双胍、噻唑烷二酮或磺脲联合使用。但是佳维乐一直未获得FDA的批准,因为FDA不确定该药对肾损伤患者的有效性和安全性。
百时美施贵宝开发的安立泽(沙格列汀片)在2010年3月获得FDA批准用于治疗成人2型糖尿病患者的高血糖症。沙格列汀可单用,也可与二甲双胍或一种磺酰脲类药物或一种噻唑烷二酮类药物联合使用。
2011年5月,勃林格殷格翰和礼来合作开发的欧唐宁(利格列汀片)获得FDA批准,用于2型糖尿病成年患者的治疗,该药是一种配合饮食控制和锻炼以降低血糖水平的处方药。利格列汀片是此类药物中首个被批准以单一剂量给药的药物。2013年,利格列汀片获得国家食品药品监督管理总局批准在中国上市。
SGLT-2抑制剂是近年来发现的治疗糖尿病的新靶点。SGLT-2是一种跨膜蛋白,主要分布在肾脏近曲小管,将葡萄糖从肾小管液转运入肾小管细胞内,约占肾脏重吸收葡萄糖的90%。SGLT-2抑制剂的药物机理通过选择性的阻断SGLT-2功能,抑制肾糖重吸收以促进尿糖排泄,使多余的葡萄糖通过尿排出,从而降低体内血糖,同时避免了体重增加和低血糖风险。
2013年美国审批通过第一个SGLT-2抑制剂降糖药物是由强生公司研发的卡格列净,卡格列净于2013年3月29日获FDA批准用于2型糖尿病成人患者的治疗,也是在美国获批的首个SGLT-2类型糖尿病药物。2014年1月美国FDA 审批通过百时美施贵宝/阿斯利康研发的达格列净上市,这是FDA审批通过的第二个SGLT-2抑制剂类降糖药物。除此以外,2014年欧洲药品监管机构批准阿斯利康旗下的Dapag liflozin/二甲双胍复合剂型用于2型糖尿病,这是欧洲首次批准由一种SGLT-2抑制剂和二甲双胍组成的固定剂量的复方药物。日本也审批通过了托格列净、艾格列净、鲁格列净三个SGLT-2抑制剂类降糖药物上市。
4 血友病药物
血友病是一种X染色体连锁的隐性遗传性出血性疾病,主要表现为自发性反复出血或外伤、手术后出血,最常见的出血部位为关节和肌肉,皮肤和黏膜部位出血也较多,严重者则为内脏出血或颅内出血,可以致残甚至威胁生命安全[8]。根据世界血友病联盟统计,全球约有40多万血友病患者,80%~85%为A型血友病患者,我国可能有10万患者,而且不同种族和经济群体患病率没有差异[9]。凝血因子是血友病治疗不可替代药物,通常患者需终身输注。
血友病虽然被视为罕见病,但患者群体相对庞大,用药存在刚性需求,导致市场竞争激烈。目前,A型血友病药物市场规模大约为60亿美元,B型血友病药物市场大约为10亿美元。 血友病药物市场竞争激烈,主要参与企业包括Bax te r、辉瑞、诺和诺德、拜耳和Biogen。
诺和诺德的A型血友病药物Novoeight(重组凝血因子VIII)在2013年10月16日获得FDA批准,用于成人和儿童A型血友病患者的预防和控制出血。拜耳也在2014年3月宣布投入7亿美元扩大血友病药物的产能。Baxte r的血友病药物占其生物制药业务收入的58%,其旗下的药物Advate2013年销售额达18亿美元,此外,其B型血友病新药Rixubis在2013年6月获批,但是其新型A型血友病药物预期还要1~2年才能上市。
Biogen在长效血友病药物的产品上则领先拜耳和诺和诺德。2014上半年,Biogen先后有两个长效血友病药物被FDA批准,其中重组凝血因子IXFc融合蛋白药物Alp ro lix在3月28日获得FDA批准,用于B型血友病患者的出血控制。Alp ro lix是FDA批准的首个长效B型血友病药物,可以一周甚至10天注射1次。Biogen的另一个药物Eloctate(重组Ⅷ因子Fc融合蛋白)则是FDA批准的首个长效A型血友病药物,于2014年6月6日获得FDA批准,用于预防A型血友病患者的出血控制,可以每3~5天注射1次。
5 银屑病药物
银屑病俗称牛皮癣,是一种常见的慢性皮肤病。在美国约有750万人患银屑病,我国也约有650万患者[10]。在银屑病患者中,约3%~10%的患者身体皮肤会出现红色的炎症病损。银屑病并不致命,但如果病症较重的话,会严重影响生活质量和身心健康,该病到目前为止还没有有效的治愈方法。
银屑病的发病机理目前认为是自身免疫系统失调引起,同时又和遗传因素、感染、药物等因素相关[11]。轻度银屑病采用局部外用药物治疗即可,比如皮质类固醇激素、维生素D类等药物。重度患者则需系统治疗,生物制剂例如肿瘤坏死因子抑制剂目前是最有效的药物,已经上市生物制剂包括阿法赛特、依法珠(已退市)、依那西普、英夫利昔单抗、阿达木单抗和乌斯奴单抗等[12]。
目前,依那西普在中度至重度斑块状银屑病治疗中处于主导地位,占有32%的市场份额。依那西普之后,雅培的阿达木单抗也具备强大的竞争实力,2013年阿达木单抗已占据了大约30%的市场份额。
2014年,诺华的IL-17A抑制物secukinum ab在三期临床结果中显示,secukinum ab治疗组有过半的患者其PASI(银屑病面积和严重程度指数评分标准)下降90%,明显高于依那西普对照组的20.7%。该药于2014年12月在日本获批用于银屑病,同时2015年1月也被欧洲药品管理局(European Medicines Agency, EMA)和FDA批准用于治疗中、重度斑块型银屑病。
2014年,礼来的抗白介素17A单抗Ixekizum ab的临床试验数据显示在主要指标上均明显优于依那西普,礼来计划在2015年上半年向美国F D A提交上市申请。安进公司和阿斯利康合作开发的b rodalum ab也于2014年10月发布了III期临床试验成功的结果。这两个单抗的审批意见预计在2015年上半年有结果。除此之外,默克的MK-3222、和强生的guselkum ab也都在进行晚期临床开发,并显示明显疗效。
在口服小分子药物领域,塞尔基因的磷酸二酯酶4抑制剂Ap rem ilast已经在2014年3月获得美国FDA批准,用于治疗银屑病关节炎,并且已经申报用于治疗银屑病。辉瑞的Janus激酶抑制剂托法替尼作为中度至重度的风湿性关节炎药物已经在全球20多个国家销售,辉瑞正在进行临床实验,考察托法替尼作为银屑病口服药物的疗效和安全性。
6 黑色素瘤药物
黑色素瘤是欧美白种人的一种常见肿瘤,在所有恶性肿瘤中它的发病率名列前茅。黑色素瘤起源于黑色素细胞的病变:正常情况下,黑色素细胞在皮肤下是均匀分布的,如果其过度分裂增殖就可能成为黑色素痣,而当这种分裂增殖失去控制时,就会演变成为黑色素瘤[13]。
黑色素瘤在中国发病率很低但增长迅速,每年新增患者约2万人左右,但在美国和欧洲等主要国家每年预计有几十万的新诊患者。在2011年之前,采用达卡巴嗪化疗是治疗恶性黑色素瘤的主要疗法。达卡巴嗪是一种DNA烷基化制剂,不仅副作用大,而且应答率只有10%左右,中位生存期仅为5~11个月,一年总生存率不到30%。
2011年,黑色素瘤的治疗获得突破性进展,两个新药伊匹单抗Yervoy和Zelbo raf上市。Yervoy由施贵宝开发的免疫靶向药物,是抗细胞毒性T淋巴细胞抗原4的单克隆抗体,作用机制是间接通过T细胞介导的抗肿瘤免疫反应,它是首个获得FDA批准的可延长转移性黑色素瘤患者生命的药物。虽然Yervoy和达卡巴嗪相比的应答率改善不大,但明显改善患者的总生存期,上市后三年就成为了重磅药物,2013年销售额达到5.77亿美元。
Zelbo raf是罗氏开发的小分子BRAF抑制剂,不仅应答率明显提高到57%,且和达卡巴嗪相比也能改善患者的生存期,但采用Ze lbo ra f半年之后通常产生耐药性。Ze lbo ra f是一个突破性药物,但是受到免药物Yervoy的挤压,2013年的销售额只有1.27亿美元,随着后面药物的上市,其前景逐渐暗淡。
在前面两种药物上市后,B R A F 抑制剂Tafin lar、MEK抑制剂Mekinist、以及这两个药的复发组合相继获得美国FDA批准上市,抗黑色素瘤研发领域进入快车道。由于Tafin lar、Mekinist、以及二者复方制剂都没有解决耐药性问题,因此这类药物的商业前景比较暗淡。
目前,黑色素瘤研究主要集中在免疫靶向治疗和分子靶向治疗两个领域[14]。其中,Ye rvoy可以阻断细胞毒性T淋巴细胞相关抗原,是免疫靶向治疗的代表药物。在分子靶向治疗方面,由于转移性黑色素瘤患者中,约有一半携带BRAF突变,该异常突变能促使黑色素瘤生长和扩散,因而BRAF抑制剂等药物通常会产生耐药性的情况,并且目前还没有可解决的方法。
总体而言,在黑色素瘤治疗领域,虽然在研的一些分子靶向药物临床表现不错,但是免疫靶向药物既不受变异基因的限制,而且应答要持久的多,预计会成为黑色素瘤市场的主要产品。如最近开发的程序性死亡受体-1(PD-1)抑制剂,即代表免疫靶向治疗的最新方向。PD-1抑制剂可阻断PD-1与程序性死亡配体结合,阻断免疫负性调节信号,从而增强T细胞的反应活性和提高INF-γ、IL-2、TNF-α等因子的表达,最终增强抗肿瘤的效能。2014年9月,施贵宝针对PD-1的药物n ivo lum ab率先在日本上市,而默沙东的pem b ro lizum ab随后即获得美国FDA批准上市,其另一个药物lam b ro lizum ab也已经获得FDA的突破性治疗认定。此外,程序性死亡配体抑制剂及CTLA-4和PD-1单抗的联合治疗方案也已经进入了试验。
7 减肥药物
据麦肯锡的调查显示,从全球范围来看,21亿以上人口处于超重或肥胖状态。此外,世界卫生组织公布的报告显示,全球超重和肥胖儿童呈持续增长趋势,预计到2025年可能达到7000万人,为2012年4400万人的1.6倍。
目前市场的减肥药主要包括胰脂肪酶抑制剂和作用于中枢神经系统的食欲抑制剂两大类[15],但是由于减肥药的安全性、不良反应问题,减肥药物市场表现欠佳[16,17]。
减肥药的主要问题在于其长期安全性。过去几十年内,有多种减肥药因安全隐患而退出市场。其中,惠氏公司的芬氟拉明和右芬氟拉明因被发现可增加心脏瓣膜病变风险已于1997年退市;雅培的西布曲明由于可能引发心血管疾病于2010年退市;Servier公司的苯氟雷司由于可能引发心脏瓣膜病于2009年退市;赛诺菲的利莫那班由于可能引发抑郁症或自杀于2008年退市。
目前有以下几个主要减肥药通过美国FDA审批上市。
1999年,基因泰克公司研发的减肥药Xen ica l (奥利司他)通过美国FDA审批上市。Xen ica l为脂肪酶抑制剂,属外周靶点减肥药,较中枢靶点减肥药更安全。此后,FDA一直未再审批通过减肥药的上市。
2012年FDA历经13年首次为减肥药打开绿色通道。2012年6月日本Eisai和美国Arena公司研发的减肥药Be lv iq(氯卡色林)通过美国FDA审批上市。Be lviq是5-羟色胺2C受体激动剂,属中枢靶点减肥药,能够激动位于下丘脑POMC 神经上的5-HT2c受体从而起到抑制食欲,增加能量消耗的效果。
此后,FDA陆续通过了多款减肥药的批准。2012年7月Vivus公司研发的减肥复方药物Qsym ia(苯丁胺/托吡酯复方缓释药物)通过美国FDA审批上市。2014年10月武田和 Orexigen研发的减肥复方药物Con trave(纳曲酮/丁氨苯丙酮复方制剂)通过美国FDA审批上市。
目前上市已上市的减肥药物由于安全性问题市场表现欠佳。如Qsym ia在2014年上半年销售额仅为两千万美元,Belviq 2014年上半年市场销售额仅为1800万美元。Con trave由于和武田合作,营销渠道较强,市场表现好于前面的减肥药。
在新药开发方面,2014年,诺和诺德2型糖尿病治疗药物Saxenda(利拉鲁肽)进军减肥药物市场,这对于两种疾病的治疗具有重要的意义。
利拉鲁肽为胰高血糖素样肽-1激动剂,是2型糖尿病治疗药物。由于临床中很多2型糖尿病并发肥胖症,长期观察证明,利拉鲁肽能有效减轻患者体重,是一种较为理想的减肥药物。在2014年12月,利拉鲁肽以商品名Saxend a获得FDA减肥药上市许可,成为了减肥药市场新一款重磅药物。
除此之外,2015年1月,Za fgen宣称,其旗下治疗下丘脑损伤引起的肥胖症药物beloranib可以明显改善病患血脂含量、炎症症状,是一款极具开发潜力的减肥药。目前,该公司正在进行beloranib针对普达-威利综合症治疗的三期临床开发。普达-威利综合症会使患者产生饥饿感而过度饮食从而导致肥胖症。如果此项研究获得成功,beloranib将在减肥药市场占据重要位置。
总结
当前人类在健康领域面临各种疾病的长期挑战,比如肿瘤、心脑血管疾病、糖尿病、免疫絮乱、病毒感染(艾滋病、肝炎等)。为了攻克这些疾病,医药领域的新技术和新药物不断涌现,整个行业正在向满足个性化用药需求和针对疾病的综合性药物治疗两极发展。目前,国际上创新药物的研发趋势主要呈现两个特点:一是生命科学的前沿技术,如基因组、蛋白质组和生物信息学等技术与药物研究紧密结合并取得了巨大的进展,新的药物靶点不断的被发现,为新药研发提供了基础;二是系统生物学、计算机科学、信息科学等新学科越来越多地被应用到新药前期研究中,并由此衍生出了一批具有重要应用价值的新技术,可以预计在未来的新药研发过程中,这些技术将发挥越来越重要的作用。随着新技术的发展和新药物的出现,也许,未来人们攻克各类疾病不再是天堑。
[1] 孙树森, 李新辰, 韩容, 赵志刚. 2014年美国FDA批准的新分子实体与评价: 感染和传染病治疗用药. 药品评价[J], 2015(2). 8-14, 32.
[2] 李发红, 张继明. 直接抗丙型肝炎药物的新进展[J]. 中国感染与化疗杂志. 2014: 86-88.
[3] Lam B, Henry L, Younossi Z. Sofosbuvir (Sovaldi) for the treatm ent of hepatitis C[J]. Expert Rev Clin Pharm. 2014, 7: 555-566.
[4] Keener, A. Drugs that m ade head lines in 2014. Nat Med[J], 2014. 20(12). 1370-1371.
[5] Ho rton, J D, Cohen J C, Hobbs H H. PCSK9: a convertase that coordinates LDL catabolism[J]. J Lipid Res. 2009, 50 supp l: S172-177.
[6] 蔡晓凌,纪立农. 从指南变迁看二甲双胍在2型糖尿病治疗中的地位[J]. 药品评价, 2015: 9-13.
[7] 刘永贵, 田红, 解学星, 沈雪砚, 陈常青. 治疗2型糖尿病的非胰岛素类药物的研究进展[J]. 现代药物与临床. 2013, 28: 108-113.
[8] High, K H, A. Nathw ani, T. Spencer, D. Lillicrap. Cu rren t status o f haem ophilia gene therapy. Haem ophilia[J], 2014. 20. 43-49.
[9] 王华芳. 血友病治疗新理念[J]. 江苏卫生保健: 今日保健. 2014: 24-25.
[10] 朱军容, 曹经江, 魏荣, 吴斌. 浅谈银屑病的临床治疗进展[J]. 现代医药卫生. 2014, 30: 631-632.
[11] Warren, R B, C.H. Sm ith, Z Z N. Yiu, et al. Differen tial Drug Survival o f Bio logic Therap ies for the Treatm en t of Psoriasis: A Prospective Obsevational Cohort Study from the British Association of Derm atologists Bio log ic In teren tions Resister (BASBIR). J Invest Derm ato l[J], 2015. DOI 10.1038/jid.2015.208
[12] Kragballe, K, E. H�lzle, P C M. van de Kerkhof, et al. Treatm ent of p laque psoriasis, in Psoriasis. 2014, John Wiley & Sons, Ltd. p. 163-213.
[13] Eggerm ont, A M M, A. Spatz, C. Robert. Cutaneous m elanom a. The Lancet[J]. 383(9919). 816-827.
[14] Finger, E C , C F. Cheng, T R. William s, et al. CTGF is a therapeu tic target for m etastatic m elanom a. Oncogene[J], 2014. 33(9). 1093-1100.
[15] Pouw er, F. Im pact o f cancer on use of g lucose-low ering d rug treatm en t in ind ividuals w ith d iabetes: po ten tial m echanism s. Diabetologia[J], 2015. 58(6). 1378-1379.
[16] Yanovski, S.Z.J.A. Yanovski. Long-term drug treatm ent for obesity: A system atic and clinical review. JAMA[J], 2014. 311(1). 74-86.
[17] 易青, 王曦. 差强人意的减肥药市场[J]. 中国处方药. 2013: 5-7.

