以《中国药品综合评价指南参考大纲》为依据对达托霉素进行综合评价——安全性评价
王江峰,范辉,马珂
浙江大学医学院附属邵逸夫 医院药学部,浙江杭州 310016
编者按:《中国药品综合评价指南参考大纲》是由中国药学会医院药学专业委员会发起,在医院药学界的泰斗李大魁教授和人力资源与社会保障部社会保障研究所何平的研究员的共同领导下,凝结了国内医院药学界的顶尖专家的集体智慧形成的。我刊于2015年4月(第12卷第8期)全文刊登了《中国药品综合评价指南参考大纲》(第二版),现将以此大纲为依据对达托霉素进行综合性评价的稿件分期刊登,谨供读者参考。
1. 药品概况
1.1 药学部分 药品通用名称:注射用达托霉素(d ap tom ycin fo r in je c tion);商品名:克必信(CUBICIN�);规格:0.5g。本品主要成分为达托霉素,为浅黄色至淡褐色冻干之块状物。辅料中含有氢氧化钠,用于调节pH值。
1.2 企业部分 克必信由美国Cub ist制药公司(Cub ist Pharm aceuticals Inc.)注册生产。在中国国内,克必信由美国Hosp ira Inc.为Cub ist制药公司生产,并由阿斯利康制药有限公司分装销售。
1.3 上市信息 达托霉素,2003年9月首先在美国上市,2006年1月在欧洲(英国、荷兰等国家)上市,2007年3月在日本上市,2009年9月通过国家食品药品监督管理总局(CFDA,原SFDA)审批在中国上市。
2 药品安全性信息
2.1 达托霉素上市前安全信息 达托霉素申办的临床试验中,入组了1667名患者接受达托霉素的治疗,1319名患者接受对照药的治疗。在达托霉素申办的1、2、3期临床试验中,大多数的不良事件均为轻度或中度。在金黄色葡萄球菌菌血症/心内膜炎试验中,20/120(16.7%)的患者因不良事件而中止了达托霉素的用药,而有21/116(18.1%)的患者停用对照药。
革兰阴性菌感染:在金黄色葡萄球菌菌血症/心内膜炎试验中,10/120(8.3%)接受本药治疗的患者发生了严重的革兰阴性菌感染及非严重革兰阴性血流感染,而以对照药治疗的患者为0/115。对照组的患者接受了联合治疗,包括先给予庆大霉素治疗4天。在治疗期间及随访的早期和晚期都有不良事件的报告。革兰阴性感染包括胆管炎、酒精性胰腺炎、胸骨骨髓炎/纵隔炎、肠梗阻、复发性克罗恩病,复发性管性败血症以及复发性尿脓毒症。1名患胸骨骨髓炎的患者进行二尖瓣修复术后,发生了金黄色葡萄球菌心内膜炎,并有1个2cm的二尖瓣赘生物,在并发肠梗塞、多菌种菌血症后死亡。
复杂皮肤和软组织感染(com p licated skin and skin structure in fections,cSSSI)试验中患者最常见的不良事件见表1。
cSSSI试验中,发生率为1%~2%的不良事件包括:浮肿、蜂窝组织炎、低血糖、碱性磷酸酶升高、咳嗽、背痛、腹痛、低钾血症、高血糖、食欲减退、焦虑、胸痛、喉咙痛、心脏衰竭、神经混乱以及念珠菌感染。达托霉素(4 m g/kg)试验组这些事件的发生率为0.2%~1.7%,而对照组为0.4%~1.8%。
cSSSI试验中,接受达托霉素治疗的患者,发生率<1%的其他药物相关不良事件(包括很可能或可能由药物导致的)为:
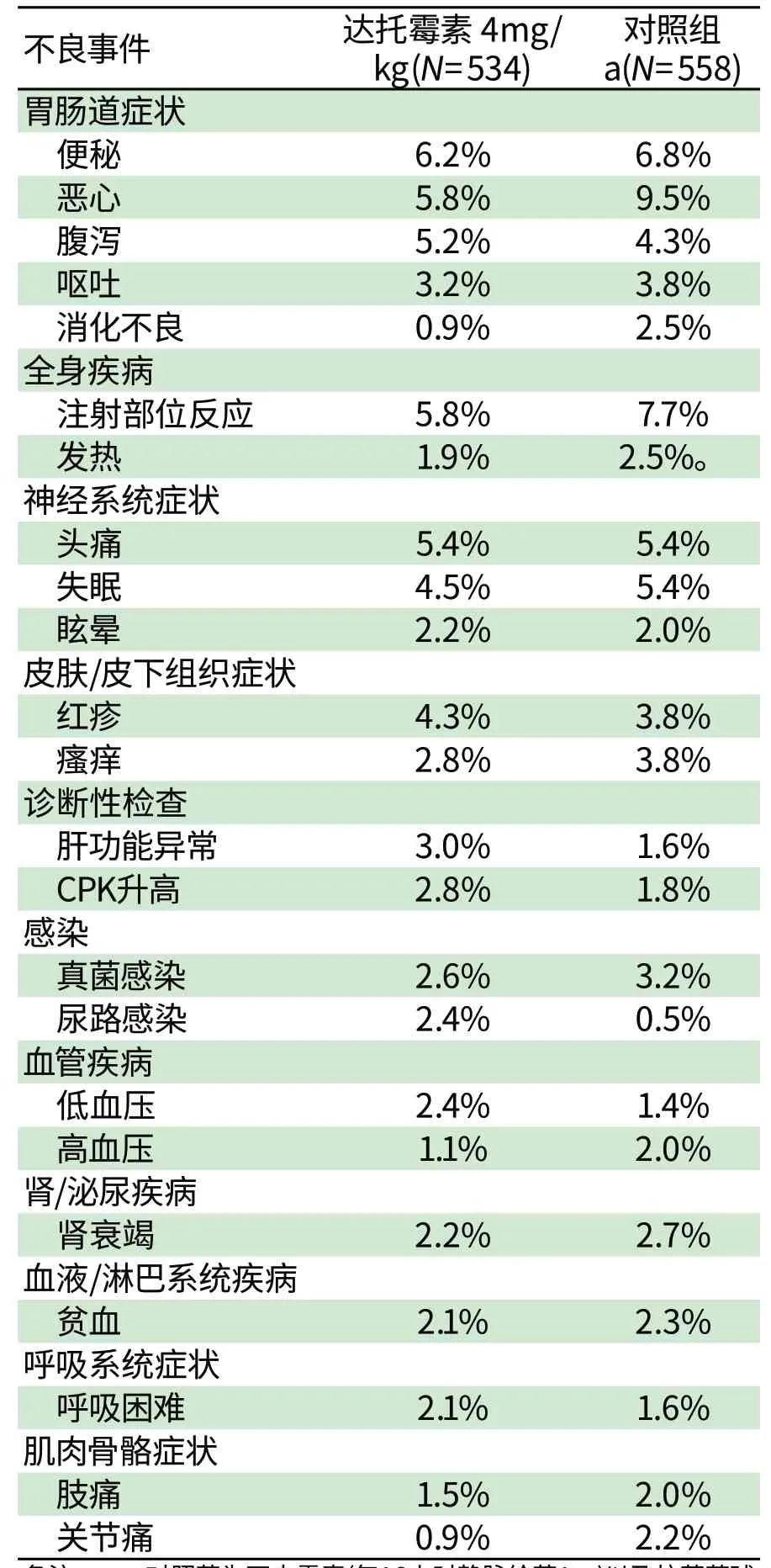
表1 cSSSI 3期研究中,达托霉素或对照治疗组中发生率在2%以上患者的不良事件的发生率(%)。Tab1 Incidence of Adverse Reactions that Occurred in≥2% o f Patients in the Dap tom ycin Treatm ent Group and the Com parator Treatm ent Group in Phase 3 cSSSI Trials
全身系统:疲劳、虚弱、寒战、不适、神经过敏、面红、过敏。
血液/淋巴系统:白细胞增多、血小板减少、血小板增多、嗜酸细胞增多、国际标准化率(INR)升高。
心血管系统:室上性心律失常。
皮肤系统:湿疹。
消化系统:腹胀、胃气胀、口炎、黄疸、血清乳酸脱氢酶升高。
代谢/营养系统:低镁血症、血清重碳酸盐升高、电解质紊乱。
骨骼肌肉系统:肌痛、肌痉挛、肌无力、骨髓炎。
神经系统:眩晕、精神状态改变、感觉异常。
特殊感觉:味觉障碍、眼部刺激。
按系统器官分类(SOC),在金黄色葡萄球菌菌血症/心内膜炎(6m g/kg达托霉素)患者中最常见的不良事件见表2。
达托霉素治疗组中,上表中未包括的以下不良事件,可能或很可能与药物相关:
血液及淋巴系统症状:嗜酸细胞增多(1.7%),淋巴结病(<1%),血小板增多(<1%),血小板减少(<1%)。
心脏疾病:心房颤动(<1%),心房扑动(<1%),心跳停止(<1%)。
耳及迷路症状:耳鸣(<1%)。
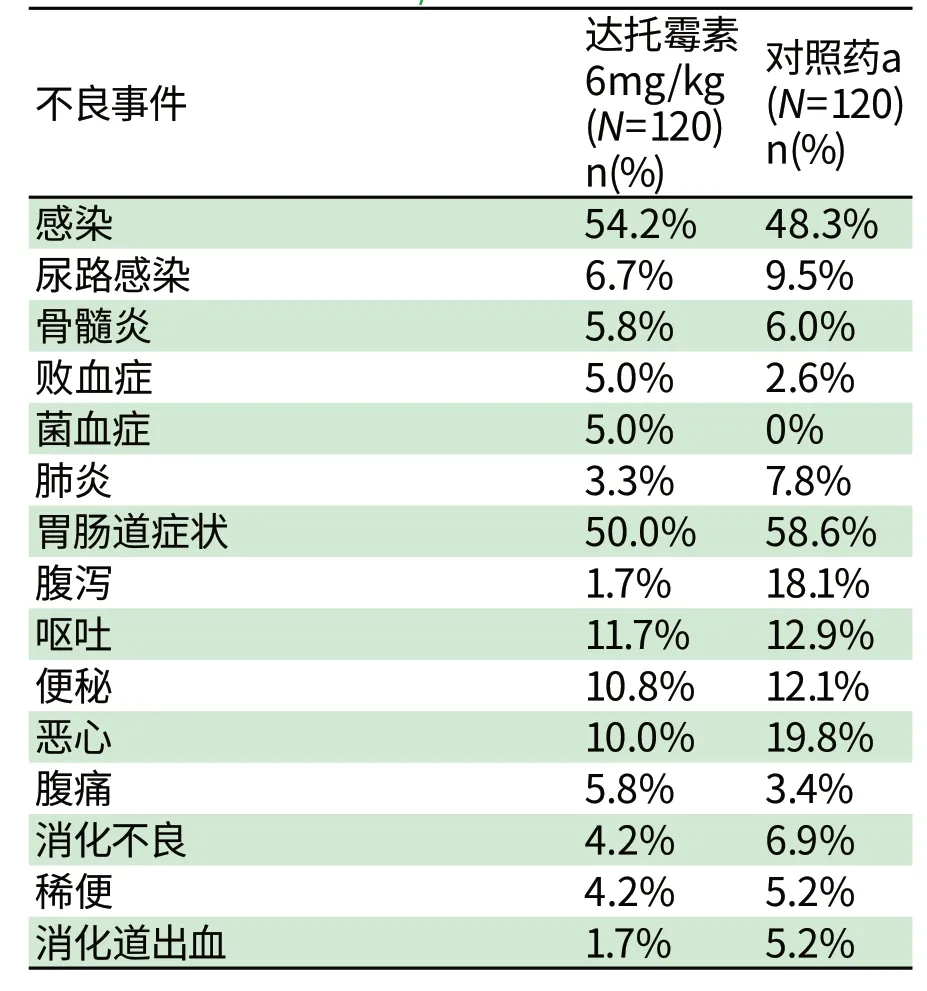
表2 金黄色葡萄球菌菌血症/心内膜炎研究中,在达托霉素试验组或对照组中,5%以上患者发生的不良事件的发生率(%)Tab2 Incidence of Adverse Reactions that Occurred in≥5% of Patients in the Dap tom ycin Treatm ent Group and the Com parator Treatm ent Group in the S.aureus Bacterem ia/Endocard itis Trial
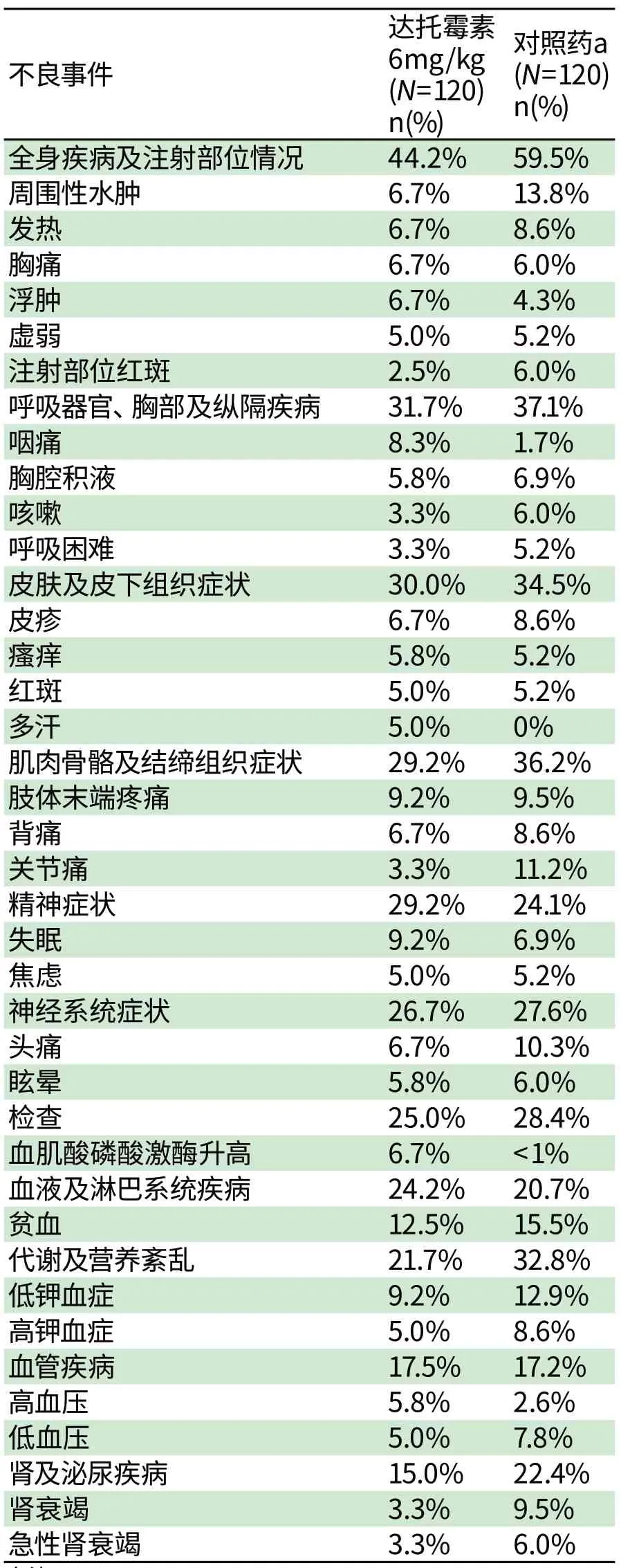
备注:a:对照药:万古霉素(每12小时静脉给药1g )以及抗葡萄球菌的半合成青霉素类(即萘夫西林、苯唑西林、氯唑西林、氟氯西林,每4小时2 g IV)。
眼病:视力模糊(<1%)。
消化道症状:口干(<1%),上腹部不适(<1%),牙龈疼痛(<1%),口腔感觉减退(<1%)。
感染:念珠菌感染(1.7%),阴道念珠菌病(1.7%),真菌血症(<1%),口腔念珠菌病(<1%),尿道真菌感染(<1%)。
检查:血磷升高(2.5%),血碱性磷酸酶升高(1.7%),INR率升高(1.7%),肝功能检查异常(1.7%),丙氨酸转氨酶升高(<1%),天冬氨酸转氨酶(<1%),凝血酶原时间延长(<1%)。
代谢及营养紊乱:食欲减退(<1%)。
肌肉骨骼及结缔组织症状:肌痛(<1%)。
神经系统症状:运动障碍(<1%),感觉异常(<1%)。
精神症状:幻觉(<1%)。
肾及泌尿症状:蛋白(<1%),肾损伤(<1%)。
皮肤及皮下组织症状:热疹(<1%),泛发性瘙痒(<1%),泡疹(<1%)。
在社区获得性肺炎(CAP)的3期研究中,达托霉素治疗组患者的死亡率和严重心肺不良事件发生率高于对照组。这些差异是因为达托霉素对发生不良事件的CAP患者缺乏有效性造成的(见适应症)。
实验室改变:在cSSSI和CAP3期对照研究中,达托霉素组和对照组的患者CPK升高没有临床或统计学显著性差异(<0.05)。两组的CPK升高都主要是由医学原因引起,如皮肤和皮肤结构感染、手术、或肌肉注射导致的,并未伴随肌肉症状。
在cSSSI研究中,0.2%的达托霉素患者具有肌肉疼痛或虚弱的症状,并伴随着CPK升高,超过正常值范围上限4倍。症状能在3天内缓解,而CPK在停药后7~10天后回落到正常值。表3总结了在cSSSI试验中到治疗结束时CPK自基线升高的情况。
在金黄色葡萄球菌菌血症/心内膜炎研究中,共有11名(9.2 %)以达托霉素治疗的患者因治疗导致CPK>500 U/L,其中4人CPK升高超过10倍ULN。这11名患者中的3人在继续使用达托霉素治疗的过程中CPK水平回落到正常范围内,6名患者在随访期内恢复正常值,1名患者在末次评估时回到基线水平,1人未报告任何随访期数据。3名患者因CPK升高而停用本药。
2.2 不良事件及不良反应 (1)PubMed检索文献:主要检索达托霉素的临床研究及上市后安全性研究。表5给出了达托霉素治疗中出现的不良事件及不良反应的例数及构成比。一些文献给出了具体不良事件及终止治疗或致死的原因。① 在“致终止治疗不良事件”项下,Ku llar等[1]报道了2例与达托霉素相关不良事件而终止使用达托霉素的病例,其中1例为高血钾,另1例为间质性肺炎。Tim e rm an等[2]报道了3例,分别为心跳骤停、上消化道出血以及CPK升高。Knap p等[4]报道了2例,考虑与达托霉素无关。Cham berlain等[5]报道了5例,其中1例为CPK升高合并肌痛与达托霉素有关,其余4例与达托霉素无关。Ro lston等[8]报道了13例导致终止使用达托霉素的不良事件,其中4例与达托霉素有关,分别为CPK升高(1例)、肝功能异常(1例)和中性粒细胞减少(2例)。Brow n等[9]道5例,包括低血压、横纹肌溶解、间质性肾炎、CPK升高、CPK升高合并横纹肌溶解。Mo ise等[11]报道了2例因CKP升高而导致停用达托霉素的病例。此外,La i等[3]报道了3例,Mueller等[6]报道了12例,Crom p ton等[13]报道了23例,但均未给出具体的不良事件。②在“严重不良事件”项下,Cham berlain等[5]报道了1例CPK升高合并肌痛的严重不良事件。M ue lle r等[6]报道了6名患者发生了9项严重不良事件,包括横纹肌溶解、嗜酸性粒细胞增多症、荨麻疹、肾功能不全、全血细胞减少等。Brow n等[9]报道4例与达托霉素相关的严重不良事件,分别为低血压、横纹肌溶解、间质性肾炎和肾衰竭。Moise等[11]报道了1例使用达托霉素后发生艰难梭菌结肠炎的严重不良事件。Ku llar等[1]报道了3例严重不良事件,但未给出具体的不良事件。③在“致死不良事件”项下,Rege等[12]报道了63例死亡病例,其中4例为使用达托霉素导致的不良事件。此外,多篇文献[2,8]报道在达托霉素治疗过程中发生死亡的不良事件,但均认为该不良事件由其他药物或疾病本身造成,与达托霉素无关。

表3 cSSSI 3期研究中,达托霉素组或对照组在治疗期间肌酸磷酸激酶(CPK)自基线升高的发生率(%)Tab3 Incidence of CPK Elevations from Baseline during Therapy in Either the Dap tom ycin Treatm ent Group or the Com parator Treatm en t Group in Phase 3 cSSSI Trials
(2)CHKD文献检索:国内暂时没有达托霉素安全性的相关报道。
2.3 用药差错及事故 2003年,美国一夜班药师在首次调配达托霉素医嘱过程中,将达托霉素(dap tom ycin)错配成了更生霉素(dactinom ycin),造成用药差错[14]。2009年,美国一患者体重150磅(约68kg)错写成150kg,而达托霉素给药剂量按照150kg体重计算,造成用药错误[15]。
2.4 与其他抗阳性菌抗菌药物的安全性比较 (1)PubMed 文件检索:表6给出了达托霉素与其他抗阳性菌抗生素安全性比较的文10献篇。结果表明,达托霉素耐受性良好,多数不良事件为轻中度反应,发生率最高的为胃肠道反应。一些文献给出了具体不良事件及终止治疗或致死的原因。①在“致终止治疗不良事件”项下,Cha ftari等[16]报道了1例患者因CPK过高而停用达托霉素。Byren等[18]报道了2例CPK升高、2例横纹肌溶解和1例麻疹。Liang等[21]报道了1例CPK过高的病例,Lip sk等[22]报道了2例CPK过高的病例。M oo re等[23]报道了1例患者CPK最高达6827U/L而停用达托霉素。Sh restha等[25]报道与达托霉素相关的不良事件包括皮疹、CPK升高、白细胞减少、多种症状并存。Carugati等[19]报道了2例,Konychev等[20]报道了3例,但均未给出具体的不良事件。②在“严重不良事件”项下,Aikaw a等[17]报道10例SAE,其中1例过敏性休克与达托霉素有关。Konychev等[20]报道了11例SAE,其中1例CKP升高与达托霉素有关,1例全血细胞减少与半合成青霉素有关,而万古霉素则造成1例急性肾衰竭。By ren等[18]报道了4例与达托霉素有关的SAE,但未给出具体不良事件。Lip sk等[22]报道了1例患者在达托霉素治疗第2周出现CPK升高伴上肢疼痛和无力。③在“致死不良事件”项下,尚没有文献报道达托霉素有关的致死不良事件。Aikaw a等[17]报道达托霉素治疗组中有1例致死不良事件,但考虑与研究药物无关。
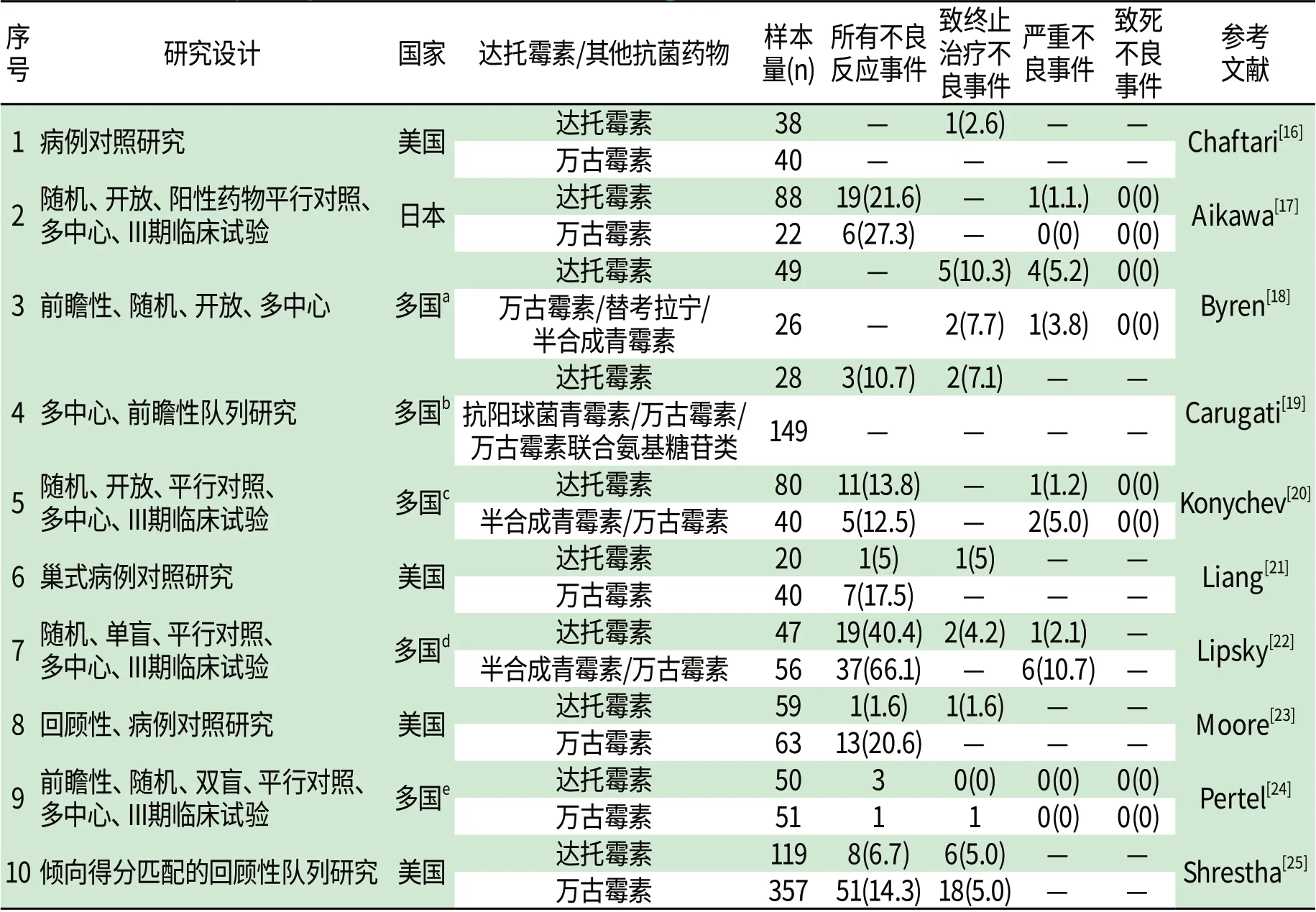
表6 达托霉素与其他抗菌药物相关的不良事件[n(%)]Tab6 ADEs o f Dap tom ycin and o ther an tibiotic agen ts[n(%)]
(2)CHKD文献检索:国内暂时没有达托霉素安全性的相关报道。
2.5 政府采取的措施 关于达托霉素上市后的安全使用,FDA及CFDA给出了下列信息。
(1)FDA:①2008年6月,FDA根据厂家信息发布公告[26],达托霉素不应与Read y MED�弹性输液泵(Card inal Health, Inc.)结合使用。对保存在Ready M ED�弹性输液泵中的达托霉素溶液进行稳定性研究,鉴别出从泵系统中渗透至本品溶液中的一种杂质(2-巯基苯并噻唑)。②2010年7月29日发布信息[27],就诊疗过程中使用静脉内注射药物达托霉素(dap tom ycin,Cubist制药公司生产,商品名Cubicin)可能引起嗜酸细胞性肺炎的问题提醒患者以及医疗专业人员,并要求达托霉素生产商将该信息列入药品说明书的“警告及注意事项”和“不良反应及上市后经验”项。③达托霉素可能引起艰难梭状杆菌相关性肠炎,2010月12月,将该信息已加入到达托霉素说明书的“不良反应及上市后经验”项中[28]。④有个案研究结果表明,达托霉素可透过乳汁分泌。2012年3月,该信息加入到达托霉素说明书的“注意事项”项下“特殊人群使用”项中[28]。⑤达托霉素可能引起嗜酸性粒细胞增多及全身症状的血管性水中和药物疹,2013年11,该信息加入到达托霉素说明书的“不良反应及上市后经验”项中[28]。
(2)CFDA:2010年9月1日,《药物警戒快讯》发不了《美国警告达托霉素可能引起嗜酸细胞性肺炎》的通告,其内容转载了FDA公布的相关公告[29]。
3 小结
目前临床上用于治疗MRSA的主要抗菌药物为万古霉素和利奈唑胺,但万古霉素和利奈唑胺都在安全性方面存在挑战。万古霉素最主要的严重不良反应为肾毒性和耳毒性,考虑与其血药浓度相关。相关指南[30]建议对万古霉素进行血药浓度监测,对MRSA引起的复杂感染和重症感染患者,建议其谷浓度维持在15~20 m g/L。利奈唑胺耐受性良好,但也存在一些严重不良反应,比如骨髓抑制、视神经毒性、乳酸性酸中毒等。
达托霉素是第一个用于临床的环酯肽类抗生素,2003年9月,美国FDA首次批准达托霉素用于治疗复杂皮肤和皮肤结构感染(cSSSI),2006年又进一步批准了达托霉素用于治疗金葡菌引起的心内膜炎和菌血症。达托霉素具有良好的耐受性,多数不良事件为轻中度反应,不良反应的发生率和分布与对照药物(万古霉素和半合成青霉素)相似,最常见的不良反应为胃肠道反应[31]。临床研究中发现达托霉素可致肌肉疼痛或虚弱,并伴随CPK升高[31],而PubMed文献检索同样证实达托霉素最长见的SAE以及致终止治疗的不良事件为CPK升高。达托霉素与HMG-Co A还原酶抑制剂合用时可能增加发生横纹肌溶解的风险,因此不建议达托霉素与HMG-CoA还原酶抑制剂同时使用[32]。达托霉素用于治疗cSSSI的推荐总剂量为4m g/kg,用于治疗金葡菌引起的心内膜炎和菌血症的推荐剂量为6m g/kg,但多篇问文献[1,3,7,11]结果显示不良反应的发生率与达托霉素的给药剂量不相关。此外,FDA通报达托霉素可能引起嗜酸细胞性肺炎,而厂家在说明书的“不良反应及上市后经验”中加入了可能引起艰难梭状杆菌相关性肠炎、嗜酸性粒细胞增多及全身症状的血管性水中和药物疹等内容。
[1] Kullar R, Davis S L, Levine D P, et al. High-dose dap tom ycin fo r treatment of comp licated gram-positive infections: a large, multicenter, retrospective study[J]. Pharm acotherapy. 2011, 31(6): 527-536.
[2] Tim erm an A, Brites C, Bicudo E, et al. Brazilian experience in EUCORE: daptom ycin registry and treatm ent of serious Gram-positive in fections[J]. Braz J In fect Dis. 2013, 17(6): 647-653.
[3] Lai C C, Sheng W H, Wang J T, et al. Safety and efficacy o f highdose dap tom ycin as salvage therapy for severe g ram-positive bacterial sepsis in hosp italized adult patients[J]. BMC Infect Dis. 2013, 13: 66.
[4] Knapp A G, Kam epalli R K, Martone W J, et al. Prospective, noncom parative study of dap tom ycin for the treatm en t of superficial and deep incisional surgical site infections[J]. Surg Infect (Larchm t). 2011, 12(2): 113-118.
[5] Chamberlain R S, Culshaw D L, Donovan B J, et al. Daptom ycin for the treatm ent of surgical site infections[J]. Surgery. 2009, 146(2): 316-324.
[6] Muelle r B A, Crom p ton J A, Donovan B J, et al. Safety o f daptom ycin in patients receiving hemodialysis[J]. Pharm acotherapy. 2011, 31(7): 665-672.
[7] Ku llar R, Casapao A M, Davis S L, et al. A m ulticentre evaluation of the effectiveness and safety of high-dose dap tom ycin for the treatm en t of in fective endocard itis[J]. J Antim icrob Chem other. 2013, 68(12): 2921-2926.
[8] Ro lston K V, Besece D, Lam p K C, et al. Dap tom ycin use in neutropenic patients w ith docum ented gram-positive infections[J]. Suppo rt Care Cancer. 2014, 22(1): 7-14.
[9] Brow n J E, Fom inaya C, Ch ristensen K J, et al. Dap tom ycin experience in critical care patien ts: results from a registry[J]. Ann Pharm aco ther. 2012, 46(4): 495-502.
[10] Lai C C, Sheng W H, Wang J T, et al. Safety and efficacy o f dap tom ycin fo r the treatm en t o f hosp italized adult patients in Taiw an w ith severe staphylococcal in fections[J]. J M icrobio l Imm uno l In fect. 2012, 45(1): 52-57.
[11] Moise P A, Hershberger E, Am od io-Gro ton M I, et al. Safety and clinical ou tcom es w hen u tilizing high-dose (>o r=8m g/kg) daptom ycin therapy[J]. Ann Pharm acother. 2009, 43(7): 1211-1219.
[12] Rege S, Moh r J, Lam p K C, et a l. Safety o f dap tom ycin in patients com p leting m ore than 14 days of therapy: results from the Cubicin(R) Outcom es Registry and experience[J]. Int J Antim icrob Agen ts. 2013, 41(5): 421-425.
[13] Crom pton J A, North D S, Mcconnell S A, et al. Safety and efficacy of daptom ycin in the treatment of osteom yelitis: results from the CORE Registry[J]. J Chem other. 2009, 21(4): 414-420.
[14] ISMP. ISMP Qua rte rly Action Agenda--M ix-up be tw een COSMEGEN (dactinom ycin) and CUBICIN (dap tom ycin).https://www.ism p.org/newsletters/acutecare/articles/A1Q04Action.asp[N].
[15] ISMP. ISMP Quarterly Action Agenda-- Lbs/kg confusion. https://www.ism p.org/newsletters/acutecare/articles/A2Q09Action.asp[N].
[16] Chaftari A M, Hachem R, Mu lanovich V, et al. Efficacy and safety of daptom ycin in the treatm ent of Gram-positive catheter-related b loodstream in fections in cancer patien ts[J]. In t J An tim icrob Agen ts. 2010, 36(2): 182-186.
[17] Aikaw a N, Kusachi S, M ikam o H, et al. Efficacy and safety o f intravenous daptom ycin in Japanese patients w ith skin and soft tissue in fections[J]. J In fect Chem o ther. 2013, 19(3): 447-455.
[18] Byren I, Rege S, Cam panaro E, et al. Random ized con trolled trial of the safety and efficacy o f Dap tom ycin versus standardof-care therapy fo r m anagem ent of patien ts w ith osteom yelitis associated w ith prosthetic devices undergoing two-stage revision arthrop lasty[J]. Antim icrob Agents Chemother. 2012, 56(11): 5626-5632.
[19] Carugati M, Bayer A S, M iro J M, et al. High-dose dap tom ycin therapy for left-sided infective endocard itis: a prospective study from the international collaboration on endocarditis[J]. Antim icrob Agen ts Chem o ther. 2013, 57(12): 6213-6222.
[20] Konychev A, Heep M, Mo ritz R K, et al. Safety and Efficacy o f daptom ycin as first-line treatm ent for com p licated skin and soft tissue infections in elderly patients: an open-label, m ulticentre, random ized phase IIIb trial[J]. Drugs Aging. 2013, 30(10): 829-836.
[21] Liang S Y, Khair H N, Mcdonald J R, et al. Dap tom ycin versus vancom ycin for osteoarticular infections due to methicillin-resistant Staphylococcus aureus (MRSA): a nested case-control study[J]. Eur J Clin M icrobio l In fect Dis. 2013.
[22] Lipsky B A, Stou tenbu rgh U. Dap tom ycin for treating in fected d iabetic foot ulcers: evidence from a random ized, con trolled trial com paring daptom ycin w ith vancom ycin or sem i-synthetic penicillins for com p licated skin and skin-structure infections[J]. J An tim icrob Chem o ther. 2005, 55(2): 240-245.
[23] Moore C L, Osaki-Kiyan P, Haque N Z, et al. Dap tom ycin versus vancom ycin for bloodstream infections due to m ethicillin-resistant Staphylococcus aureus w ith a high vancom ycin m inim um inhibitory concentration: a case-control study[J]. Clin Infect Dis. 2012, 54(1): 51-58.
[24] Pertel P E, Eisenstein B I, Link A S, et al. The efficacy and safety of daptom ycin vs. vancom ycin for the treatm ent of cellulitis and erysipelas[J]. In t J Clin Pract. 2009, 63(3): 368-375.
[25] Sh restha N K, Mason P, Go rdon S M, et al. Adverse even ts, healthcare interventions and healthcare utilization during hom e infusion therapy w ith daptom ycin and vancom ycin: a propensity score-m atched cohort study[J]. J Antim icrob Chem other. 2014.
[26] Fda. Avoid Using ReadyMED Infusion Pum ps w ith Cubicin. http://www.accessdata.fda.gov/psn/p rin ter.cfm?id=805[N].
[27] Cubicin (dap tom ycin): Drug Safety Comm unication - Risk o f Eosinophilic Pneum onia. http://www.fda.gov/Safety/MedWatch/Safety In fo rm ation/SafetyAlertsfo rHum anMed icalProducts/ucm 220499.h tm[N].
[28] Fda. Cubicin (daptom ycin) for injection. http://www.fda.gov/safety/m edw atch/safetyin fo rm ation/ucm 225842.h tm[N].
[29] Cfda. 美国警告达托霉素可能引起嗜酸细胞性肺炎. h ttp://www.sda.gov.cn/WS01/CL0389/53535_2.h tm l[N].
[30] Martin J H, No rris R, Barras M, et al. Therapeu tic m onitoring o f vancom ycin in adult patients: a consensus review of the Am erican Society o f Health-System Pharm acists, the In fectious Diseases Society o f Am erica, and the Society Of In fectious Diseases Pharm acists[J]. Clin Biochem Rev. 2010, 31(1): 21-24.
[31] Arbeit R D, Maki D, Tally F P, et al. The safety and efficacy o f daptom ycin for the treatment of com p licated skin and skin-structure in fections[J]. Clin In fect Dis. 2004, 38(12): 1673-1681.
[32] Shoem aker D M, Sim ou J, Ro land W E. A review of dap tom ycin for injection (Cubicin) in the treatment of com p licated skin and skin structure infections[J]. Ther Clin Risk Manag. 2006, 2(2): 169-174.

