压热处理对米糠蛋白功能特性的影响研究
王长远,郝天舒
(黑龙江八一农垦大学食品学院,大庆 163319)
米糠是水稻加工过程中形成的主要副产物,即稻米碾磨挤压中所碾磨出的皮层及碎米与米胚的混合物[1]。我国是产粮大国,每年稻谷的产量高达2 亿t,米糠年产可达140 万t,总量约占全球产量的1/3[2]。通常,米糠重蛋白质含量约为12%~16%,脂肪含量约为16%~22%,水分含量约为7%~14%[3-4]。而脱脂处理后米糠的蛋质含量可达到18%左右,是一种极有利用价值的植物源蛋白质[5]。米糠蛋白的另一个显著优点是氨基酸组成配比较为合理,十分接近FAO/WHO 的推荐模式;并且米糠蛋白还是低过敏性蛋白,可安全地应用于婴儿食品中[6]。
虽然,米糠蛋白的营养功能性已广受认可,但目前,米糠蛋白及其同类产品并未实现商品化,主要是受限于米糠蛋白的低溶解性。当今已有部分研究采用物化改性手段对米糠蛋白进行修饰,并表现出较为良好的效果,其中热处理是较为广泛使用的一种技术手段。研究采用压热处理对米糠蛋白进行修饰,探究压热处理对米糠蛋白功能性的影响,以期为后续研究提供理论依据。
1 材料与方法
1.1 实验材料和仪器
材料:米糠蛋白,由实验室制备(米糠蛋白蛋白含量为89.21%);其他化学试剂均为国产分析纯。
仪器:手提式压力蒸汽灭菌器,广州康迈医疗器械有限公司;CR22G 高速冷冻离心机,日本日立公司;pHS-3D pH 计,上海雷磁公司;722 型分光光度计,上海精密科学仪器有限公司;ATN-300 全自动定氮仪,上海洪纪仪器设备有限公司;JJ-1 精密增力电动搅拌器,江苏省金坛市宏华仪器厂。
1.2 实验方法
1.2.1 米糠蛋白的提取
粗米糠过60 目筛除去内部杂质,过筛后加入正己烷比例为1∶6(g·V-1),搅拌2 h,静止3 min 后4 000 r·min-1下离心5 min 除去上清液,重复两次脱脂处理,沉淀经风干处理后制得脱脂米糠用于后续研究。
脱脂米糠100 g,按料液比1∶10 加入1 000 mL水,用NaOH 溶液调pH 至9,45 ℃下恒温水浴搅拌2 h,4 000 r·min-1下离心20 min,收集上清液,调节pH 至4.5,静止沉淀后4 000 r·min-1离心15 min,倾去上清液,沉淀于4 ℃对蒸馏水透析48 h,沉淀真空冷冻干燥,即为米糠蛋白粉,-20 ℃保存备用。
1.2.2 压热处理米糠蛋白
将米糠蛋白溶解于pH 7.0 磷酸缓冲液中,配制成浓度为5%的米糠蛋白溶液,用作储备液。然后将储备液用标准缓冲液稀释分装在三角瓶中,用软胶塞塞住瓶口避免水分蒸发。
将样品放入手提式高压灭菌锅(121 ℃、0.1 MPa)中分别处理10、15、20、25、30 min,样品处理后迅速冷却,经冷冻干燥后备用。
1.2.3 溶解性
蛋白的溶解性以氮溶指数表示。精确称取2.00 g蛋白样品,溶解于45 mL 蒸馏水中,调节pH 至7.0,室温下搅拌1 h 后,在4 000 r·min-1下离心20 min出去沉淀,测定上清液中的氮含量。
溶解度(%)=(上清液蛋白质含量/样品总蛋白含量)×100%
1.2.4 乳化性及乳化稳定性
准确称取1.00 g 样品,加入到0.05 mol·L-1,pH 7.0 的磷酸缓冲液中,配置成1%的蛋白溶液100 mL,使之充分溶解。取75 mL 蛋白溶液与25 mL大豆油充分混合,在高速剪切乳化机下4 000 r·min-1乳化2 min,然后立刻在烧杯底部吸取20 μL 乳状液,加入至5 mL 0.1%的SDS 溶液中混合均匀,使之稀释250 倍,测定500 nm 下的吸光值。按下面公式计算乳化活性EAI。
EAI=2T×N×A0/(c×Φ×10 000)其中:T=2.303;
N—稀释倍数,250;
c—乳化液未形成前蛋白质溶液的浓度,g·mL-1;
Φ—乳化液中油相体积分数,0.25;
A0—0 min 时的吸光值。
测定蛋白的乳化稳定性,需要等乳化液放置10 min 后,再从烧杯底部吸取液体,按如上方法测定吸光值。按下面公式计算乳化稳定性ES。
ES=A0×t/(A0-A10)
其中:A0—0 min 时的吸光值;
A10—10 min 时的吸光值;
t—间隔时间,10 min。
1.2.5 起泡性及起泡稳定性
取一定量米糠蛋白样品加入到0.01 mol·L-1的pH 7.0 磷酸缓冲液中,配置成5%蛋白溶液,取200 mL 样品,在高速均质机下以4 000 r·min-1,搅打2 min,快速移至500 mL 量筒中,记录0 min,15 min泡沫的高度,表示蛋白起泡能力的大小,并进行3 次重复试验。按如下公式计算:
泡沫膨胀率(%)=(H0-H)/ H
其中,H—未搅打时溶液的高度,cm;
H0—搅打停止时泡沫的高度,cm。
泡沫稳定性(%)=H15/H0
其中:H15—搅打停止静置15 min 时泡沫的高度,cm。
1.2.6 表面疏水性
称取一定量的米糠蛋白溶解于0.01 mol·L-1pH7.0 的磷酸盐缓冲液,4 000 r·min-1离心30 min 除去沉淀,采用Lowry 法测定上清液的蛋白浓度,控制蛋白质浓度在0.005~0.5 mol·mL-1,取不同浓度梯度的米糠蛋白溶液3 mL,分别加入ANS 溶液30 μL(8 mmol·L-1),经振荡处理后静置5 min,利用荧光分光光度计测定蛋白质样品的荧光强度。条件为:荧光光谱的激发波长λex=370 nm,发射波长λem=490 nm,夹缝设定为5 nm。建立荧光强度与蛋白质浓度之间的线性关系,其初始段斜率即为米糠蛋白的表面疏水值。
2 结果与讨论
2.1 溶解性
蛋白质的溶解性是蛋白质最主要功能特性,溶解性的表达在很大程度上影响着其他功能性质,另外,蛋白质的溶解性也会较为显著地影响蛋白质的商用及营养价值。
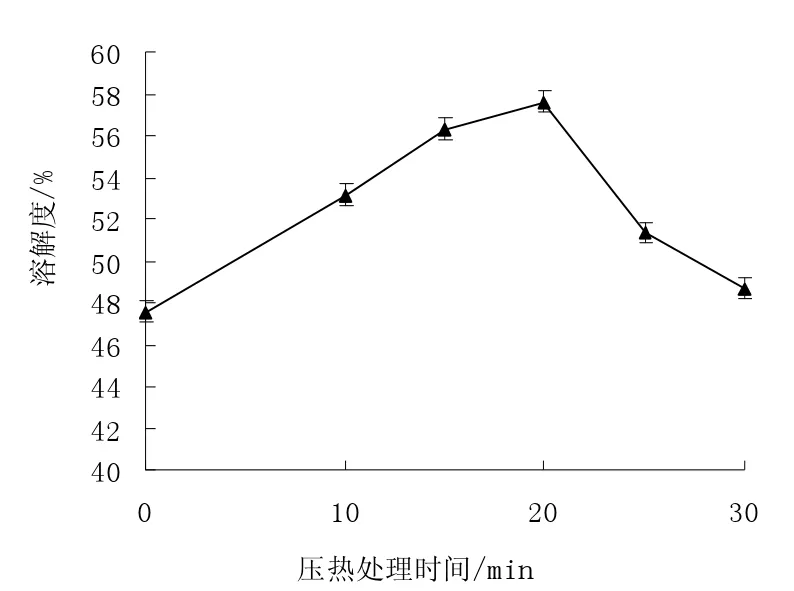
图1 压热处理对米糠蛋白溶解性的影响Fig.1 Effects of heating with high pressure to solubility of rice bran protein
由于米糠蛋白中二硫键含量较多且易于聚集形成聚集体,因而米糠蛋白在水溶液中的溶解性较差,溶解度仅为47.56%。由图1 可知,压热处理可以有效地提高米糠蛋白溶解性,压热处理米糠蛋白后,蛋白空间结构局部展开、分子柔性得以改善,促进了蛋白质的结构舒张与水合作用,使米糠蛋白的溶解性得到提高。随着压热处理时间的延长,米糠蛋白溶解性呈现先增大后降低的变化趋势,压热处理20 min 时,米糠蛋白溶解性最高,溶解度可达51.36%。对于米糠蛋白在长时压热处理后溶解性的降低主要与部分不溶性蛋白聚集体形成有关。
2.2 乳化性
乳化性是指互不相溶的液体在机械搅拌后形成乳液的能力。乳化性是蛋白质较为重要的表面性质之一,这主要是由于蛋白分子链内分布有较多的亲水或疏水基团,亲水性及疏水性基团的存在也决定了蛋白质的表面活性特点。米糠蛋白乳化性在食品加工过程中起到了重要的作用,因此,现今研究多围绕此功能性质展开。

图2 压热处理对米糠蛋白乳化性的影响Fig.2 Effects of heating with high pressure to emulsion of rice bran protein
由图2 可知,原始米糠蛋白的乳化性约为35.6 m2·g-1,压热处理有效地提高米糠蛋白乳化性,并且随着压热处理时间的增长呈先增大后降低的趋势,在20 min 压热处理后米糠蛋白的乳化性为48.3 m2·g-1,相比于原始米糠蛋白乳化性提高了近35.6%。这主要是由于压热处理后米糠蛋白发生局部变性,米糠蛋白分子刚性显著降低,米糠蛋白的分子形态逐渐由紧实球体转变为线性分子,促进了米糠蛋白的柔性增加,有利于米糠蛋白更为有序地排列于油—水界面;另外,米糠蛋白在压热处理后蛋白质内部包埋的疏水性残基逐渐暴露出来,并逐渐扩散于油—水界面,进而降低界面张力,促进了米糠蛋白乳化性的提升。但随着压热处理时间的延长,米糠蛋白变性程度增加,蛋白质聚集程度增大,维持米糠蛋白的内部结构力(包括氢键、范德华力、离子键等)逐渐被破坏,使油滴表面的保护层变薄,进而导致乳化性的降低[7],在30 min 压热处理下米糠蛋白的乳化性降低至42.6 m2·g-1,但仍较高于原始米糠蛋白。

图3 压热处理对米糠蛋白乳化稳定性的影响Fig.3 Effects of heating with high pressure to emulsion stablility of rice bran protein
通过图3 可知,原始米糠蛋白的乳液稳定时间约为10 min,而压热处理后米糠蛋白乳化稳定性有所降低,随着压热处理时间的增长,米糠蛋白乳化稳定性逐渐降低,压热处理25 min 后乳化液稳定时间仅为8.5 min。目前研究表明,蛋白质的乳化稳定性与乳滴粒径大小有关,可以推测,米糠蛋白的乳化稳定性的降低很可能是与米糠蛋白聚集造成的乳滴粒径增大有关[8]。
2.3 起泡性
为了测试米糠蛋白的起泡性,采用泡沫膨胀率为指标进行分析。压热处理对米糠蛋白起泡性的影响如图4 所示,由图可知未经任何处理条件下的米糠蛋白起泡性较差,这主要是由于米糠蛋白本身结构相对致密,其内部富含二硫键增加了蛋白结构的紧实性,以至于难以分散形成泡沫[9]。
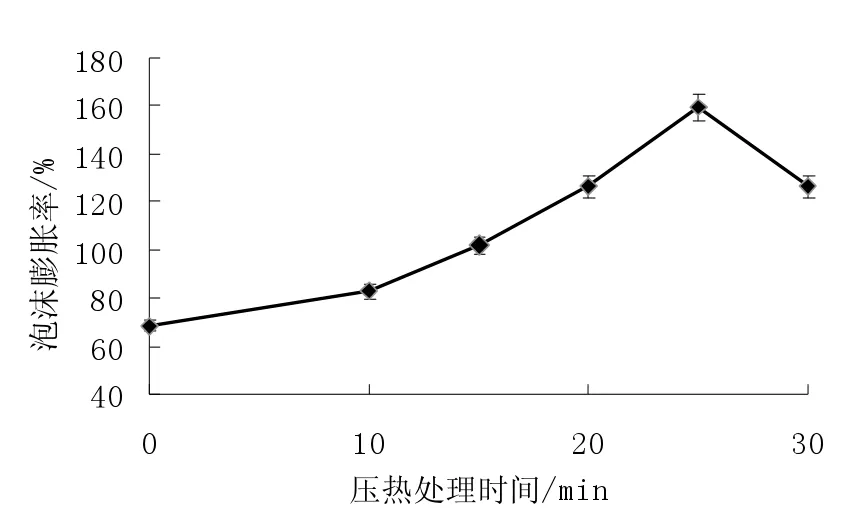
图4 压热处理对米糠蛋白起泡性的影响Fig.4 Effects of heating with high pressure to foam of rice bran protein
如图4 可知,未经处理的米糠蛋白泡沫膨胀率为68.3%,而压热处理后米糠蛋白的起泡性有所提高,并总体随时间的延长呈先增大后降低的变化趋势,在压热处理25 min 时起泡性最大,此时米糠蛋白的泡沫膨胀率为159.4%。短时压热处理起泡性提高的原因是:泡沫的形成需要蛋白质分子盘旋的肽链伸展开,通过各种相互作用在液体表面形成一层具有韧度的液膜。压热处理的热效应有助于蛋白质分子结构的展开,更多的疏水性基团暴露也促进了起泡性的提高,而长时压热处理后米糠蛋白的聚集收缩使其难于形成液膜,造成了米糠蛋白起泡性的降低[9],压热处理30 min 后米糠蛋白泡沫膨胀率仅为126.3%。

图5 压热处理对米糠蛋白起泡稳定性的影响Fig.5 Effects of heating with high pressure to foam stability of rice bran protein
通过图5 可知,压热处理不利于米糠蛋白的泡沫稳定性的维持,原始米糠蛋白的泡沫稳定性较强,为69.1%,而压热处理30 min 后米糠蛋白的泡沫稳定性仅为61.3%。其原因可能在于压热处理下米糠蛋白聚集体的形成使泡沫液膜变脆弱,液膜对泡沫的包裹效果减弱,进而降低了蛋白质的泡沫稳定性;另外,研究表明柔韧性与分子间附着力之间的平衡对于产生稳定的泡沫非常关键,由于压热处理造成了米糠蛋白变性,内部疏水性基团的暴露增加了蛋白质分子的电荷量,静电荷产生的静电作用会阻碍蛋白质分子吸附于泡沫表面,进而造成了泡沫稳定性的降低[10]。
2.4 表面疏水性
由图6 压热处理对米糠蛋白表面疏水性的影响可知,原始米糠蛋白表面疏水值为125.32,而压热处理后米糠蛋白的表面疏水性有所增大,在压热处理20 min 后表面疏水值可达197.65,相比于原始米糠蛋白提高了近57.71%,主要的原因是因为包埋于蛋白质分子内部的疏水性氨基酸趋于“暴露态”,使米糠蛋白表面疏水性增加。
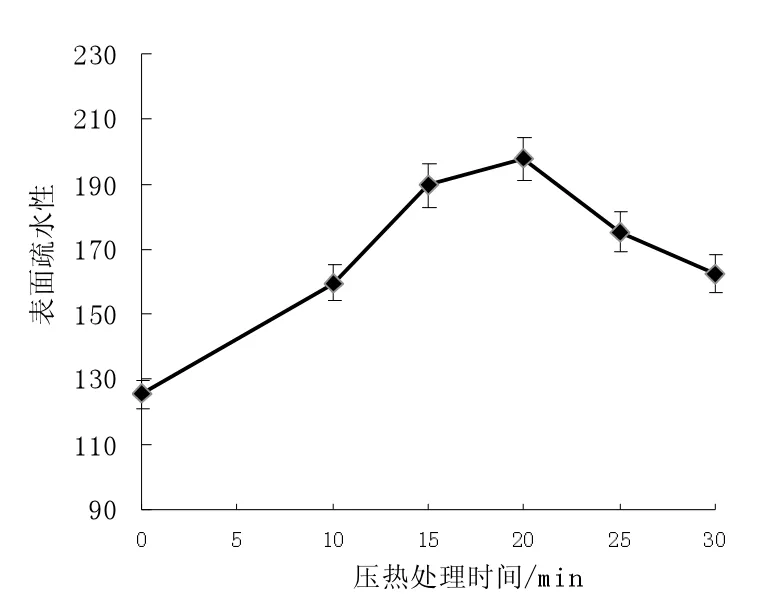
图6 压热处理对米糠蛋白表面疏水性的影响Fig.6 Effects of heating with high pressure to surface hydrophobicity of rice bran protein
另外米糠蛋白随着压热处理时间呈现先增大后降低的变化趋势,随着加热时间的延长,其疏水性又开始缓慢下降,在压热处理30 min 下为162.30,这很可能是亚基之间的聚合形成可溶或不可溶的聚集体导致[11]。米糠蛋白疏水性的变化趋势也进一步印证了关于米糠蛋白乳化性、起泡性的研究结论。
3 结论
(1)压热处理可有效地提高米糠蛋白溶解性,并随着压热处理时间的延长,米糠蛋白溶解性呈现先增大后降低的变化趋势,压热处理20 min 时,米糠蛋白溶解性最高,溶解度可达51.36%。米糠蛋白在长时压热处理后溶解性的降低主要与部分不溶性蛋白聚集体形成有关。
(2)原始米糠蛋白的乳化性约为35.6 m2·g-1,压热处理有效地提高米糠蛋白乳化性,并且随着压热处理时间的增长呈先增大后降低的趋势,在20 min压热处理后米糠蛋白的乳化性为48.3 m2·g-1。但长时压热处理下米糠蛋白的乳化性则降低至42.6 m2·g-1,但仍较高于原始米糠蛋白。压热处理后米糠蛋白乳化稳定性有所降低,随着压热处理时间的增长,米糠蛋白乳化稳定性逐渐降低。
(3)未经处理的米糠蛋白泡沫膨胀率为68.3%,而压热处理后米糠蛋白的起泡性有所提高,并总体随时间的延长呈先增大后降低的变化趋势,在压热处理25 min 时起泡性最大,此时米糠蛋白的泡沫膨胀率为159.4%。压热处理不利于米糠蛋白的泡沫稳定性的维持,原始米糠蛋白的泡沫稳定性为69.1%,而压热处理30 min 后米糠蛋白的泡沫稳定性仅为61.3%。
(4)原始米糠蛋白表面疏水值为125.32,而压热处理后米糠蛋白的表面疏水性有所增大,随着压热处理时间呈现先增大后降低的变化趋势,在压热处理20 min 后表面疏水值最高,可达197.65。
[1]张强,周正义,王松华.从米糠中制备抗氧化肽的研究[J].食品工业科技,2007,28(7):145-147.
[2]姚惠源,周素梅,王立.米糠与米糠蛋白质的开发利用[J].无锡轻工大学学报,2002,21(3):312-316.
[3]Connor M A,Saunders R M.Rice bran protein concentrates obtained by wet alkaline extraction[J].Cereal Chem,1976,53:488.
[4]顾华孝.米糠的食用性和在保健功能食品中的应用[J].粮食与饲料工业,2001(5):46-48.
[5]陈季旺,姚惠源,张小勇.米糠可溶性蛋白的提取工艺和特性研究[J].中国油脂,2003,28(2):46-50.
[6]李喆,翟爱华.米糠蛋白抗氧化肽的制备及初步分离[J].黑龙江八一农垦大学学报,2012,24(3):56-59.
[7]Gbogour,Linder,Fann.Influence of hydrolysis degree on the functional properties of salm on byproduct hydrolysates[J].Food Science,2004,69:615-622.
[8]Keshun L.大豆化学加工工艺与应用[M].江连洲,译.哈尔滨:黑龙江科学技术出版社,2005.
[9]Feng J,Xiong Y L.Interaction and functionality of mixed myofibrillar and enzyme-hydrolyzed soy proteins [J].J food sci,2003,68(3):803-809.
[10]Kinsella J E.Functional properties of proteins:possible relationships between structure and function in foams[J].Food Chemistry,1981,7:273-288.
[11]Sorgentini D A,Wagner J R,Anon M C.Effects of thermal treatment of soy protein isolate on the characteristics and structure-function relationship of soluble and insoluble fractions [J].J Agric Food Chem,1995,43(9):2471-2479.

