林生毛霉对孕甾烯醇酮的生物转化研究
宇川川,贾桂燕,李丽阳,阮洪生,赵竹青,崔玉,葛文中
(1.黑龙江八一农垦大学生命科学技术学院,大庆 163319;2.齐齐哈尔市梅里斯区第二中学)
甾体的微生物转化是一种有效且经济的能制备药用活性成分的重要方法。存在于中枢和外周神经系统的孕甾烯醇酮(Pregnenolone,PREG),对睡眠、细胞兴奋性毒性等产生作用,在体内可被代谢为20α-羟基化和7α-羟基化产物[1]。而7α-羟基孕甾烯醇酮能提高小鼠的免疫反应[2],具有抗糖皮质激素的功效[3],能提高空间记忆[4],并可作为神经元的激活剂去激发自主活动[5]。
研究表明,Fusarium oxysporum var.cubense[6],Exophiala jeanselmei var.lecanii-corni[7]等菌株使孕甾烯醇酮发生7α-羟基化反应,而孕甾烯醇酮分别被Mucor plumbeus[8]和 Mucor circi -nelloides var lusitanicus[9]转化为7α,11β-和7α,11α-二羟基化产物。葛文中[10,11]利用Mucor racemosus 对一系列3-羟基-5-烯甾体进行生物转化,研究发现该菌株的生物转化具有较强的规律性,都能专一性的发生7α 羟基化,C5-C6 双键的形成对羟基化位置的引入有重要影响,C16-C17 双键及16α,7α-环氧甾体发生16-甲氧基的新反应。
林生毛霉可以分泌蛋白酶,应用于腐乳的加工过程[12],鲍松林等[13]对生产绍兴腐乳的林生毛霉的蛋白酶进行系统检测研究。本研究利用M.silvaticus 对孕甾烯醇酮进行生物转化,采用IR、MS 和2D NMR等波谱方法对转化产物的结构进行鉴定,对13C 谱数据进行归属,并详细地解析了3β,7α,9α-三羟基-5-烯-20-酮,为系统分析甾体微生物转化和其他甾体衍生物结构鉴定提供参考。
1 材料与方法
1.1 材料
孕甾烯醇酮、林生毛霉(Mucor silvaticus AF 93204,购自中国典型培养物保藏中心);发酵培养液:1 000 mL 水、12 g 蛋白胨、30 g 葡萄糖、1 g 酵母膏、1.3 g KH2PO4,用浓盐酸调pH 为4.5;实验室所用各种试剂均为分析纯。
1.2 主要仪器
BIO-RAD 公司FTS-40 型红外光谱仪,Bruker-Esquire3000 离子阱液相色谱质谱仪,RE-52A 旋转蒸发器,Bruker AVANCE DPX-400 超导核磁共振仪(样品以DMSO-d6 为溶剂,TMS 为内标)。
1.3 实验方法
取林生毛霉斜面菌种1 支,接种于含120 mL 培养基的500 mL 锥形瓶内。在28 ℃,180 r·min-1条件下振荡培养2 d。将1.5 g 孕甾烯醇酮底物溶于30 mL 丙酮中,向每瓶菌液中加入2 mL 的底物溶液,继续发酵培养4 d。用纱布过滤发酵液,用乙酸乙酯分别萃取发酵液和菌丝体5 次,合并有机相。减压蒸去溶剂,40 ℃真空干燥的粗品。以乙酸乙酯/石油醚=3/2(v/v)为洗脱剂,硅胶柱层析对粗品进行分离。转化产物经IR、ESI-MS 和2D NMR 等波谱方法确定结构。
2 结果与讨论
用林生毛霉对孕甾烯醇酮转化时,得到了三个转化产物。经图谱分别鉴定为7α-羟基孕甾烯醇酮(2)、7α,11α-二羟基孕甾烯醇酮(3)和7α,9α-二羟基孕甾烯醇酮(4),结构式如下:
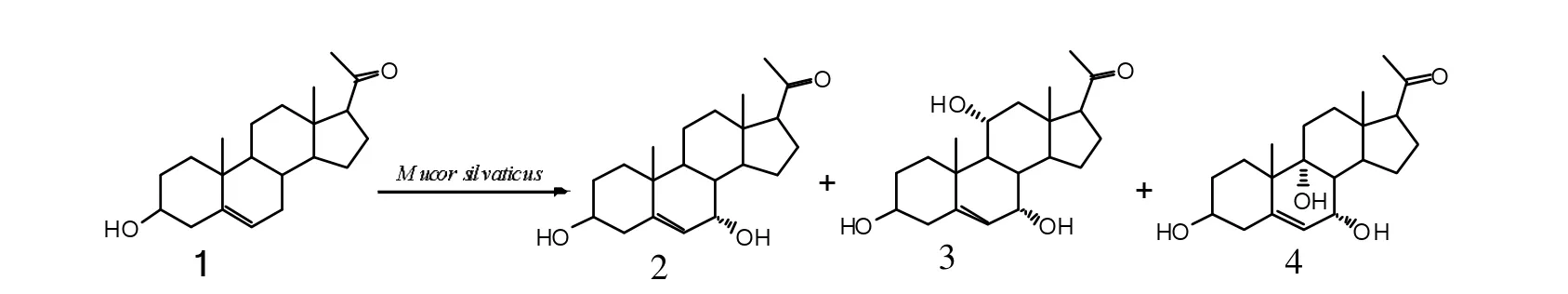
图1 孕甾烯醇酮的生物转化Fig.1 Biotransformation of pregenolone
孕甾烯醇酮1 转化产物经分离纯化后,得到化合物2、3 和4。化合物2 收率:6.4%,mp:183~184 ℃;IR(cm-1):3 420,2 935,1 698,1 661,1 458,1 433,1 358,1 229,1 186,1 054;MS m/z 355 [M+Na]+,371 [M+K]+。化合物3 收率:42.3%;mp:279~281 ℃;IR(cm-1):3 408,3 246,3 123,1 798,1 769,1 630,1 433,1 358,1 229,1 186,1 054;MS:m/z 371 [M+Na]+,387 [M+K]+。化合物4 收率:8.1%;mp:239~241 ℃;IR(cm-1):3 511,3 291,2 960,2 933,2 897,1 693,1 635,1 381,1 364,1 064,1 025,538;MS m/z 371[M+Na]+,387 [M+K]+。
根据1H NMR、13C NMR 和2D NMR 谱图,对化合物的13C NMR 谱数据进行了归属,数据见表1。
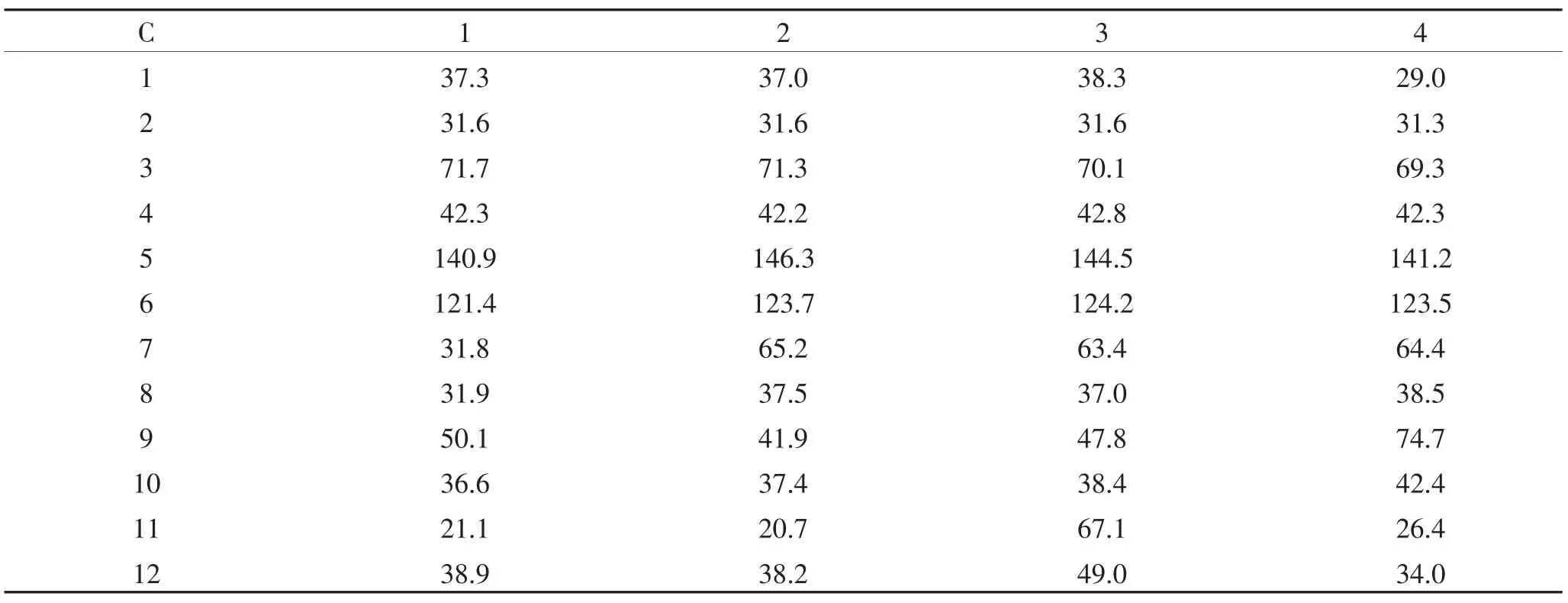
表1 化合物13C NMR 数据Table 1 13C NMR signals of compounds
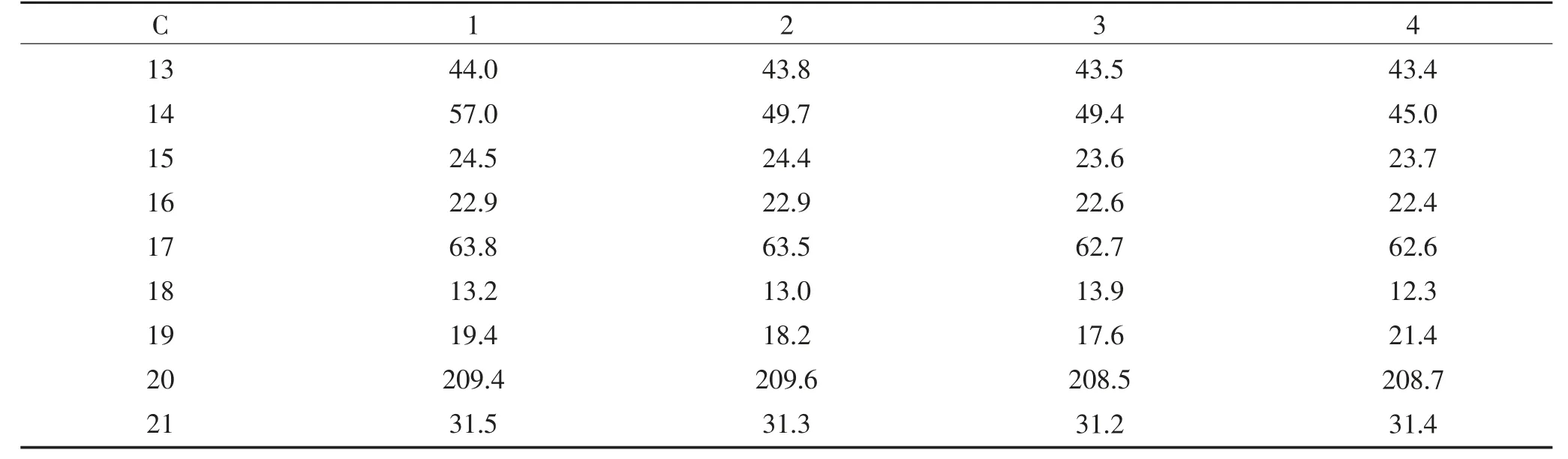
表1 化合物13C NMR 数据Continued table 1 13C NMR signals of compounds
根据红外、质谱、1H NMR、13C NMR、DEPT、HMBC、HSQC 和1H-1H COSY 谱图,对化合物4 进行完全解析[14]。
在化合物4 的红外中谱中,3 511 cm-1和3 291 cm-1两处有吸收峰,是羟基的H-O 伸缩振动。1 693 cm-1处的吸收峰,是羰基的C=O 伸缩振动。1635 cm-1处的吸收峰,是不饱双键的C=C 伸缩振动,说明A 环中3-羟基-5-烯的基本结构仍然存在。
在化合物4 的ESI-MS 谱中,MS m/z 371([M+Na]+),与底物妊娠烯醇酮的分子量相比增加了32 个质子单位,表明转化产物4 比底物增加了两个氧原子。
在化合物4 的13C NMR 谱中,存在δ 208.7 峰,为C-20 羰基。与底物相比,表明C-20 羰基未变。δ 141.2 和δ 123.5 的存在,表明保留了底物的5~6位双键。1H NMR 谱中,根据峰形和质子数目,可将低场的δ 5.47 直接归属为H-6,在HSQC 谱中与δ 5.47 相关联的δ 123.5 归属为C-6,则δ 141.2 归属为C-5。DEPT 谱(图5)显示,化合物4 有3 个甲基信号和7 个仲碳,6 个叔碳,5 个季碳,与底物谱图对比,少了一个叔碳信号,少了一个仲碳信号,多了一个季碳信号。
化合物4 的1H NMR 谱显示,3 个甲基信号分别位于δ 0.52、δ 0.98 和δ 2.08 处。在HMBC 谱中(图2)中,δ 0.98 处的甲基氢与δ 141.2(C-5)有相关联的交叉峰,而δ 2.08 与δ 208.7(C-20)有交叉峰,因此,δ 0.98,δ 2.08 处的氢分别归属为H-19 和H-21,甲基氢δ 0.52 归属为H-18。HMBC 谱中H-21(δ 2.08)、H-18(δ 0.52)分别与δ 62.6 处的峰有相关偶合,根据DEPT 碳类型,可将δ 62.6 归属为C-17。由HSQC谱中(图3),可将与δ 0.52(H-18)、δ 0.98(H19)和δ 2.08(H-21)相偶合的δ 12.3、δ 21.4 和δ 31.4 分别归属为C-18、C-19 和C-21。
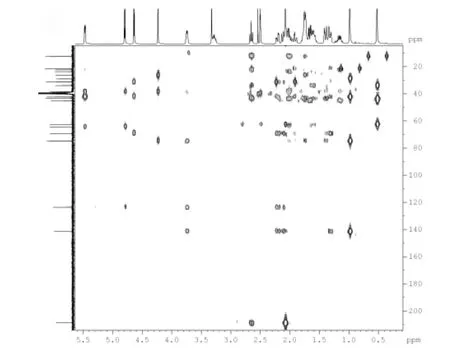
图2 化合物4 HMBC 谱图Fig.2 HMBC spectrum of compound 4
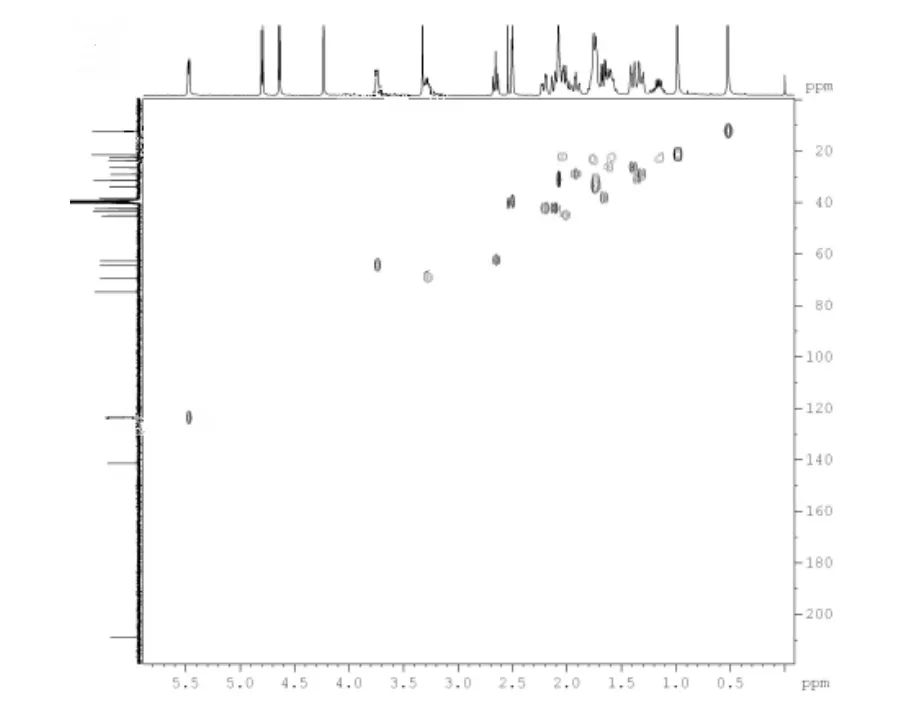
图3 化合物4 HSQC 谱图Fig.3 HSQC spectrum of compound 4
在化合物4 的HMBC 谱中,H-18 应与C-12,C-13,C-14 和C-17 有相关偶合。质子H-18(δ 0.52)与δ 34.0、δ 43.4、δ 45.0 和δ 62.6 有交叉峰。根据DEPT 中碳的类型,δ 34.0 为仲碳,δ 43.4 为季碳,δ 45.0 为叔碳,δ 62.6 为叔碳。因此,δ 34.0、δ 43.4、δ 45.0 分别归属为C-12、C-13,C-14 峰。
在HMBC 谱中,H-19 应与C-1,C-5,C-9 和C-10 有相关偶合。质子H-19(δ 0.98)与δ 29.0,δ 42.4,δ 74.7,和δ 141.2 有交叉峰,DEPT 谱中显示,δ 29.0 为仲碳,而δ 141.2、δ 64.7 和δ 42.4 处均为季碳,已推断δ 141.2 为C-5 峰,δ 29.0、δ 42.4 分别归属为C-1、C-10 的化学位移。δ 74.7 峰为C-9 化学位移,推测C-9 中有一羟基相连,表明C-9 发生羟基化。由HSQC 谱可知,与δ 29.0(C-1)相关的氢δ 1.92归属为H-1。
在化合物4 的1H-1H COSY(图4)谱中,δ 5.47处的H-6 与δ 3.74 处的氢有相关偶合,δ 3.74 可归属为H-7。由HSQC 谱中,δ 3.74(H-7)相关联的δ 64.4 峰为C-7 化学位移。根据C-7 的13C NMR 值,结合DEPT 谱中碳类型推测,C-7 发生羟基化。
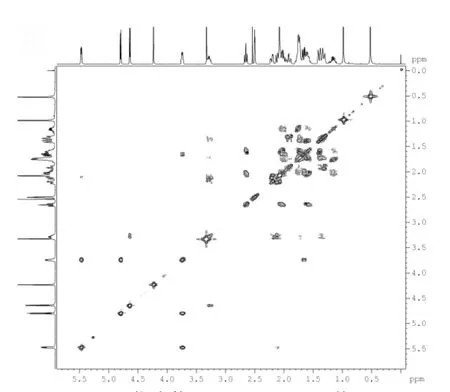
图4 化合物4 1H-1H COSY 谱图Fig.4 1H-1H COSY spectrum of compound 4
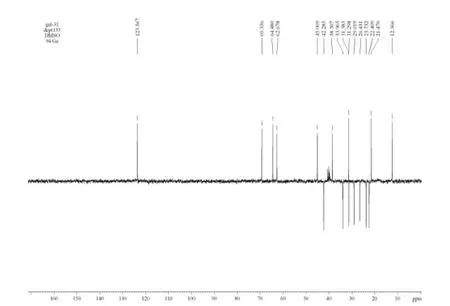
图5 化合物4 的DEPT 谱图Fig.5 DEPT spectrum of compound 4
在化合物4 的1H-1H COSY(图4)谱中,δ 1.92(H-1)与δ 1.34 有相关偶合,可归属δ 1.34 为H-2化学位移。在HSQC 谱中δ 1.34 对应的碳化学位移为δ 31.3,根据DEPT 谱中的碳类型,将δ 31.3 归属为C-2。1H-1H COSY 谱中,H-2(δ 1.34)不仅与δ 1.92(H-1)有相关偶合,而且与δ 3.32(H-3)有交叉峰,在HSQC 谱中与之相关联的碳化学位移为δ 69.3,即为C-3 信号峰。可将1H-1H COSY 谱中与δ 3.32(H-3)有偶合的另一质子δ 2.23 归属为H-4 化学位移,在HSQC 谱中与之对应的δ 42.3 归属为C-4 化学位移。
在1H-1H COSY 谱中,δ 3.74(H-7)与δ 1.68,δ 4.80 和δ 5.47(H-6)处有偶合。在HSQC 中δ 1.68对应的碳化学位移为δ 38.5,根据DEPT 谱中的碳类型,可将δ 38.5 归属为C-8。δ 4.80 在HSQC 中却没有相关联的碳化学位移,而在HMBC 谱中与C-7(δ 64.4)有相关偶合,δ 4.80 峰为C-7 羟基中的氢。确定C-7 发生羟基化。
在化合物4 的HSQC 谱中,C-17(δ 62.6)相关联的H-17 化学位移对应为δ 2.65,在1H-1H COSY 谱中与δ 1.59 偶合,通过DEPT 和HSQC 归属δ 22.4为C-16 化学位移,由1H-1H COSY 及DEPT 中碳的类型推断δ 23.7 为C-15 的化学位移。最后一个仲碳δ 26.4 直接归属为C-11。在HMBC 谱中,质子δ 4.23与δ 74.4(C-9)和δ 26.4(C-11)有交叉峰,而在HSQC 中却没有相关联的碳化学位移,因此,推断C-9 羟基化。
生物转化结果表明,孕甾烯醇酮主要发生了7α-羟基化,并伴有C-9α 和C-11α 羟基化,其中主要转化产物为7α,11α-二羟基孕甾烯醇酮。3β-羟基-5-烯-甾体的微生物转化中发生9α-羟基化的报道较少,Rhodococcus sp.对16α,17α-环氧妊娠烯醇酮具有较强的9α-羟基化位置选择性[15],Circinella sp.转化多个3β-羟基-5-烯-甾体主要得到9α-羟基衍生物,9α-羟基化也是微生物降解甾体母核的关键反应[16]。
3 结论
利用林生毛霉转化孕甾烯醇酮得到了7α-羟基孕甾烯醇酮、7α,11α-二羟基孕甾烯醇酮和7α,9α-二羟基孕甾烯醇酮三种产物,其中7α,11α-二羟基孕甾烯醇酮的收率最大。通过DEPT 和1H-1HCOSY,HSQC,HMBC 等2D NMR 技术对产物13C NMR 数据进行了全归属,利用IR、ESI-MS 和2D NMR 等波谱方法对7α,11α-二羟基孕甾烯醇酮的结构进行了详细的解析。
[1]Plassart S E,Baulieu E E.Neurosteroids:recent findings[J].Brain Research Reviews,2001,37(1-3):133-140.
[2]Morfin R,Lafaye P,Cotillon A C,et al.7α-Hydroxydehydroepiandrosterone and immune response[J].Annals of the New York Academy of Sciences,2000,917:971-982.
[3]Morfin R.7-Hydroxylated metabolites of circulating 3βhydroxysteroids are native anti-glucocorticoids[J].Expert Opinion on Therapeutic Targets,1997,1(1):245-248.
[4]Yau J L,Noble J,Graham M,et al.Central administration of a Cytochrome P450 -7B product 7α -hydroxypregnenolone improves spatial memory retention in cognitively impaired aged rats[J].Neuroscience,2006,26(43):11034-11040.
[5]Matsunaga M, Ukena K,Baulieu E, et al.7α -Hydroxypregnenolone acts as a neuronal activator to stimulate locomotor activity of breeding newts by means of the dopaminergic system[J].Natl.Acad.Sci.,2004,101(49):17282-17287.
[6]Wilson M R,Gallimore W A,Reese P B.Steroid transformations with Fusarium oxysporum var.cubense and Colletotrichum musae[J].Steroids,1999,64:834 -843.
[7]Peart P C,McCook K P,Russell F A,et al.Hydroxylation of steroids by Fusarium oxysporum,Exophiala jeanselmei and Ceratocystis paradoxa[J].Steroids,2011,76:1317 -1330.
[8]Lamm A S,Chen A R,Reynolds W F,et al.Steroid hydroxylation by Whetzelinia sclerotiorum,Phanerochaete chrysosporium and Mucor plumbeus [J].Steroids,2007,72:713-722.
[9]Shan L H,Liu H M,Huang K X,et al.Synthesis of 3β,7α,11α-trihydroxy-pregn-21-benzylidene-5-en-20-one derivatives and their cytotoxic activities[J].Bioorganic &Medicinal Chemistry Letters,2009,19:6637-6639.
[10]Ge W Z,Li N,Shan L H,et al.Microbial transformation of 4-ene-3-one steroids by Mucor racemosus[J].Acta Microbiologica Sinica,2007,47(3):540-543.
[11]Ge W Z,Wang S M,Shan L H,et al.Transformation of 3β-hydroxy-5-en -steroids by Mucor racemosus[J].Journal of Molecular Catalysis B:Enzymatic,2008,55(1-2):37-42.
[12]沈德中.海外腐乳的生产和研究[J].中国调味品,1989(7):1-4.
[13]鲍松林,丁霄霖.绍兴腐乳毛坯中蛋白酶的检测[J].无锡轻工业学院学报,1994,13(4):280-284.
[14]刘永刚,葛文中.去氢表雄酮生物转化及产物的波谱学结构表征[J].黑龙江八一农垦大学学报,2010,22(1):100-103.
[15]Angelova B,Mutafov S,Avramova T L.Stefanova effect of nitrogen source in cultivation medium on the 9α -hydroxylation of pregnane steroids by resting Rhodococcus.sp.cells[J].Biotechnol and Biotechnol.,2005,19(3):113-116.
[16]Lugauskas A,Repeckiene J,Novosinskas A.Micromycetes producers of toxins,detected on stored vegetables[J].Ann Agric Environ Med,2005,12:253-260.

