基于气相色谱-质谱技术对用咪康唑处理的白念珠菌的代谢组学研究
杨 宇,王 慧,曹颖瑛,朱臻宇(第二军医大学药学院,.药物分析学教研室;.新药研究中心,上海 200433)
随着免疫功能低下患者的增加、器官移植等医疗技术的发展以及免疫抑制剂的使用,真菌感染率居高不下,其中白念珠菌成为真菌感染的主要病原菌[1]。
咪康唑因生物利用度好和不良反应少成为防治真菌感染的一线药物。研究表明,咪康唑可通过影响过氧化物酶和线粒体而发挥抗真菌活性[2]。同时,咪康唑可增加活性氧使细胞死亡[3]。然而,目前咪康唑的作用机制尚不明确,因此研究其作用机制显得尤为重要。
在生命系统中,代谢组能将基因组、转录组和蛋白组的微小变化放大。因此,代谢组学能更直接地反应生物体的功能变化。
笔者基于气相色谱-质谱(GC-MS)代谢组学技术,研究咪康唑给药前后白念珠菌的代谢特征谱,结合药物作用机制,探讨代谢物产生差异的原因,为阐明药物作用机制提供参考。
1 仪器与试药
1.1 仪器 Thermo Trace Ultra/DSQⅡGC-MS(美国赛默飞公司);微型漩涡混合仪(美国赛默飞公司);-80℃低温冰箱(美国赛默飞公司);冻干机(美国Virtis公司);MJx型智能霉菌培养箱(宁波江南仪器厂)。
1.2 试剂 甲氧基胺盐酸盐、N-甲基-N-(三甲基硅烷)三氟乙酰胺(MSTFA)、吡啶、三甲基氯硅烷(TMCS)、咪康唑均购自Sigma公司;正庚烷(上海晶纯实业公司)。
1.3 菌株和培养基 白念珠菌SC5314;YPD培养液:酵母浸膏10g,蛋白胨20g,葡萄糖20g,溶解于1 000ml三蒸水,高压灭菌(121 ℃,15min),4 ℃保存。
2 方法
2.1 真菌培养
2.1.1 咪康唑半数抑菌浓度(IC50)的确定 挑取白念珠菌单克隆,接种至1ml YPD培养液,于30℃,200r/min培养至指数生长后期,于紫外分光光度计600nm[4]下测菌液光密度(D)值,用 YPD培养液调整菌液浓度至D值为0.1,取20ml加入各锥形瓶中培养,至D值为0.2时,给药组中加入咪康唑,使其终浓度分别为0.5、1、2、4、8、16、32、64μg/ml,继续培养(对照组中加入相同体积的二甲基亚砜,其浓度应小于0.05%,以确保不影响白念珠菌的生长),分别在3、4、5、6h测定各组的D值。与对照组的D值相比,选择继续培养4h,其中咪康唑的IC50为16μg/ml。
2.1.2 培养条件 按照IC50的测定方法和给药浓度,培养给药组和对照组各6份。
2.2 样品前处理
2.2.1 样品淬灭 向样品中加入等体积的60%甲醇(预冷至-20 ℃),迅速摇匀,静置5min(-40℃),6 000r/min离心。
2.2.2 样品提取 样品用超纯水迅速清洗后,重悬于1ml沸水(含10μl 200mmol/L的α-氨基丁酸内标)[4],静置15min,放入 -80 ℃ 冰箱冰 冻15min,取出,60℃水浴溶解15min,再重复冻融操作2次,13 200r/min离心,取上清液,放置在-20℃冰箱预冻。后置于冻干机中冻干,获得冻干粉。
2.2.3 衍生化 向冻干粉中加入75μl甲氧基胺盐酸盐/吡啶溶液,40℃温孵90min,再加入75μl MSTFA 溶液 (1%TMCS),40 ℃ 温孵 50min,13 200r/min离心,取上清液,装入进样小瓶。
2.2.4 菌体干重的测定 将样品沉淀在室温下风干至恒重,称样品干重,至少称量3次以确保样品完全干燥。
2.3 GC-MS条件 毛细管柱:HP-5MS石英毛细管柱(30m×0.25mm,0.25μm);进样口温度:260℃;升温程序:起始温度为70℃,保持3min,4℃/min升至220℃,再8℃/min升至310℃,保持10min,图谱从第7.6分钟开始采集;载气:高纯氮气;流速:1.0ml/min。进样量为1μl。
电子轰击源(EI);离子源温度:200℃;接口温度:280℃;电子能量:70eV;调谐方式:标准调谐;质谱扫描方式:扫描范围15~800amu,扫描速度5s/dec。
2.4 数据处理 将原始数据(.RAW)经Xculibur数据处理系统转化成CDF格式,利用XCMS软件对数据峰校正和峰积分,并采用 MATLAB 7.0(The MathWorks,Inc.,USA)过滤离子峰,留下相同保留时间下峰度最大的离子峰。为校正质谱响应,每个样品的各个峰面积先除以各自的细胞干重,再除以内标衍生化后峰度最大的离子峰。利用SIMCA-P V 11.0(Umetrics,Sweden)软件将数据中心化和帕累托变换,标准化后进行主成分分析(PCA)和偏最小二乘法(PLS-DA)分析,根据variable influence in the projection(VIP)值来预测代谢物对模型的贡献程度。VIP>1的数据对模型有明显贡献。接着对数据进行独立样本t检验,保留P<0.01的数据。将数据与NIST数据库匹配,并用标准品定位,得到潜在的生物标志物。
3 结果
3.1 GC-MS色谱图 给药组和对照组白念珠菌的胞内代谢物,经提取,衍生化后进样分析,其GC-MS色谱图,如图1所示。
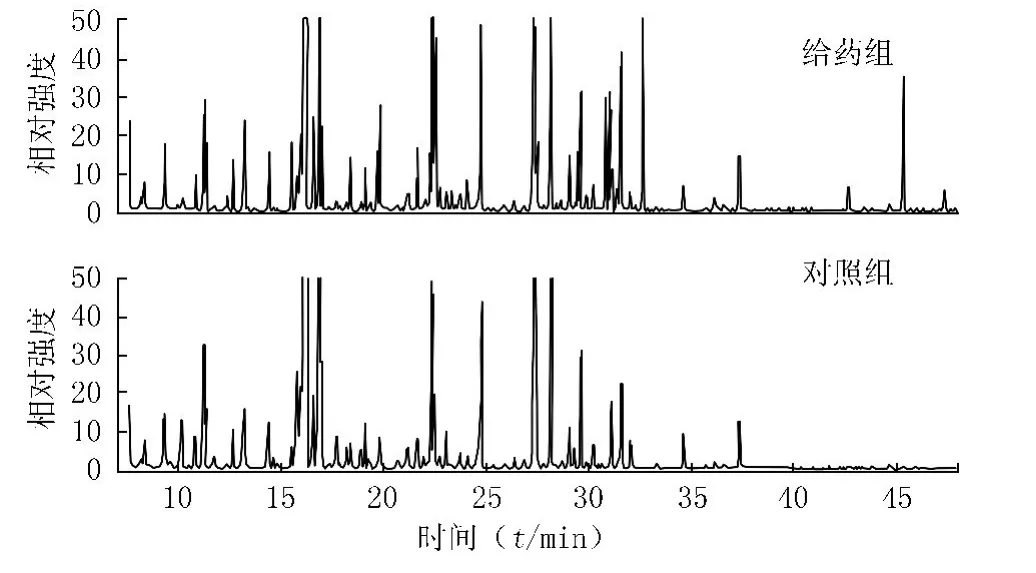
图1 给药组和对照组的GC-MS色谱图
3.2 PCA与PLS-DA结果 数据校正后,对给药组和对照组进行PCA和PLS-DA分析,如图2A和2B所示,结果表明两组明显分开。其载荷图和S-plot图,如图2C和2D所示。载荷图用于潜在生物标志物的筛选,根据载荷图所示,离原点越远的离子对分类贡献越大。得到23个潜在的生物标志物,给药组和对照组代谢物含量变化见图3。
4 讨论
根据给药组和对照组的差异代谢物实验结果,分别讨论如下:
4.1 葡萄糖 给药组与对照组相比,葡萄糖含量显著升高。研究表明咪康唑通过影响线粒体ATP酶和钾离子泵而发挥抗真菌活性[5],其中钾离子泵是主动运输,消耗能量,而葡萄糖可产生能量。因此,葡萄糖含量的升高可能与咪康唑作用钾离子通道有关。
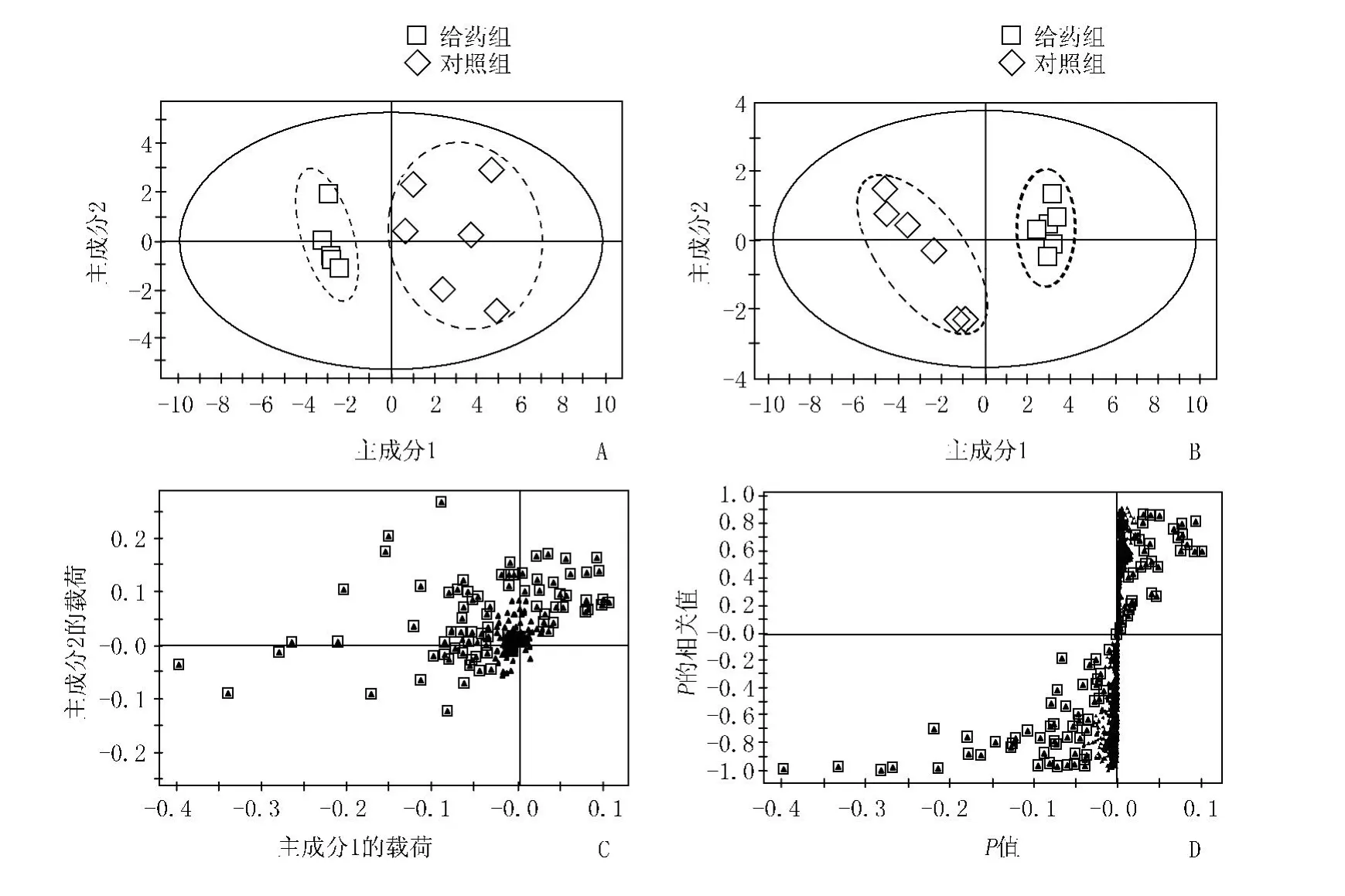
图2 给药组和对照组的主成分分析图(A)、偏最小二乘法得分图(B)、载荷图(C)和S-plot图(D)
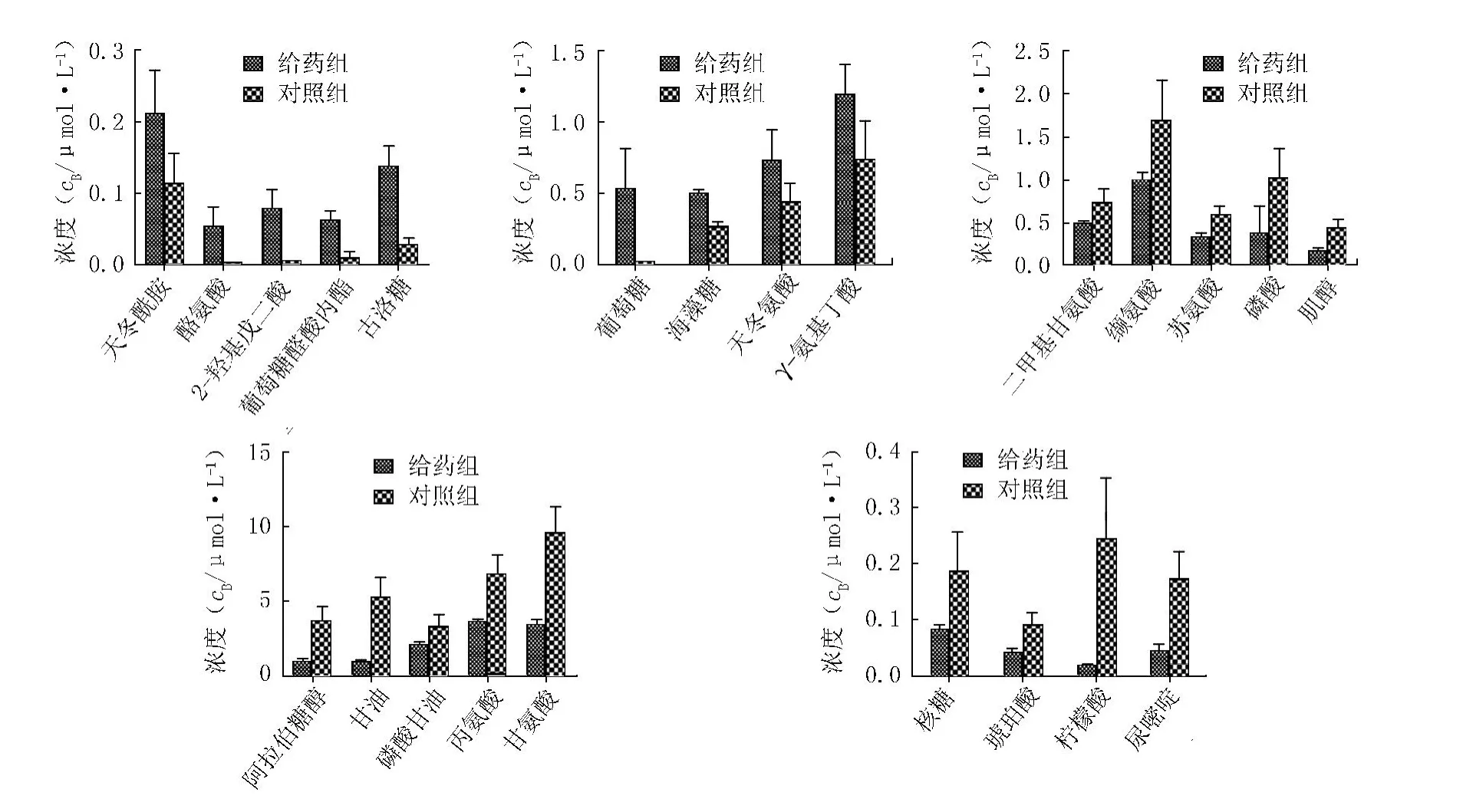
图3 给药组和对照组的差异代谢物柱状图
4.2 海藻糖 白念珠菌受到外界刺激时会采取保护性防御机制,其中氧化应激刺激细胞内非还原性二糖海藻糖明显增加[6]。在本实验中,咪康唑可能是一种氧化应激,给药后使细胞内海藻糖大量积累,从而起到抗氧化的作用。
4.3 三羧酸循环相关代谢物 三羧酸循环不仅是需氧生物体重要的代谢途径,还是糖类、脂质和氨基酸代谢联系的枢纽。酸刺激下,胞外谷氨酸通过反向转运体(GadT)转移至胞内,在谷氨酸脱羧酶的作用下生成γ-氨基丁酸(GABA),该反应消耗氢离子,使胞内pH值升高。进而GABA通过GABA支路在GABA/α-酮戊二酸氨基转移酶的作用下脱氨基形成琥珀酸半醛(SSA),SSA在琥珀酸半醛脱羧酶的作用下生成琥珀酸,进而影响三羧酸循环[7],同时GABA支路可降低细胞内活性氧[8]。这与前期的研究结果相符[9]。由此可知,三羧酸循环中琥珀酸和柠檬酸含量的降低可能与咪康唑影响GABA支路有关。
4.4 2-羟基戊二酸(2-HG) 研究表明,2-HG脱氢酶活性降低导致2-HG大量积累,而2-HG脱氢酶可降低DNA和组蛋白的甲基化,从而抑制正常细胞向癌细胞转化[10]。因此,咪康唑给药组2-HG的大量积累可能与2-HG脱氢酶活性降低有关,从而促进正常细胞向癌细胞转化。
4.5 氨基酸类 天冬酰胺、天冬氨酸、酪氨酸在给药组中含量升高。其中,酪氨酸磷酸化参与细胞信息传递,因此酪氨酸的增加可能与细胞信息传递有关。天冬氨酸和天冬酰胺可合成多种氨基酸。有研究表明,苏氨酸生物合成中间体β-天冬氨酸半醛(ASA)的积累对细胞有一定的损伤作用,同时可加速Gcn4的降解,Gcn4可调控多种氨基酸和维生素的生物合成[11]。因此丙氨酸、二甲基甘氨酸、缬氨酸、苏氨酸和甘氨酸含量的降低与咪康唑促使ASA积累有关。
4.6 磷酸、磷酸甘油、甘油类 磷脂是细胞膜的重要组成部分。Pasrija等[12]报道药物外转运蛋白倾向定位于细胞膜。因此,咪康唑可能通过影响细胞膜而导致药物外转运蛋白的活性降低,使细胞内的药物积累而发挥治疗作用。
本实验基于GC-MS的代谢组学方法对咪康唑给药前后白念珠菌的代谢物进行研究,经比较分析,得到23个潜在的生物标志物,它们主要参与了氨基酸代谢、三羧酸循环、氧化应激、糖酵解和磷脂代谢等相关通路,对咪康唑抗真菌作用机制的阐明具有重要意义。
[1]Kriengkauykiat J,Ito JI,Dadwal SS.Epidemiology and treatment approaches in management of invasive fungal infections[J].Clin Epidemiol,2011,3:175-191.
[2]Vandenbosch D,De Canck E,Dhondt I,et al.Genomewide screening for genes involved in biofilm formation and micon-azole susceptibility in Saccharomyces cerevisiae[J].FEMS Yeast Res,2013,13(8):720-730.
[3]Zhu CX,Yan L,Wang XJ,et al.Transposition of the Zorro2retrotransposon is activated by miconazole in Candida albicans[J].Biol Pharm Bull,2014,37(1):37-43.
[4]吴海棠,李 祥,王添琦,等.黄芩素作用白假丝酵母菌的GCMS代谢组学研究[J].第二军医大学学报,2013,34(2):184-189.
[5]Calahorra M,Lozano C,Sanchez NS,et al.Ketoconazole and miconazole alter potassium homeostasis in Saccharomyces cerevisiae[J].Biochim Biophys Acta,2011,1808(1):433-445.
[6]Sanchez-Fresneda R,Guirao-Abad JP,Arguelles A,et al.Specific stress-induced storage of trehalose,glycerol and D-arabitol in response to oxidative and osmotic stress in Candida albicans[J].Biochem Biophys Res Commun,2013,430(4):1334-1339.
[7]Feehily C,O'Byrne CP,Karatzas KA.Functionalγ-Aminobutyrate Shunt in Listeria monocytogenes:role in acid tolerance and succinate biosynthesis[J].Appl Environ Microbiol,2013,79(1):74-80.
[8]Cao J,Barbosa JM,Singh NK,et al.GABA shunt mediates thermotolerance in Saccharomyces cerevisiae by reducing reactive oxygen production[J].Yeast,2013,30(4):129-144.
[9]Kobayashi D,Kondo K,Uehara N,et al.Endogenous reactive oxygen species is an important mediator of miconazole antifungal effect[J].Antimicrob Agents Chemother,2002,46(10):3113-3117.
[10]Shim EH,Livi CB,Rakheja D,et al.L-2-hydroxyglutarate:an epigenetic modifier and putative oncometabolite in renal cancer[J].Cancer Discov,2014,4(11):1290-1298.
[11]Rawal Y,Qiu H,Hinnebusch AG.Accumulation of a threonine biosynthetic intermediate attenuates general amino acid control by accelerating degradation of Gcn4via Pho85and Cdk8[J].PLoS Genet,2014,10(7):e1004534.
[12]Pasrija R,Panwar SL,Prasad R.Multidrug transporters CaCdr1p and CaMdr1p of Candida albicans display different lipid specificities:both ergosterol and sphingolipids are essential for targeting of CaCdr1p to membrane rafts[J].Antimicrob Agents Chemother,2008,52(2):694-704.

