二氧化锰改性活性炭吸附汞的机理研究
高正阳,吕少昆
(华北电力大学能源动力与机械工程学院,河北保定071003)
汞是煤燃烧过程中释放的最易挥发的重金属污染物[1],其主要排放源是煤燃烧,相关研究显示煤燃烧所释放的汞占全部人为汞排放量的30%以上[2].痕量元素汞作为一种有着极强的累积性和不可逆性的神经毒物,极大地危害着人类健康[3],其剧毒性、高挥发性、可在生物体内沉积及长时间存在等特点,引起了世界各国越来越多的关注[4-5].美国国家环境保护局于2005年3月15日颁发了汞的排放标准[6],美国是第一个规定燃煤电厂汞排放限制标准的国家,这一重要举措在控制汞污染排放上具有里程碑的意义.随着中国环境污染问题的日益突出,我国于2012年1月1日制订了GB 13223—2011《火电厂大气污染物排放标准》,并对汞及其化合物质量浓度限值作出规定,为0.03mg/m3,这对我国燃煤电厂控制汞排放提出了更高的要求.
煤燃烧产生烟气中的汞主要有3种形态:气态单质汞(Hg0)、气态氧化汞(Hg2+)和颗粒汞(HgP)[7].燃煤电厂现有污染物控制设备可轻易脱除Hg2+与Hgp[8],但由于Hg0难溶于水、易挥发,所以难以被脱除,并且Hg0随烟气排放到大气环境中,会对环境造成严重污染[7].目前,在烟气通过颗粒控制装置之前喷入汞吸附剂能较为有效地脱除Hg0[9].汞吸附剂目前主要以碳基类吸附剂为主,如活性炭和飞灰未燃尽碳等[10],但单纯的碳基类吸附剂不能高效地吸附Hg0.通过对活性炭进行化学改性处理,改变其表面结构和活性位分布,发现其吸附Hg0的能力明显提高,并且活性炭的消耗量显著减少,从而降低了成本.如高洪亮等[11]的实验研究表明,经过MnO2浸渍和FeCl3浸渍改性后的活性炭对Hg0的吸附能力显著增强,但是其机理尚不明确.了解改性活性炭吸附Hg0的反应机理,对控制燃煤电厂汞排放具有指导意义.
利用量子化学从头计算方法可以对分子构型进行几何优化和计算,得到热力学参数和动力学参数,从而对Hg0吸附过程的反应机理有一个全面而准确的把握[12].因此,对于研究MnO2改性活性炭吸附Hg0反应机理,量子化学是一种有效的研究手段.笔者应用量子化学从头计算经典理论,研究了经MnO2改性后的活性炭吸附汞的微观机理,确定了反应过程中产生的中间体和过渡态的几何构型,并进行频率分析和能量计算,从而得到反应相关的动力学参数,基本确定微观反应的顺序.
1 计算方法
1.1 理论方法和反应机理
采用量子化学从头计算的MP2方法对反应进行计算.金属元素Hg含有80个电子,为使其具有适合的范围和精度,对Hg采用SDD 基组;Mn、O、C、H 等元素处于多电荷体系,单纯的标准基组计算精度不能满足要求,添加弥散函数来增加价轨道在空间分布的范围,采用6-311++g(d,p)基组.此外,在指定的基组水平上应用QCISD(T)方法计算得到反应中物质的能量,所用程序为Gaussian09[13].
基于反应物的不同,所研究反应过程共有3个:
(1)反应I,活性炭吸附单质汞:

(2)反应II,活性炭吸附MnO2:
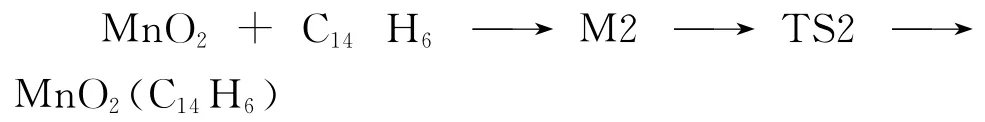
(3)反应III,经MnO2改性后的活性炭吸附单质汞:
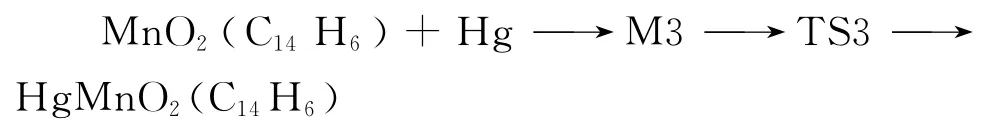
首先应用量子化学从头计算的MP2方法,计算了MnO2改性活性炭吸附Hg0反应过程中的反应物、中间体、过渡态和产物的几何构型.在计算得到的相关几何参数基础上,进行热能和零点能校正,从而得到反应活化能.此外,采用经典过渡态理论计算了在298~1 500K 温度范围内和0.000 1~3 MPa压力范围内各反应的指前因子、活化能等动力学参数,比较分析不同温度和压力下各反应速率的变化趋势.
1.2 动力学参数计算方法
采用经典过渡态理论计算公式计算反应速率常数k:
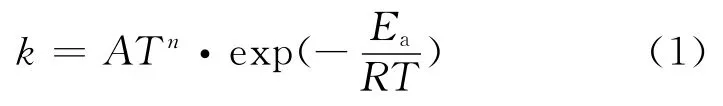
式中:A为指前因子,cm3/(mol·s);n为温度指数;Ea为活化能,kJ/mol;R为摩尔气体常数,J/(mol·K);T为热力学温度,K.
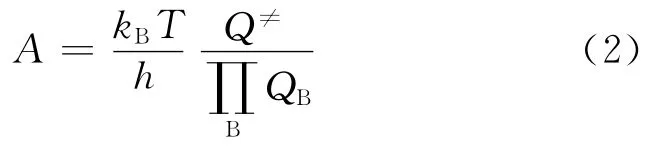
式中:kB为玻耳兹曼常数,J/K;h为普朗克常数;Q≠为过渡态的配分函数;表示所有反应物B的配分函数QB的乘积.
2 结果与分析
2.1 反应过程分析
采用从头计算的MP2方法,先改变指定键长,再进行势能面扫描,并以势能面上的鞍点为初始构型在6-311+g(d,p)/SDD 基组水平上进行几何构型优化,得到反应的微观过程,如图1~图3所示.
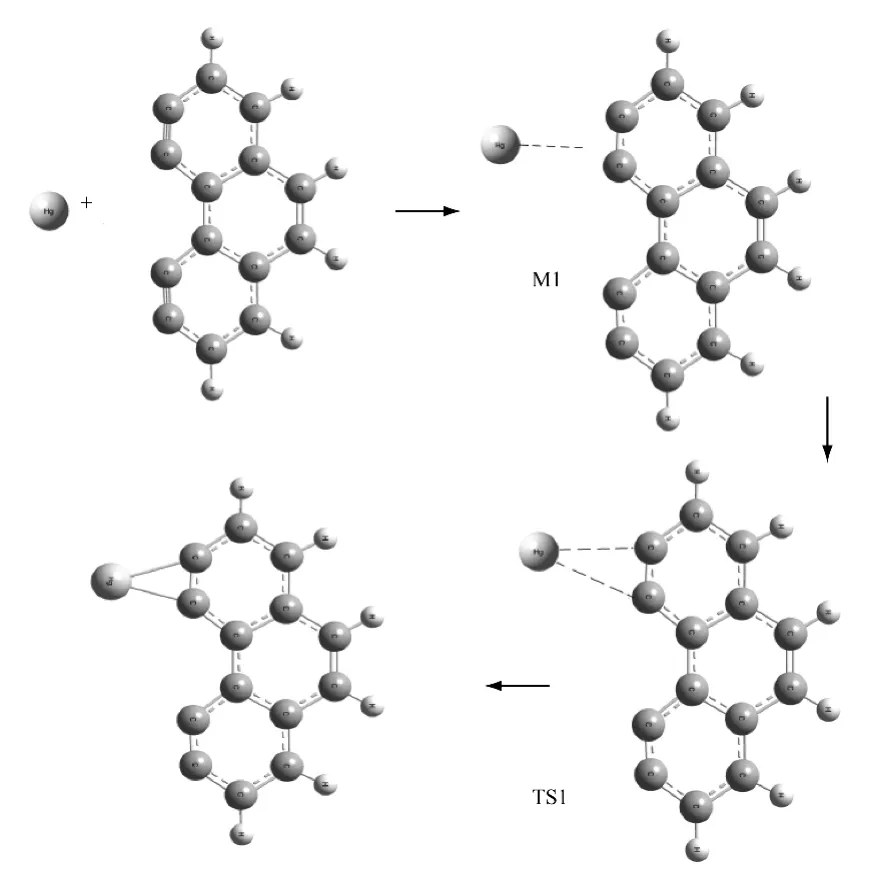
图1 活性炭吸附Hg0 的过程Fig.1 Reaction process of Hg adsorption by activated carbons
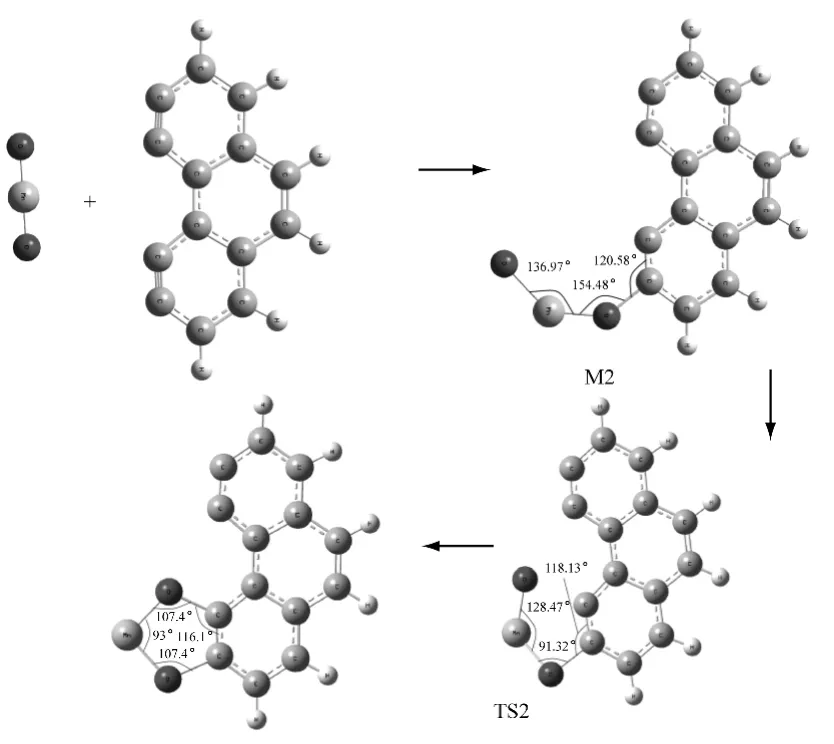
图2 活性炭吸附MnO2 的过程Fig.2 Reaction process of MnO2adsorption by activated carbons
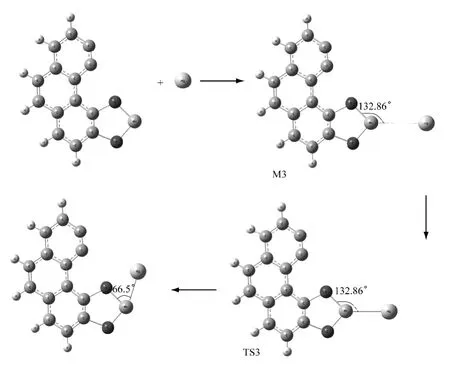
图3 经MnO2 改性后的活性炭吸附Hg0 的过程Fig.3 Reaction process of Hg adsorption by MnO2-modified activated carbons
活性炭吸附单质汞的过程为反应I,即碳环的活性位上C和Hg结合,并且在反应过程中存在中间体和过渡态.在吸附过程中,Hg—C 键的距离逐渐减小(∞→0.276 43 nm →0.226 00 nm →0.226 47nm,其中∞表示键的距离超过了成键范围),反映了Hg—C 键的形成过程.过渡态频率为-38.6cm-1、44.2 cm-1、52.6 cm-1和398.5 cm-1,有且仅有一个虚频.在虚频振动模式下,Hg原子沿反应坐标向C 原子方向有明显的振动,有利于反应的发生,由此说明过渡态一定存在,所研究的机理是可信的.
活性炭吸附MnO2的过程为反应II,即O 原子和C 原子先结合生成稳定的中间体M2,然后M2经过渡态TS2 生成产物MnO2(C14H6).在结合过程中,O—C 键的距离先减小后增大(∞→0.139 15nm→0.136 53nm→0.138 102nm),反映了O—C键的形成过程.中间体的振动频率都为正,并且是势能面上的稳定点,过渡态有且仅有一个虚频,为-67.3cm-1.在虚频振动模式下,C 原子和O原子沿反应坐标有明显的振动,有利于反应的发生,这表明过渡态是合理的.
经MnO2改性后的活性炭吸附单质汞的过程为反应III.Hg 和Mn 先反应生成稳定的中间体M3,后转变为存在时间极短的过渡态TS3,最后形成产物HgMnO2(C14H6).在反应过程中,从中间体到产物,Hg—Mn 键的距离逐渐缩短.中间体的振动频率全为正,为势能面上的稳定点,过渡态有且仅有一个虚频,为-32.8cm-1,并且其对应的振动模式表明,反应是Hg向Mn靠近,这有利于反应的发生,过渡态是可信的.
2.2 反应过程中的能量
表1列出了T=298K 时,用从头计算的MP2方法和组态互相作用(QCISD)的方法计算得到的反应物、过渡态和中间体的能量值,并进行了零点能校正.ZPE为零点能校正因子,Erel为反应物、过渡态和产物能量的相对值.
由过渡态理论可知,活化能为过渡态的能量与稳定反应物(或中间体)能量的差值.由表1可知,反应I~反应III的活化能分别为321.58kJ/mol、180.89kJ/mol和257.97kJ/mol.其中,反应II的活化能最低,说明与其他2种反应相比,反应II更容易发生.
2.3 反应动力学参数
在以上计算的基础上,分别计算温度为298K、500K、800K、1 000K、1 200K和1 500K下各稳定点的指前因子和活化能.并利用式(1)和式(2)计算得到不同温度下各反应的反应速率常数,结果见表2~表4.
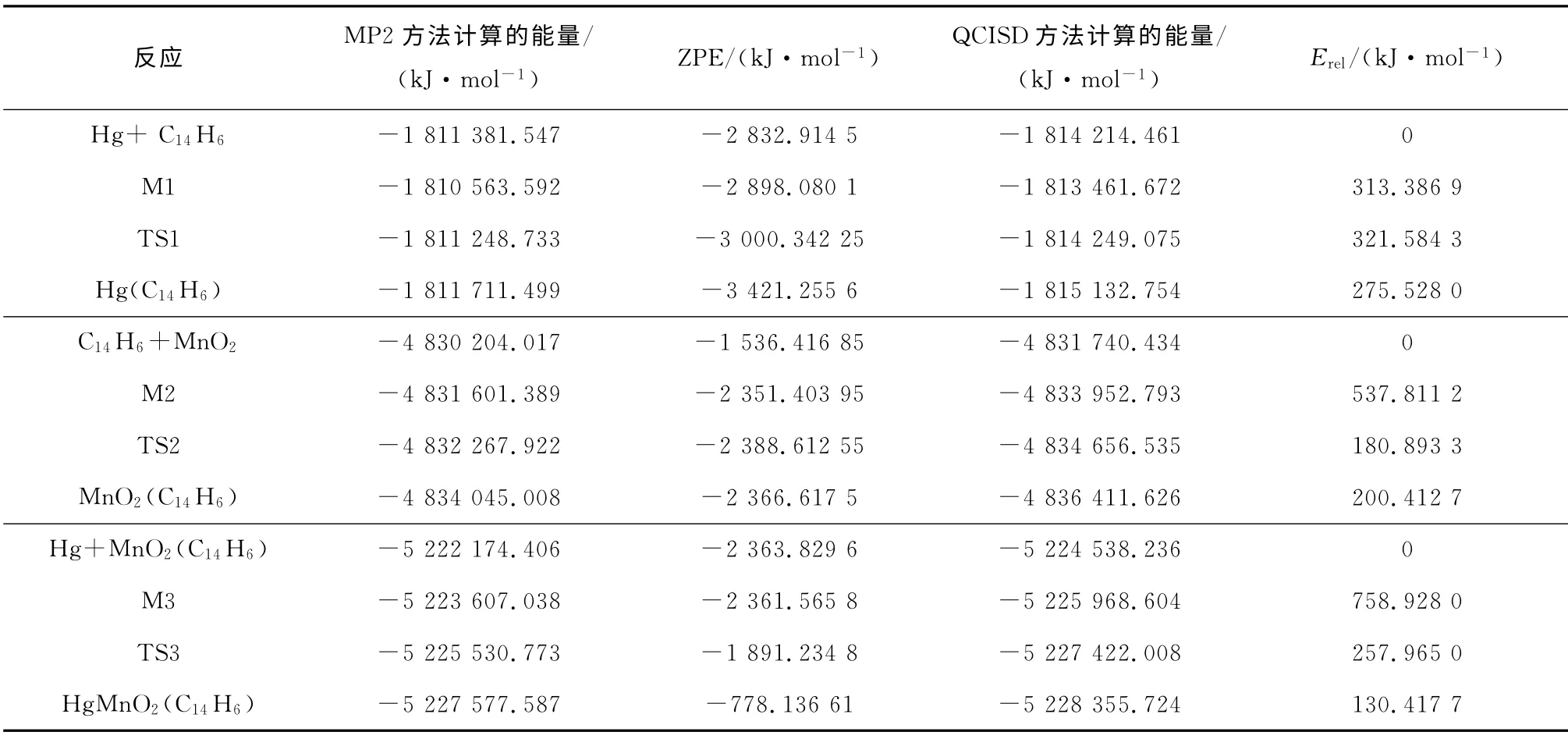
表1 反应通道上各驻点的能量Tab.1 Stagnation point energy of each reaction channel
当T=298.15K 时,分别计算0.000 1 MPa、0.5 MPa、1.0 MPa、1.5 MPa、2.0 MPa、2.5 MPa和3.0 MPa下各反应的指前因子和活化能,并利用式(1)计算得到不同压力下各反应的反应速率常数,见表5~表7,其中n取0.
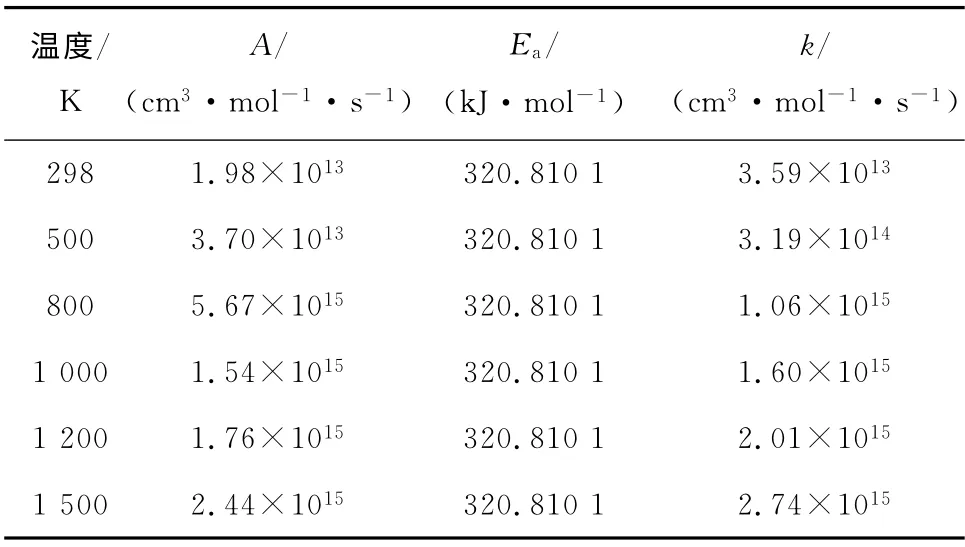
表2 不同温度下反应I的动力学参数Tab.2 Kinetic parameters of reaction I at different temperatures
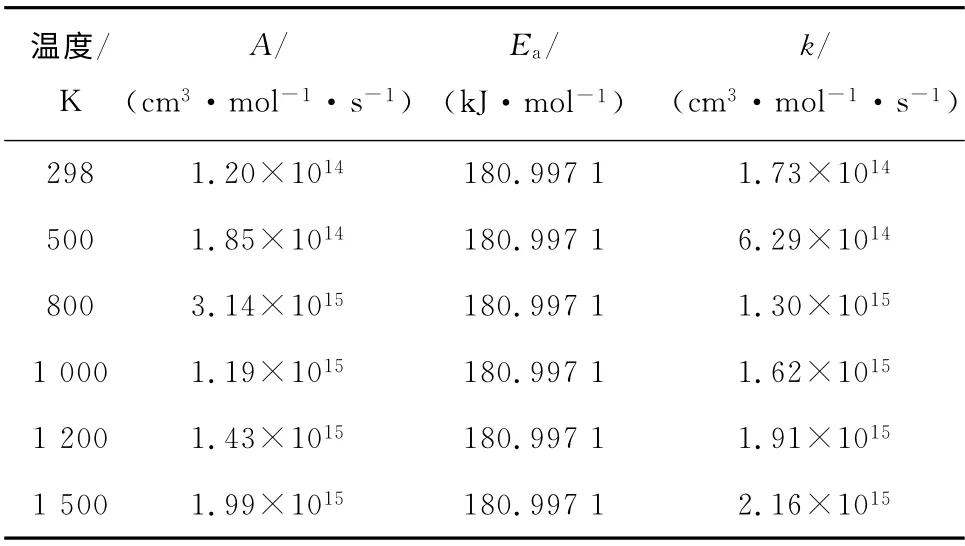
表3 不同温度下反应II的动力学参数Tab.3 Kinetic parameters of reaction II at different temperatures
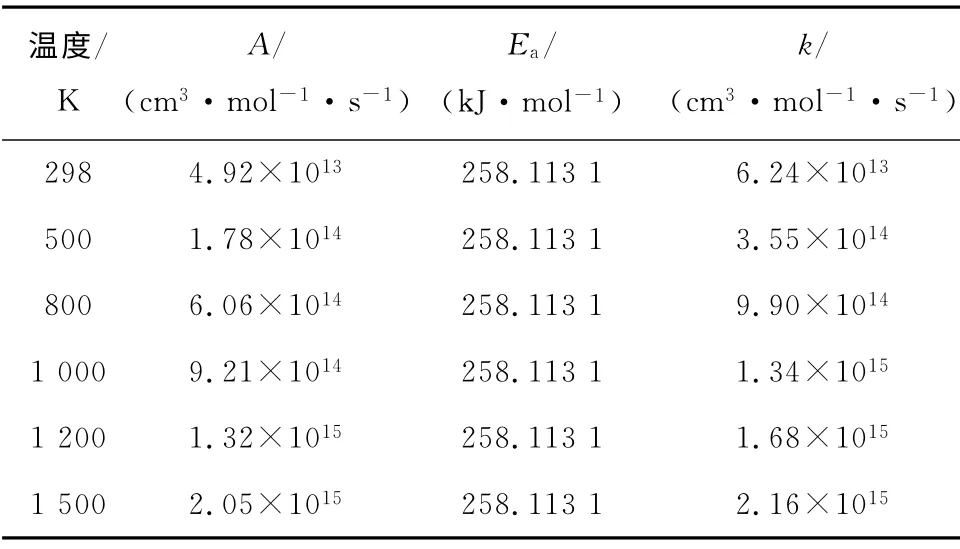
表4 不同温度下反应III的动力学参数Tab.4 Kinetic parameters of reaction III at different temperatures
对式(1)取对数可得:
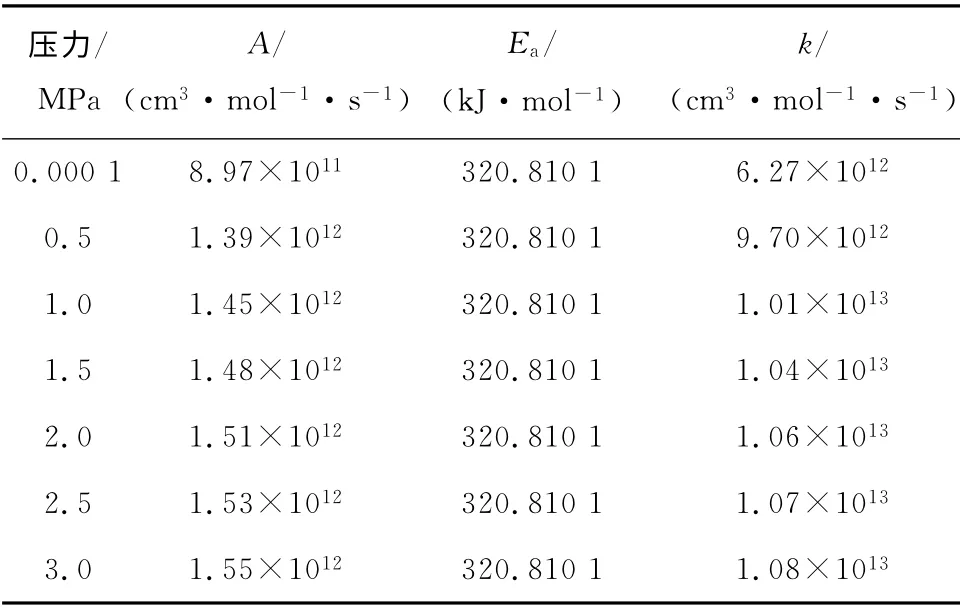
表5 不同压力下反应I的动力学参数Tab.5 Kinetic parameters of reaction I at different pressures
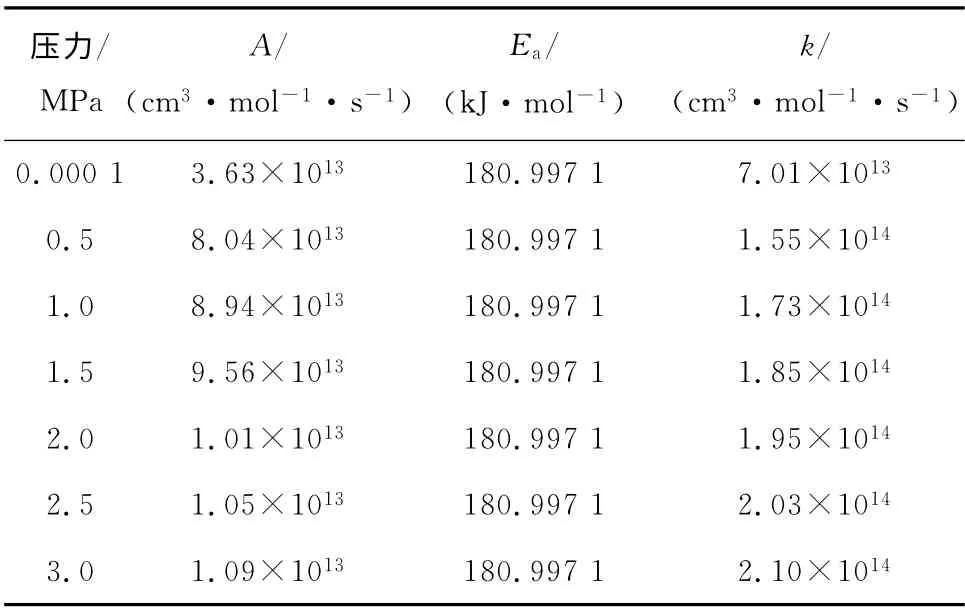
表6 不同压力下反应II的动力学参数Tab.6 Kinetic parameters of reaction II at different pressures
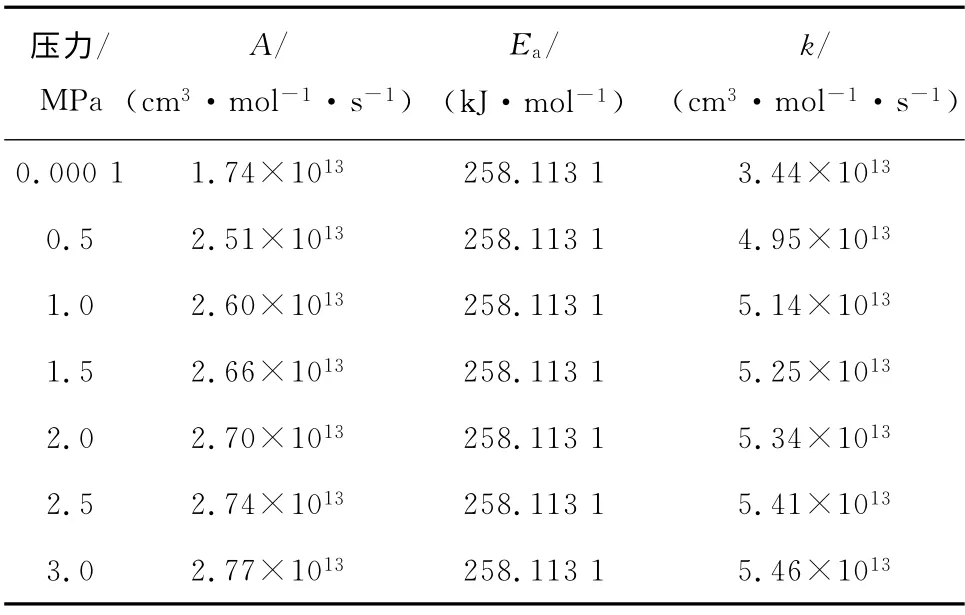
表7 不同压力下反应III的动力学参数Tab.7 Kinetic parameters of reaction III at different pressures
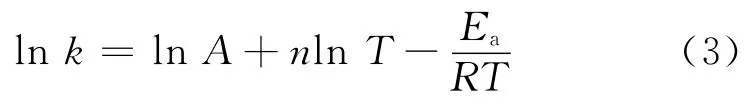
根据表5~表7中数据,分别取温度指数n为0、0.1、0.3和0.5,计算得到不同温度下各反应速率常数值.将不同温度指数下的4组数据分别以lnk为纵坐标,1 000/T为横坐标作图.比较可得,n=0时,lnk与1 000/T呈现良好的线性关系,将其绘制为图4,得到各反应速率常数曲线图,拟合图形得到3个反应的反应速率常数表达式,如表8所示.
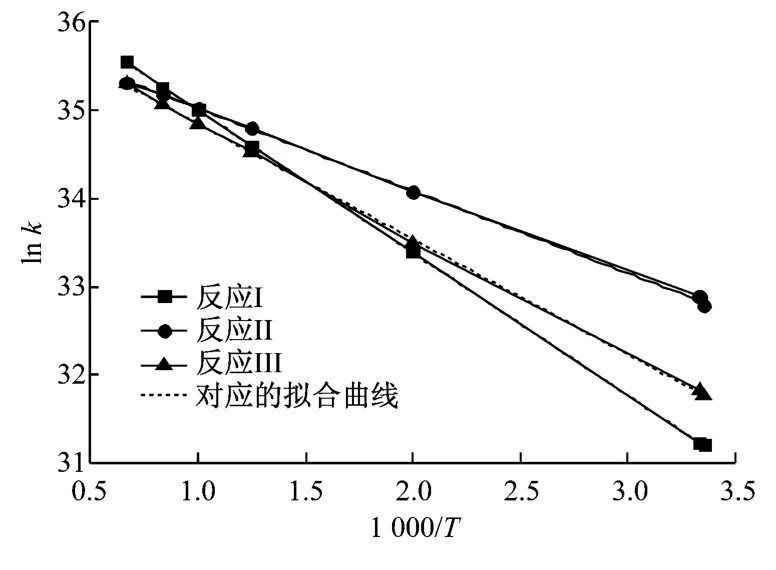
图4 反应速率常数曲线Fig.4 Curves of various reaction rate constants

表8 相关反应的动力学参数Tab.8 Kinetic parameters of relevant reactions
由表2~表8数据分析可知,各反应的反应速率常数随温度的升高而增大.通过比较指前因子、活化能与反应速率常数之间的关系可以发现,同一温度下,反应速率常数受活化能的影响较大,而受指前因子的影响较小.从表3~表4和表6~表7可以看出,只要反应体系中含有一定浓度的MnO2,C14H6与 MnO2发生反应的可能性较大,其次为MnO2(C14H6)和Hg的反应,最后才是Hg和C14H6的反应.这也表明了量子化学可以从本质上揭示改性活性炭在吸附汞时的微观反应机理,为提出有效可行的汞污染控制技术奠定理论基础.
图5为反应I~反应III中lnk随温度的变化曲线图.由图5可知,各反应的反应速率常数随温度的升高变化明显,其中反应I和反应III的反应速率常数在温度低于800K 时,随温度的升高增大较明显,而当温度高于800K 后增大趋势逐渐放缓.反应II的反应速率常数在温度低于500 K 时增大较明显,当温度高于500 K 后增大趋势逐渐放缓.当MnO2改性活性炭和Hg 反应时,700 K 前Hg 和MnO2(C14H6)的反应较快,700K 后Hg和C14H6的反应较快.
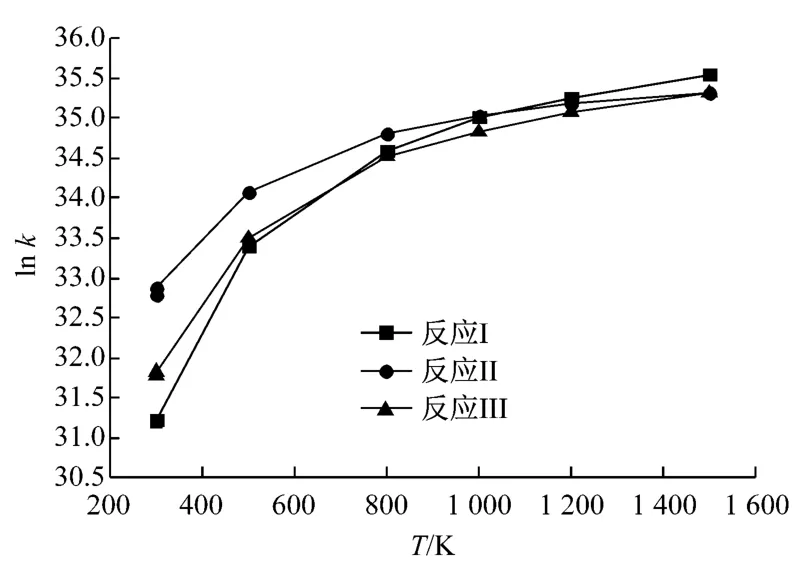
图5 各反应ln k随温度的变化Fig.5 Change curves of ln k with temperature
图6为反应I~反应III中lnk随压力的变化曲线图.由图6可知,各反应速率常数随压力的升高而增大.当压力低于0.5 MPa时,反应速率常数随压力的升高均有明显增大,压力高于0.5 MPa后增大趋势放缓.
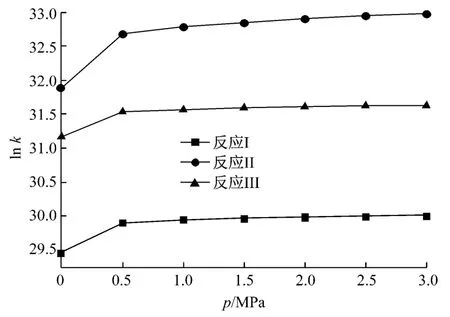
图6 各反应ln k随压力的变化Fig.6 Change curves of ln k with pressure
3 结 论
(1)反应I~反应III的活化能分别为321.58 kJ/mol、180.89kJ/mol和257.97kJ/mol.反应II的活化能最低,说明其反应最容易进行.
(2)在同时含有Hg、C14H6和MnO2的情况下,MnO2和C14H6的反应要比Hg和C14H6的反应快,Hg和MnO2(C14H6)的反应比Hg和C14H6的反应更容易进行.
(3)反应速率常数随温度的升高呈现增大趋势.反应I和反应III的反应速率常数在800K 前随温度的升高增大较快,此后增大趋势逐渐放缓.反应II的反应速率常数在500K 前增大得较快,随后增大趋势也逐渐放缓.
(4)反应速率常数随压力的升高而增大.压力低于0.5 MPa时其随压力的升高增大较快,高于0.5 MPa后增大趋势放缓.
(5)经MnO2改性后的活性炭比未改性的活性炭吸附单质汞的效果要好.
[1]陈俊杰,任建莉,钟英杰,等.活性炭纤维吸附汞的量子化学研究[J].动力工程学报,2010,30(12):960-965.
CHEN Junjie,REN Jianli,ZHONG Yingjie,etal.Quantum chemistry study of mercury adsorption by active carbon fiber[J].Journal of Chinese Society of Power Engineering,2010,30(12):960-965.
[2]殷立宝,禚玉群,徐齐胜,等.中国燃煤电厂汞排放规律[J].中国电机工程学报,2013,33(29):2-9.
YIN Libao,ZHUO Yuqun,XU Qisheng,etal.Mercury emission from coal-fired power plants in China[J].Proceedings of the CSEE,2013,33(29):2-9.
[3]杨建平,赵永椿,张军营,等.燃煤电站飞灰对汞的氧化和捕获的研究进展[J].动力工程学报,2014,34(5):337-345.
YANG Jianping,ZHAO Yongchun,ZHANG Junying,etal.Research process on mercury oxidation and capture with fly ash of coal-fired power plant[J].Journal of Chinese Society of Power Engineering,2014,34(5):337-345.
[4]孟素丽,段钰锋,黄治军,等.烟气成分对燃煤飞灰汞吸附的影响[J].中国电机工程学报,2009,29(20):66-73.
MENG Suli,DUAN Yufeng,HUANG Zhijun,et al.Effect of flue gas components on mercury adsorption by coal-fired fly ash[J].Proceedings of the CSEE,2009,29(20):66-73.
[5]黄勋,程乐鸣,蔡毅,等.循环流化床中烟气飞灰汞迁移规律[J].化工学报,2014,65(4):1387-1395.
HUANG Xun,CHENG Leming,CAI Yi,etal.Mercury migration between flue gas and fly ash in circulating fluidized bed[J].CIESC Journal,2014,65(4):1387-1395.
[6]陈其颢,朱林,王可辉.燃煤电厂汞排放及其控制技术研究[J].电力科技与环保,2013,29(3):10-12.
CHEN Qihao,ZHU Lin,WANG Kehui.Review of mercury emissions and removal technologies of coalfired power plants[J].Electric Power Technology and Environmental Protection,2013,29(3):10-12.
[7]赵鹏飞,郭欣,郑楚光.活性炭及氯改性活性炭吸附单质汞的机制研究[J].中国电机工程学报,2010,30(23):40-44.
ZHAO Pengfei,GUO Xin,ZHENG Chuguang.Investigating the mechanism of elemental mercury binding on activated carbon and chlorine-embedded activated carbon[J].Proceedings of the CSEE,2010,30(23):40-44.
[8]LIU J,QU W,JOO S W.Effect of SO2on mercury binding on carbonaceous surfaces[J].Chemical Engineering Journal,2012,184:163-167.
[9]屈文麒,刘晶,沈锋华,等.CO 对碳基吸附汞的影响机理研究[J].工程热物理学报,2013,34(3):550-553.
QU Wenqi,LIU Jing,SHEN Fenghua,etal.Effect of carbon monoxide on mercury adsorption on carbonaceous material[J].Journal of Engineering Thermophysics,2013,34(3):550-553.
[10]史亚微,白中华,姜军清,等.中国烟气脱汞技术研究现状及发展趋势[J].洁净煤技术,2014,20(2):104-108.
SHI Yawei,BAI Zhonghua,JIANG Junqing,etal.Research status and prospect of mercury removal technology from flue gas in China[J].Clean Coal Technology,2014,20(2):104-108.
[11]高洪亮,周劲松,骆仲泱,等.改性活性炭对模拟燃煤烟气中汞吸附的实验研究[J].中国电机工程学报,2007,27(8):26-30.
GAO Hongliang,ZHOU Jinsong,LUO Zhongyang,etal.Experimental study on Hg vapor adsorption of modified activated carbons in simulated flue gas[J].Proceedings of the CSEE,2007,27(8):26-30.
[12]高正阳,周黎明,于航,等.应用量子化学计算研究溴与汞反应的动力学参数[J].化工学报,2013,64(9):3235-3240.
GAO Zhengyang,ZHOU Liming,YU Hang,etal.Reactivity between mercury and bromine compounds by quantum chemistry calculation[J].CIESC Journal,2013,64(9):3235-3240.
[13]高正阳,陈嵩涛,吴培昕,等.煤燃烧过程中Hg与HF反应动力学的理论研究[J].热力发电,2014,43(9):96-101.
GAO Zhengyang,CHEN Songtao,WU Peixin,etal.Kinetic study on Hg/HF reaction in coal combustion[J].Thermal Power Generation,2014,43(9):96-101.

