miR-181b-5p在人卡波西肉瘤组织中的表达变化及临床意义
丁 媛,吴秀娟,康晓静,普雄明
本研究创新点:
国内外现还未有关于miR-181b-5p与卡波西肉瘤发病机制的相关研究。本研究通过研究miR-181b-5p在人卡波西肉瘤组织中的表达变化及其临床意义,为本病的基因诊断及药物靶标提供理论基础,也对miR-181b-5p在卡波西肉瘤中发病机制的深入研究具有重要意义。
微小RNA(microRNA,miRNA)是一种长度为18~25个核苷酸的非编码小分子RNA。miRNA在基因转录后通过与靶mRNA互补结合,抑制mRNA的翻译或降解mRNA,发挥对约30%人类蛋白的表达调节作用。迄今为止,已经发现并命名超过9 500个miRNA,分别参与了细胞的生长、分化和细胞周期调控等多个环节,在胚胎发育、神经生物学、病毒学以及肿瘤学等领域已经有了许多成熟的研究[1]。虽然卡波西肉瘤 (Kaposi's sarcoma,KS)组织来源不清,但大多数研究结果还是认为,KS细胞主要来源于血管内皮细胞和周皮细胞,肿瘤组织中可能还存在某种必要的细胞产物以促进内皮细胞的生长[2]。而有研究表明,miR-181b通过调控核因子κB(NF-κB)信号通路作用于靶基因核蛋白α3[3],最终参与了血管内皮细胞炎症发生的过程。miR-181b-5p是从miR-181b的前体5'端加工而来。miR-181b-5p是否通过复杂的miRNA调控网络导致血管内皮细胞的异常增殖,最终导致肿瘤的发生,还有待于进一步验证。本研究检测miR-181b-5p在人KS组织中的表达,明确miR-181b-5p是否与KS的发生发展相关。
1 材料与方法
1.1 材料来源 收集2012年1月—2013年10月新疆维吾尔自治区人民医院18例行HE染色且病理检查明确诊断KS患者的KS组织及癌旁组织 (活检取材),存于液氮罐中。
1.2 主要试剂 miRNeasy Mini Kit试剂盒 (德国Qiagen公司),Trizol试剂 (美国Invitrogen公司),RNA酶抑制剂、MMLV反转录酶 (美国Epicentre公司),10×反转录 (RT)缓冲液、2×PCR Master Mix(美国Super Array公司),2.5 mmol/L脱氧核糖核苷三磷酸(dNTP)混合液 (芬兰HyTest Ltd公司),RT引物 (上海英骏生物技术有限公司)。
1.3 研究方法
1.3.1 提取组织总RNA(含miRNA) 取液氮保存的KS组织及癌旁组织 (50 mg),按miRNeasy Mini Kit试剂盒说明书提取总RNA。采用紫外线吸收法检测RNA的浓度及纯度,OD260/OD280比值在1.8~2.2之间的用于下一步实验。
1.3.2 RT-RNA 选取 2.5 mmol/L dNTP 混合液 2 μl、10 × RT 缓冲液 2 μl、RT 引物 (1 μmol/L)0.3 μl、总RNA 700 ng、MMLV 反 转 录 酶 (200 U/μl)0.2 μl、RNA 酶抑制剂 (40 U/μl)0.3 μl,加去 RNA 酶水至20 μl,制成RT混合反应液。采用PCR扩增仪进行RT-RNA:16℃ 30 min,42℃ 40 min,85℃ 5 min,合成的cDNA用于实时荧光定量PCR检测。RT引物:hsa-miR-181b:5'-GTCGTATCCAGTGCGTGTCGTGG AGTCGGCAATTGCACTGGATACGACACCCACCG -3';U6:5'-CGCTTCACGAATTTGCGTGTCAT-3'。
1.3.3 实时荧光定量PCR检测 实时荧光定量PCR检测使用ViiA 7 Real-time PCR系统,实时荧光定量PCR反应体系:2 × PCR Master Mix 5 μl、10 μmol/L PCR 特异引物:上游引物 0.5 μl、下游引物 0.5 μl,加水至总体积为8 μl,轻弹管底将溶液混合,以5 000 r/min离心1 min(离心半径10 cm)。将8 μl混合液加到384孔PCR板对应孔中,再加入对应的cDNA 2 μl,小心粘上Sealing Film封口膜,并以5 000 r/min离心1 min(离心半径10 cm)。U6和各样品的目的miRNA均按以下程序进行:95℃ 10 min,共40个 PCR循环〔95℃ 10 s,60℃ 60 s(收集荧光)〕。扩增反应结束后,95℃ 10 s,60℃ 60 s,95℃ 15 s,并从60℃缓慢加热到99℃(仪器自动进行,升温速率为0.05℃/s),建立PCR产物的熔解曲线。得到基本循环数 (Ct)值,以U6为内参,△Ct=Ct与内参循环数差值,△△Ct=最低样本△Ct值 -其他各样本△Ct值,目的基因相对含量=2-△△Ct。hsa-miR-181b-5p PCR 特异引物的上游引物为:5'-GGGAACATTCATTGCTG-3',下游引物为:5'-TGCGTGTCGTGGAGTC-3'。U6 PCR特异引物的上游引物为:5'-GCTTCGGCAGCACATATACTAAAAT-3',下游引物为:5'-CGCTTCACGAATTTGCGTGTCAT-3'。
1.4 分类标准 KS组织病理分期[4]:(1)斑片期:无增生的梭形细胞和血管成分,真皮内血管增生扩张,倾向于形成新生血管,非特异性改变;(2)斑块期:少量血管成分,梭形细胞逐渐增多;(3)结节期:梭形细胞明显密集。全身皮损类型[5]:斑片、斑块、结节、糜烂、水肿。
1.5 统计学方法 采用SPSS 16.0软件进行统计分析,计量资料以 (±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,组间两两比较采用q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 临床资料 患者均为维吾尔族,其中男17例,女1例;年龄29~79岁,平均 (60.0±14.1)岁;病程1~132个月,平均 (24.2±33.8)个月;KS组织病理分期:斑片期5例,斑块期5例,结节期8例;全身皮损面积:≤1%6例,>1%12例;全身皮损类型≤2种7例,>2种11例;人疱疹病毒8型 (HHV-8)阳性15例,阴性3例;人类免疫缺陷病毒 (HIV)阳性7例,阴性11例;HIV合并HHV-8双阳性6例,双阴性2例。
2.2 KS组织和癌旁组织中miR-181b-5p表达水平KS组织中miR-181b-5p表达水平为 (0.73 ±0.40),癌旁组织中miR-181b-5p表达水平为 (0.24±0.16),差异有统计学意义 (t=4.826,P<0.01)。
2.3 miR-181b-5p表达水平的单因素分析 不同年龄、病程、全身皮损面积、全身皮损类型及HHV-8、HIV阴阳性患者KS组织中miR-181b-5p表达水平比较,差异无统计学意义 (P>0.05)。不同肿瘤组织病理分期患者KS组织中miR-181b-5p表达水平比较,差异有统计学意义 (P<0.05);斑块期、结节期患者miR-181b-5p表达水平高于斑片期,差异有统计学意义 (P<0.05,见表1)。HIV合并HHV-8双阳性患者miR-181b-5p表达水平为 (0.32 ±0.19),HIV 合并HHV-8双阴性患者miR-181b-5p表达水平为 (0.43±0.17),差异无统计学意义 (t=1.615,P=0.158)。
3 讨论
由于获得性免疫缺陷综合征 (AIDS)合并KS病死率高,且KS可以帮助早期诊断AIDS以及评估预后[6],故其在AIDS的防治工作中发挥着巨大作用。现已证明,miR-181b在炎症和恶性肿瘤中形成并建立了广泛的联系,miR-181b上游被STAT3和HMGA1转录因子所调节,其中STAT3通过白介素6(IL-6)激活的转录因子直接激活miR-181b,从而抑制肿瘤抑制基因PTEN和CYLD的功能,导致NF-κB活性增强后造成炎症的发生,而miR-181b通过抑制下游靶基因CBX7参与调控细胞周期,通过P27、BCL2等靶基因影响肿瘤细胞增殖、细胞黏附和凋亡[7];近年研究发现,miR-181b在肿瘤的发生和发展中发挥十分重要的作用[8]。研究显示,miR-181b表达水平在结肠癌、胰腺癌、头颈部肿瘤、肝细胞癌、乳腺癌、甲状腺癌、口腔癌、骨肉瘤、急性髓细胞性白血病、成视网膜细胞瘤中上调,在神经胶质瘤、慢性淋巴细胞性白血病、胃癌、肺癌、前列腺癌中下调[8],以上结果均提示miR-181b的功能较为独特,其表达水平上调或下调取决于肿瘤的类型和与之对立的细胞种类;miR-181b还参与了各种肿瘤细胞的生物学活动[8]。国内、外少见KS与人miRNA的报道,本研究通过实时荧光定量PCR检测KS组织中miR-181b-5p的 表 达 水 平,结 果 显 示,miR-181b-5p在KS组织中的表达水平高于癌旁组织,表明其与KS的发生发展可能存在着密切关系,提示miR-181b-5p对于KS来说可能是一种致瘤基因。
表1 miRNA-181b-5p表达的影响因素分析 (±s)Table 1 The influence factors of miRNA-181b-5p expression
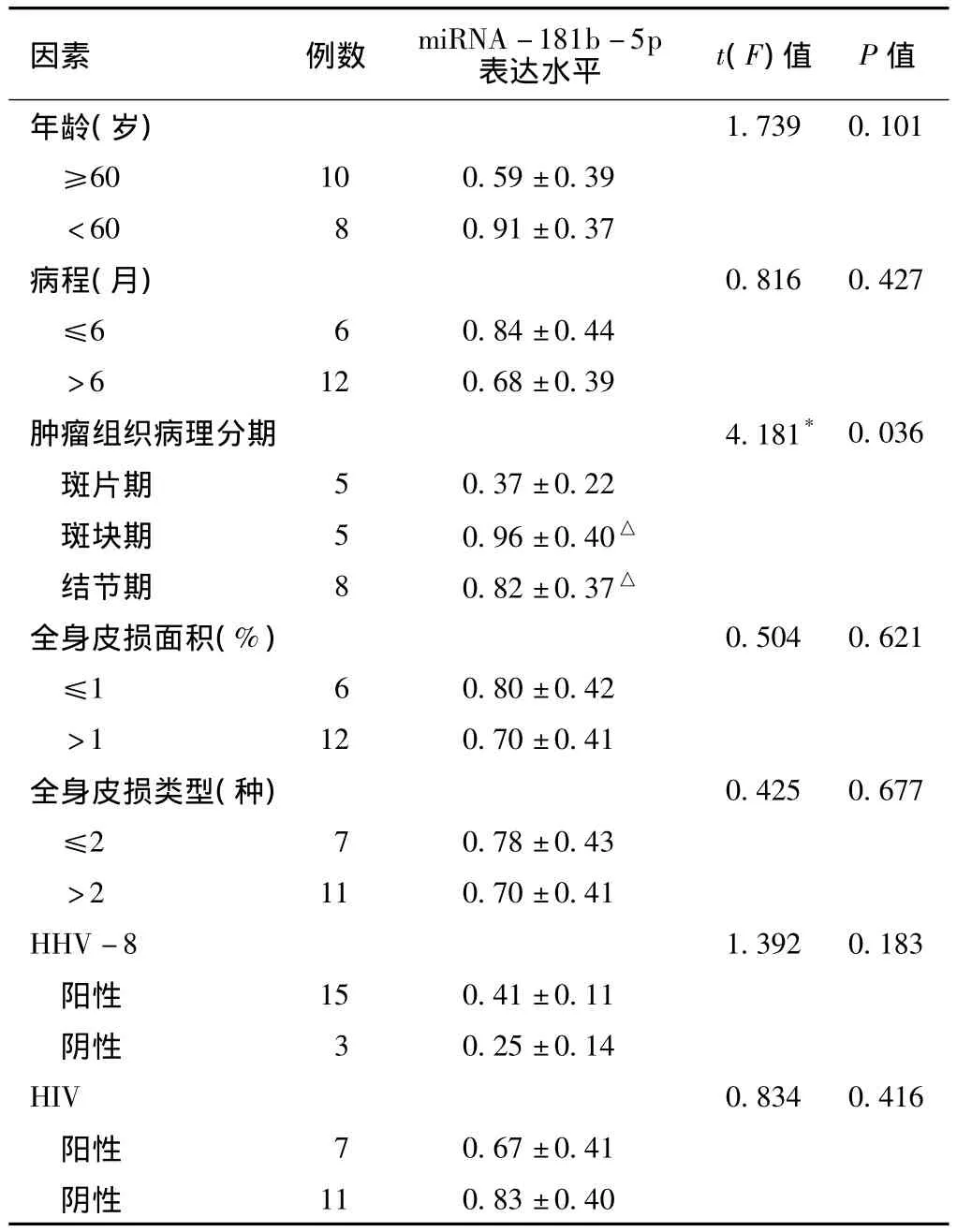
表1 miRNA-181b-5p表达的影响因素分析 (±s)Table 1 The influence factors of miRNA-181b-5p expression
注:*为F值;与斑片期比较,△P<0.05;HHV-8=人疱疹病毒8型,HIV=人类免疫缺陷病毒
因素 例数 miRNA-181b-5p表达水平 t(F)值 P值年龄(岁)11 0.83 ±0.40 1.739 0.101≥60 10 0.59 ±0.39<60 8 0.91 ±0.37病程(月) 0.816 0.427≤6 6 0.84 ±0.44>6 12 0.68 ±0.39肿瘤组织病理分期 4.181* 0.036斑片期 5 0.37 ±0.22斑块期 5 0.96 ±0.40△结节期 8 0.82 ±0.37△全身皮损面积(%) 0.504 0.621≤1 6 0.80 ±0.42>1 12 0.70 ±0.41全身皮损类型(种) 0.425 0.677≤2 7 0.78 ±0.43>2 11 0.70 ±0.41 HHV-8 1.392 0.183阳性 15 0.41 ±0.11阴性 3 0.25 ±0.14 HIV 0.834 0.416阳性 7 0.67 ±0.41阴性
本研究结果显示,不同年龄、病程、全身皮损面积、全身皮损类型及HHV-8、HIV阴阳性患者KS组织中miR-181b-5p表达水平无差异。有研究报道,HHV-8和HIV双重感染可增加KS的发生率,双重感染患者病死率较单纯感染患者明显提高[9],提示双重感染患者病情可能较重,miRNA-181b-5p在肿瘤组织中高表达。而本研究结果显示,HIV合并HHV-8双阳性患者miR-181b-5p表达水平与HIV合并HHV-8双阴性患者无差异,可能和本研究临床病例数较少有关。
Lu等[10]认为,miRNA表达谱可以作为肿瘤组织分型的依据,还可以作为细胞分化程度的客观评价,从而得出miRNA可能参与了细胞分化状态的结论。通过对肿瘤组织和正常组织间细胞分化程度的对比,建立与之对应的肿瘤miRNA标签或miRNA表达谱,对于肿瘤的早期诊断和靶向治疗有积极推动作用。Heffelfinger等[11]发现,通过miRNA的表达水平可以对8例浸润型基底细胞癌患者中的7例进行准确分类,没有准确分型的1例患者为混合型基底细胞癌。尤其是miR-183的表达水平在浸润型基底细胞癌中明显低于结节型基底细胞癌,进一步证明其可抑制肿瘤的浸润和转移。Santucci等[12]认为,KS和其他皮肤肿瘤 (如蕈样肉芽肿)一样,分为斑片期、斑块期和结节期,临床上表现为一个连续发展的过程。在组织学上亦是如此,斑片期组织学以非特异性炎症为主,而斑块期和结节期则以增生的梭形细胞和血管瘤样结构表现为主。本研究中,虽然斑块期、结节期患者KS组织miR-181b-5p表达水平均高于斑片期,提示miR-181b-5p可能促进肿瘤的生长;但结节期与斑块期无差异,考虑和本研究病例数较少有关,也可能与miRNA-181b-5p不能完全体现KS谱性改变有关,故需要进一步增加病例数后验证。
KS发病率相对较低,故本研究纳入病例数较少,而且研究较为局限,未进行相关细胞学功能以及靶基因的深入研究,本研究组将继续扩大样本量进一步验证其是否可以完全体现KS的谱性改变,并进行靶基因预测,进而验证其靶基因的功能,从而为临床的诊断提供帮助,为探索KS特异性诊断和治疗的新方法提供理论依据。
综上所述,miRNA-181b-5p在KS组织中的表达水平明显上调,且在斑片期损害中相对表达水平较低,表明其与KS的发生发展存在着密切关系,miRNA-181b-5p有可能成为潜在的分子诊断及治疗指标之一。
[1] Macfarlane LA,Murphy PR.MicroRNA:biogenesis,function and role in cancer[J].Curr Genomics,2010,11(7):537-561.
[2] Gessain A,Duprez R.Spindle cells and their role in Kaposi's sarcoma[J].Int J Biochem Cell Biol,2005,37(12):2457-2465.
[3] Sun X,He S,Wara AK,et al.Systemic delivery of microRNA-181b inhibits nuclear factor- κB activation,vascular inflammation,and atherosclerosis in apolipoprotein E-deficient mice[J].Circ Res,2014,114(1):32-40.
[4] Xu YM,Pu XM,Li F,et al.Clinical and pathological profiles of 43 cases of Kaposi's sarcoma in Xinjiang Uygur Autonomous Region[J].China Journal of Leprosy Skin Diseases,2005,21(9):685-687.(in Chinese)
徐益明,普雄明,李锋,等.新疆kaposi肉瘤43例临床及病理学分析[J].中国麻风皮肤病杂志,2005,21(9):685-687.
[5] Wu XJ,Pu XM,Kang XJ,et al.One hundred and five Kaposi sarcoma patients:a clinical study in Xinjiang,Northwest of China[J].J Eur Acad Dermatol Venereol,2014,28(11):1545-1552.
[6] Moskowitz L,Hensley GT,Chan JC,et al.Immediate causes of death in acquired immunodeficiency sydrome [J].Arch Pathol Lab Med,1985,109(8):735-738.
[7] Iliopoulos D,Jaeger SA,Hirsch HA,et al.STAT3 activation of miR-21 and miR-181b-1 via PTEN and CYLD are part of the epigenetic switch linking inflammation to cancer [J].Mol Cell,2010,39(4):493-506.
[8] Liu J,Shi W,Wu C,et al.miR-181b as a key regulator of the oncogenic process and its clinical implications in cancer(review)[J].Biomed Rep,2014,2(1):7-11.
[9] Yang PR,Guo SX,Tan XH,et al.Research on co-infections of HIV and human herpesvirus-8 among the Uygur high-risk groups in a city,Xinjiang [J].Chinese Journal of Preventive Medicine,2009,43(11):960-964.(in Chinese)
杨培荣,郭淑霞,谭晓华,等.新疆某市维吾尔族人类免疫缺陷病毒感染高危人群共感染人疱疹病毒8型的调查[J].中华预防医学杂志,2009,43(11):960-964.
[10] Lu J,Getz G,Miska EA,et al.MicroRNA expression profiles classify human cancers[J].Nature,2005,435(7043):834-838.
[11] Heffelfinger C,Ouyang Z,Engberg A,et al.Correlation of global microRNA expression with basal cell carcinoma subtype[J].G3(Bethesda),2012,2(2):279-286.
[12] SantucciM, PimpinelliN, MorettiS, etal.Classic and immunodeficiency - associated Kaposi's sarcoma.Clinical,histologic,and immunologic correlations[J].Arch Pathol Lab Med,1988,112(12):1214-1220.

