植入壳聚糖体内降解的机理研究
王刚 李晓萍 王进
植入壳聚糖体内降解的机理研究
王刚 李晓萍 王进
壳聚糖已广泛应用于医药行业,但明确壳聚糖的降解机理是其应用于人体植入的前提。壳聚糖是甲壳素脱乙酰化的产物,可通过酸降解法、氧化降解法和酶降解法降解,而植入人体后则通过溶菌酶水解成N-乙酰氨基葡萄糖和氨基葡萄糖。溶菌酶通过其活性部位与壳聚糖链中的乙酰氨基基团结合,在D、E环之间产生断裂。因此,乙酰氨基基团的数量是植入壳聚糖水解的关键。
壳聚糖;降解;乙酰氨基;溶菌酶
壳聚糖[chitosan,(1,4)-2-氨基-2-脱氧-β-D-葡萄糖]是由甲壳素[chitin,(l,4)-2-乙酰氨基-2-脱氧-β-D-葡萄糖]经脱乙酰化反应后而得到的一种生物高分子,广泛存在于节肢动物如虾、蟹的壳和真菌的细胞壁中,是一种再生资源。壳聚糖由于具有成膜性、生物兼容性好以及易于被生物降解等特点,在食品、化工、医药等领域中有着广泛的应用。为了更清晰的评价壳聚糖在体内的循环降解过程,本文对壳聚糖的结构性质、降解方法和溶菌酶进行了介绍,并着重对壳聚糖的溶菌酶催化降解机理作一综述。
1 壳聚糖结构及性质
壳聚糖是白色、无定型、半透明、略有珍珠光泽的固体,因原料不同和制备方法不同,相对分子质量也从数十万至数百万不等,它不溶于水和碱溶液,可溶于稀的盐酸、硝酸等无机酸和醋酸等大多数有机酸,不溶于稀的硫酸、磷酸。
甲壳素和壳聚糖的结构上见图1和图2,糖链上N-乙酰基的多寡,对它们的性质具有重大影响。
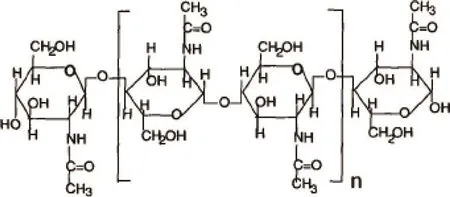
图1 甲壳素结构式

图2 壳聚糖结构式
脱乙酰度越是低于70%的壳聚糖,在1%盐酸中的溶解度越小,小到不溶解的,则就是甲壳素。因此,脱乙酰度是壳聚糖的主要性能指标[1]。
2 壳聚糖的降解方法
在壳聚糖的各种改性反应中,壳聚糖的降解反应越来越受到广泛的关注。因为降解后生成的壳低聚糖,特别是分子量低于一万的低聚糖,表现出其独特的生理活性和物化性质。它可以提高巨噬细胞的吞噬功能,促进肝脏抗体的生长,抑制肿瘤细胞的生长及转移[2],可有效地降低肝脏和血清中的胆固醇[3],相对分子量为1500的甲壳低聚糖对大肠杆菌有强的抑菌作用[4],特别是较高聚合度的甲壳低聚糖具有阻碍病源菌生长繁殖的功能,可促进蛋白质合成,活化植物细胞,从而促进植物快速生长等[5]。
壳聚糖的降解反应大致分三种方法:酸降解法、氧化降解法和酶降解法。其中,酶解法应用专一性壳聚糖酶和非专一性的其他酶来进行壳聚糖的降解,能用于酶解法的各种酶有30多种[6],通过特异地开裂壳聚糖的β(l,4)糖苷键来达到降解目的,在整个降解过程中无其他反应试剂加入、无其他反应副产物生成,是壳聚糖降解的最理想方法。
3 溶菌酶
溶菌酶(lysozyme),又称细胞壁溶解酶(muramidase),它是一种能够水解微生物细胞壁肽聚糖的酶。在1922年,英国细菌学家Fleming首次在在人的眼泪及唾液中发现了这种酶[7]。溶菌酶是人体体液中含量较高的一种抗菌物质,在泪液中含量最多,约占人体泪液蛋白含量的20%~40%。
溶菌酶的主要功能是通过破坏细菌细胞壁的肽聚糖骨架成分,从而水解细菌细胞壁,达到溶菌的作用。溶菌酶具有广泛的抑菌谱,它能分解革兰氏阳性菌、枯草杆菌及耐辐射微球菌等,并且效果很好。因为肽聚糖是这些细菌细胞壁的主要骨架成分,肽聚糖中N-乙酰葡萄糖胺和N-乙酰细胞壁之间的β-1,4糖苷键是溶菌酶的专一作用位点。相同的,溶菌酶会破坏壳聚糖链中的β-1,4糖苷键,将壳聚糖水解成含N-乙酰基葡萄糖和氨基葡萄糖的寡糖,达到降解壳聚糖的作用。
4 壳聚糖降解产物及其功效
壳聚糖水解产物是N-乙酰氨基葡萄糖(2-acetamido-2-deoxy-β-D-glucopyranose,GlcNAc)和氨基葡萄糖(2-amino-2-deoxy-β-D-glucopyranose,GlcN)的多糖或寡糖。
4.1 抗肿瘤作用 李运曼[8]等采用抗移植性肿瘤实验方法证实GlcN对小鼠移植肉瘤、肝痛腹水瘤和艾氏腹水实体瘤有显著的抑制作用,尤其是对小鼠移植肉瘤和肝庙腹水瘤抑制作用最强。
4.2 诱导白血病细胞向巨噬细胞转化作用 白血病通常由于造血干细胞在定向分化的过程中出现异常而发生,王哲[9]等分别用不同浓度GlcN和GlcNAc对白血病K562细胞进行诱导分化实验,结果表明二者均可诱导K562细胞向巨噬细胞方向分化,表明两药均可以抑制防细胞增殖,很可能成为新的高效、低毒的髓系白血病治疗候选药物。
4.3 清除过氧化氢,抗衰老作用 目前发现氨基葡萄糖与Cu2+形成的配合物对H2O2的分解具有催化作用,邵健[10]等利用GlcN在水溶液中与Cu2+形成配合物,加入到一定浓度的H2O2中,在不同条件下放置,于不同时间测分解率。结果表明GlcN-Cu2+配合物对分解H2O2具有明显的催化作用,在30℃及pH6.5条件下作用12h可使90%以上的H2O2分解,24h后分解几乎完全。
4.4 治疗骨关节炎作用 氨基葡萄糖是一种天然的氨基单糖,是软骨基质和滑液中聚氨基葡萄糖的成分。外源性的氨基葡萄糖可以刺激软骨细胞合成蛋白多糖,补充软骨基质的丢失成分,并可抑制基质金属蛋白酶的表达,从而促进软骨的修复。氨基葡萄糖可以抑制因免疫而造成的蛋白多糖降解、修复受损的关节软骨的作用;研究表明[11],氨基葡萄糖可抑制弹性蛋白酶、溶酶体酶等水解醉的释放,减少其对软骨基质的水解破坏,从而阻碍因免疫反应的恶性循环对关节软骨的不断破坏。
5 壳聚糖降解机理
壳聚糖在植入人体后,主要倚靠体液中的溶菌酶催化降解成N-乙酰氨基葡萄糖和氨基葡萄糖的单糖或多糖,从而被人体吸收。目前,国内外对于壳聚糖在溶菌酶中水解的基础研究主要集中在日本,国内较少。
5.1 壳聚糖产物的研究 为明确壳聚糖降解产物,Kenichi Ishiguro[12]采用1H核磁共振技术,测试GlcNAc、(GlcNAc)3和GlcN、(GlcN)3的单糖和三聚糖基准物的图谱。见图3。
选用脱乙酰度66%、分子量约19100的壳聚糖在37℃的含有溶菌酶的醋酸缓冲液反应6天的降解产物进行核磁共振测试,光谱见图4。
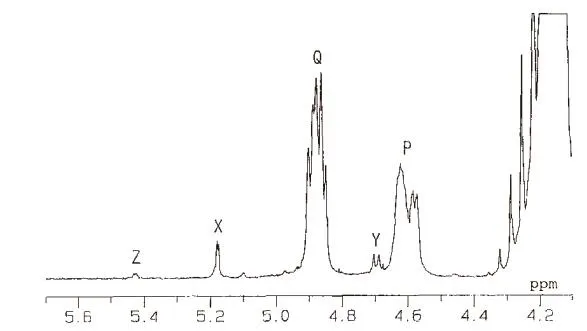
图4 壳聚糖水解产物的1H核磁谱图
图中,P(4.6ppm)和Q(4.90ppm)分别正好对应上GlcNAc和GlcN的H-1(β)峰,峰值较小的X(5.17ppm)、Y(4.69ppm)正好对应上GlcNAc和GlcN的H-1(α),壳聚糖的产物的核磁共振峰与单糖和三聚糖的GlcNAc和GlcN一一对应,而且峰值的大小也反应出两者的比例,从图中计算出其脱乙酰度为53%,而通过红外测试[13]其脱乙酰度为55%,几乎一致。由此说明,壳聚糖产物的确为GlcNAc和GlcN的单糖或者寡糖。
5.2 溶菌酶的催化机理 为解释溶菌酶的催化作用,1965年Johnson LN[14]实验室用X射线晶体结构分析法阐述了蛋清溶菌酶的三维立体结构,通过他们的三维立体结构发现溶菌酶分子其实是一个大小为4.5nm×3.0nm×3.0nm的近椭圆形结构。溶菌酶分子内部几乎是非极性的,在分子的表面有一个较深的裂缝,恰好能容纳多糖底物的六个单糖(A、B、C、D、E和F环),这就是溶菌酶的活性部位,它是一个由肽键上的第35位的谷氨酸和第52位的天门冬氨酸构成的活性中心,白色所示的即活性部位的Glu35和Asp52。见图5。

图3 GlcNAc(a)和GlcN(b) 的1H核磁谱图
图3 (a)中A、B峰为GlcNAc的H-1(α)和H-1(β)峰,C为H-1质子共振峰。图3(b)中D、E为GlcN的H-1 (α)和H-1(β)峰。GlcNAc和GlcN的核磁共振数据见表1。
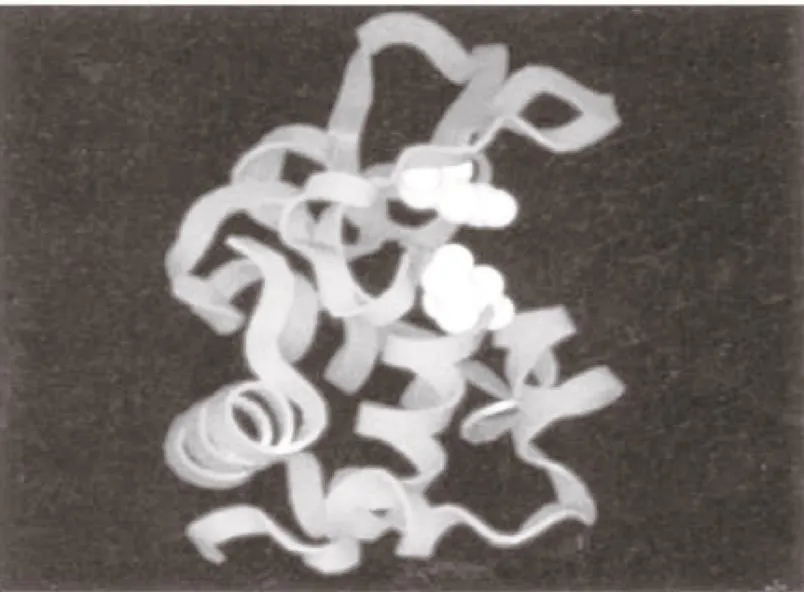
图5 溶菌酶三维结构
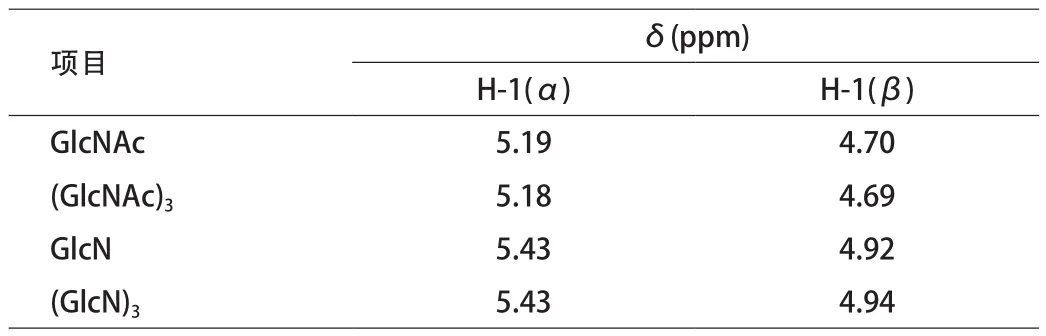
表1 GlcNAc和GlcN的核磁共振数据
Pangburn[15]在进行溶菌酶水解壳聚糖实验时发现不同浓度酶在催化水解时,水解超过2小时后低浓度酶的催化反应速率成线性而高浓度酶为非线性,他认为这种高浓度下呈现非线性催化的原因是在底物与溶菌酶活性部位结合导致的。直观的,将溶菌酶中具有活性部分设计成模型[16],如图6所示,A-F为溶菌酶活性部位的6个环,它可与带有乙酰氨基基团的线性聚合物相互作用。溶菌酶与底物结合时,第四个糖残基D环由于空间的原因必须由正常的椅式变形为能量高的半椅式,因此降低了糖苷键的稳定性,导致其容易断裂。
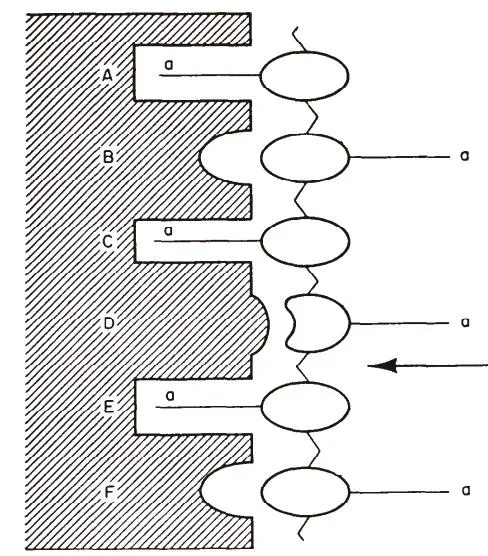
图6 溶菌酶具有活性部位的示意图
图中,a为乙酰氨基基团,在D、E之间的箭头表示N-乙酰氨基葡萄糖发生断裂的链段部位,即断裂发生在D、E之间。在断裂部位,a必须为乙酰氨基基团,否则其与溶菌酶的相互作用会减弱,无法使链段断裂。
5.3 壳聚糖分子链段断裂分析 为探索溶菌酶如何切断壳聚糖中的线性链段,Kenichi Amano和Eiji Ito[17]水解自制脱乙酰度为68%的壳聚糖,水解条件为pH5.25的含有溶菌酶的醋酸铵缓冲液在37℃条件下反应90h,然后将产物的各部分用色谱法分离[14],并通过一定方法进行鉴别[18-21],得到产物如表2所示。
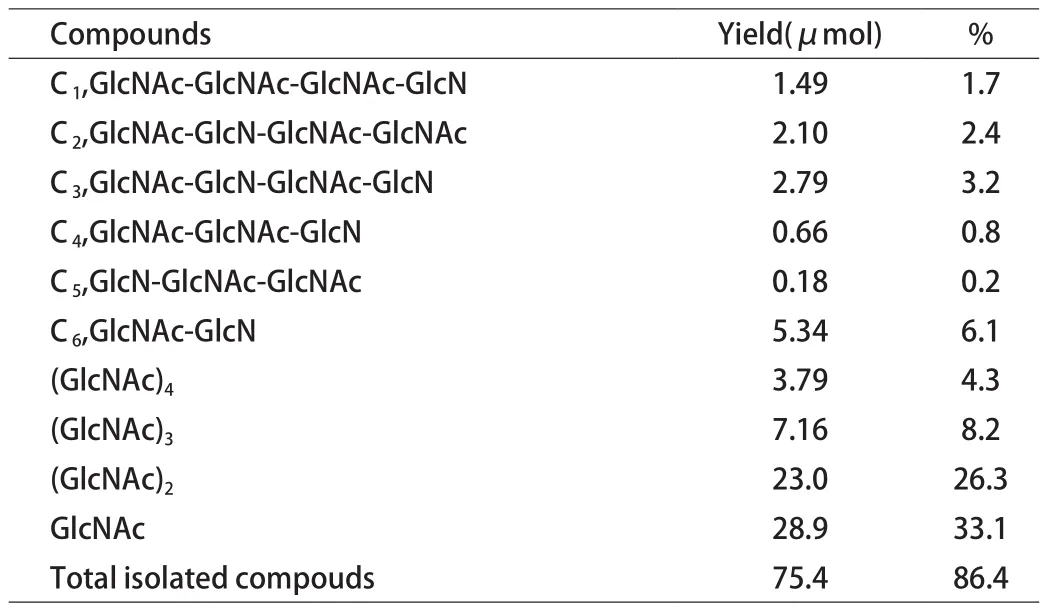
表2 壳聚糖水解产物列表
本次实验总共降解了86.4%的壳聚糖,其中C1、C2和C3为四聚糖,C4和C5为三聚糖,C6为二聚糖,分别对几种寡糖继续进行水解,结果如下:
GlcNAc-GlcNAc-GlcNAc-GlcN(C1)→GlcNAc+ GlcNAc-GlcNAc-GlcN(少)
GlcNAc-GlcNAc-GlcNAc-GlcN(C1)→(GlcNAc)2+ GlcNAc-GlcN(多)
GlcNAc-GlcN-GlcNAc-GlcNAc(C2)→GlcNAc-GlcN+(GlcNAc)2
GlcNAc-GlcN-GlcNAc-GlcN(C3)→GlcNAc-GlcN
GlcNAc-GlcNAc-GlcN(C4)→GlcNAc+GlcNAc-GlcN
C5、C6无法水解
(GlcNAc)3→GlcNAc+(GlcNAc)2
(GlcNAc)4→GlcNAc+(GlcNAc)2+(GlcNAc)3
从中可以看到,寡糖的水解是有条件的,不是所有的链段都可以断裂,C5就是很好的例子,溶菌酶似乎对它无任何作用。
在200μL的pH5.25的醋酸缓冲液中加入600μg溶菌酶分别降解各种寡糖进行分析,从链段的断裂情况中可以发现一定的规律。见表3。首先,E环必须和GlcNAc相结合,若与GlcN结合分子链段则不能断裂;其次,C环和GlcN结合链段不能断裂,当C环无基团结合时,D环与GlcNAc结合时分子链段能断裂,而与GlcN结合分子链段不能断裂;最后,从反应速率上看,C、D、E三环都与GlcNAc结合时反应速率高,比如C1和(GlcNAc)3和(GlcNAc)4,而C环没有和GlcNAc或者D部位与GlcN结合时,则反应速率低,比如C2、C3和C4。C5不符合前面两个规律,故而无法被继续水解。由此可知,乙酰氨基基团与溶菌酶活性部位的结合是水解壳聚糖中的关键。另外,从C1的水解产物上看,C环与GlcNAc的结合使得分子链断裂更容易发生,这跟C1两种水解方式的产物对比上是一致的。
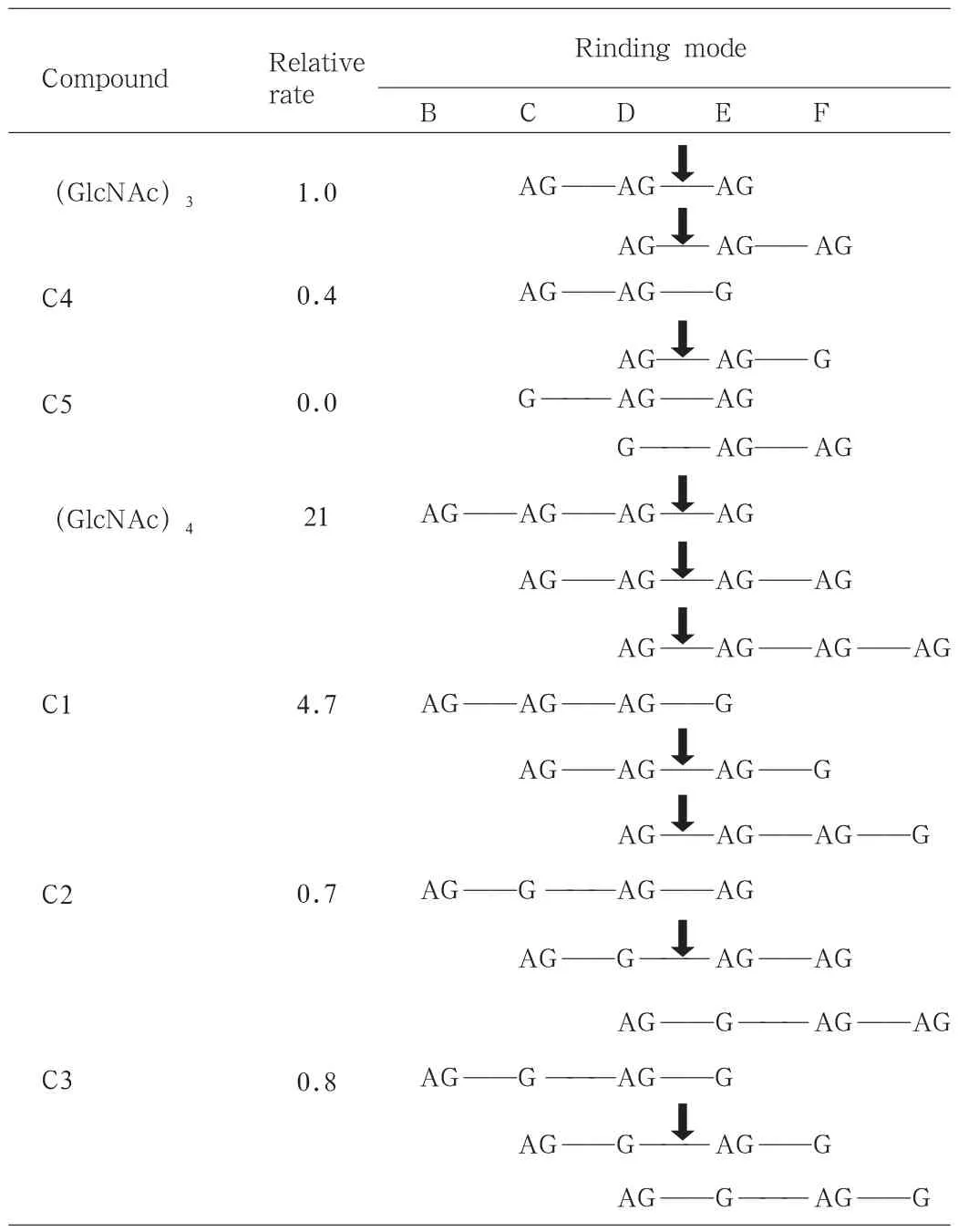
表3 寡糖水解速率及糖链段断裂点
5.4 链段断裂机理分析 从以上的实验情况可知,壳聚糖被溶菌酶水解,是由其乙酰氨基基团与溶菌酶中的活性部位结合,在D环和E环之间断裂导致的,水解产物为N-乙酰氨基葡萄糖和氨基葡萄糖的单糖或寡糖。因此,壳聚糖在生物体内的降解,取决于GlcNAc含量,即乙酰氨基葡萄糖的多少。壳聚糖的脱乙酰度越高,分子链中GlcNAc比例就越低,与C、D、E环的结合概率就越低,线性分子链段越不易断裂,进而导致壳聚糖越不容易被催化水解。可以预见,几乎完全由乙酰氨基葡萄糖组成的甲壳素在人体内是很容易被溶菌酶水解的。但是,脱乙酰度的降低会又会降低壳聚糖的水溶性。因此,在作为人体的植入材料时,为同时保证壳聚糖的水溶性以及水解性,应选择的脱乙酰度在70%左右。脱乙酰度大于85%的壳聚糖难于在体内被溶菌酶催化水解[22]。
5.5 壳聚糖降解产物在人体的代谢 壳聚糖在体内被体液中的溶菌酶催化水解成N-乙酰氨基葡萄糖和氨基葡萄糖的单糖或寡糖,进而被人体吸收。国外以前对氨基葡萄糖的药动力学研究都采用14C标记法[23],结果表明静脉注射后血浆中的氨基葡萄糖放射活性很快消除,在给药120h从尿中回收约28%,粪便回收<1%。肌肉注射给药的药动力学参数与静脉注射相似。
目前,氨基葡萄糖的药动力学研究较为透彻:氨基葡萄糖在被人体吸收后,分布到组织和器官,尤其对关键软骨有亲和性,可弥散到关节软骨基质,到达软骨细胞,在肝、肾、胃壁、小肠、脑、骨骼、肌肉和关节软骨中均可测出氨基葡萄糖,且浓度依次递增。氨基葡萄糖经肝脏代谢为较小的分子,最终分解成二氧化碳、水和尿素,10%从尿液中排除,11%经粪便排出,其余大部分以二氧化碳的形式经呼气道排出[24]。
6 展望
壳聚糖作为具有独特性能的生物材料正越来越引起人们的广泛关注,尤其在生物医用方面。壳聚糖在植入人体后由体液中的溶菌酶水解成寡糖,被机体代谢吸收,并提高机体的免疫力。但是,壳聚糖的体内水解要求其糖苷键中的乙酰氨基基团含量较高,脱乙酰度要求在85%以下,而目前国产的医用级壳聚糖的脱乙酰度通常在90%以上,植入人体后可能将无法完全降解,这需要引起重视。另外,有关于溶菌酶水解壳聚糖后是单一产物还是多种寡糖的混合物有待于进一步研究。
[1] 王霞.壳聚糖的生物改性及其应用研究[D].广州,广东工业大学,2003.
[2] Muzzarelli RAA.Chitin[M].Oxford Pergamon Press,1977.
[3] Sugano M,Watanabe S,Kishi A,et al.Hypocholesterolemic action of chitosans with different viscosity in rats[J].Lipids,1988,3(23):187-191.
[4] 夏文水,吴炎楠.甲壳低聚糖的功能性质[J].无锡轻工大学学报,1996,15(4):297-302.
[5] 郑连英.甲壳低聚糖的研究进展[J].材料科学与工程,1999,17(3): 97-100.
[6] Hutadilok N,Moehimasu T,Hisajnari H,et al.The effect of N-substitution on the hydrolysis of chitosan by an endo-chitosanase[J].Carbohydrate Reserch,1995,268(1):143-149.
[7] 叶丹,连宾.溶菌酶及其应用[J].贵州科学,2003,21(3):67-70.
[8] 李运曼,唐明月,夏雯,等.氨基葡萄糖盐酸盐的抗肿瘤作用[J].中国天然药物,2003,1(4):237-239.
[9] 王哲,乔岩,黄高升,等.氨基葡萄糖及其盐酸盐诱导白血病细胞K562向巨噬细胞样分化[J].中国药理学通报,2003,19(3):290-293.
[10] 邵健,杨宇民.氨基葡萄糖-Cu-(Ⅱ)配合物清除过氧化氢的研究[J].中国海洋药物,2003,95(5):32-34.
[11] 沈若武,龚少兰,王手彪,等.N-乙酰氨基葡萄糖对骨折愈合的实验性研究[J].中国临床解剖学杂志,2004,4:125-128.
[12] Kenichi I,Naoko Y,Sakurai M,et al.A 1H NMR study of a fragment of partially N-deacetylated chitin produced by lysozyme degradation[J]. Carbohydrate research,1992,237:333-338.
[13] Sannan T,Kurita K,Ogura K,et al.Studies on chitin:7. I.R.spectroscopic determination of degree of deacetylation[J]. Polymer,1978,19(4):458-459.
[14] Johnson LN,Phillips DC.Structure of some crystalline lysozyme-inhibitor complexes determined by X-ray analysis at 6 Angstrom resolution[J]. Nature,1965,22(206):761-763.
[15] Pangburn SH,Trescon PV,Helle J.Lysozyme degradation of partially deacetylated chitin,its films and hydrogel[J]. Biomaterials,1982,3:105-108.
[16] Imoto T,Johnson LN,North ACT,et al.A Vertebrate lysozymes in The Enzymes[M].Vol Ⅶ,3rd Edition,(Ed.P.D.Bayer)Academic Press,London and New York,1972:665-868.
[17] Kenichi A,Eiji Ito.The action of lysozyme on partially deacetylated chitin[J].Jounal of Europe BioChemistry,1978,177:3589-3600.
[18] K Amano,Hayashi H.The Action of Lysozyme on Peptidoglycan with N-Unsubstituted Glucosamine Residues[J].Chemical European Journal of Bio chemistry,1977,76(1):299-307.
[19] Park JT,Johnson MJ.A Submicrodetermination of Glucose[J].Journal of Bi ochemistry,1949,181(1):149-151.
[20] Tsuji A,Kinoshita T,Hoshino M.Analytical Chemical Studies on Amino Sugars.II.Deterimation of Hexosamines using 3-Methyl-2-benzothiazolone Hydrazone Hydrochloride[J].Chemical and Pharmaceutical Bulletin,1969,17(7):1505-1510.
[21] Araki Y,Nakatani T,Nakayama K,et al.Occurrence of N -Nonsubstituted Glucosamine Residues in Peptidoglycan of Lysozyme-resistant Cell Walls from Bacillus cereus[J].Journal of Biological Chemist ry,1972,247(19):6312-6322.
[22] 杨艾玲.壳聚糖的研究进展[J].化工中间体,2009,10:17-20.
[23] Setnikar I,Pallumbo R.人体内氨基葡萄糖的药动力学[J].国外医学-药学分册,1994,2(21):122.
[24] 冷艳霞,孙璐,邸欣,等.盐酸氨基葡萄糖片的相对生物利用度及其生物等效性评价[J].沈阳药科大学学报,2006,23(1):6.
Chitosan has been widely used in the pharmaceutical industry, but the premise of its application in the human body is that the degradation mechanism must be clear. Chitosan is the partially deacetylated chitin,can be degraded by acid, oxidation and enzyme while it is degraded into 2-acetamido-2-deoxy-β-D-glucopyranose (GlcNAc) and 2-amino-2-deoxy-β-D-glucopyranose (GlcN) by lysozyme in vivo. Cleavage of the chitosan linkage occurred between site D and site E by the acetyl amino groups bounded to the active sites of lysozyme. Therefore, the number of acetyl groups is the key to the hydrolysis of chitosan.
Chitosan; Degradation; Acetyl amino group; Lysoiyme
10.3969/j.issn.1009-4393.2015.34.003
四川 611731 成都迪康中科生物医学材料有限公司(王刚 李晓萍 王进)
——拉曼光谱和密度泛函理论计算

