壳寡糖对Hela细胞的增殖抑制与诱导凋亡
韩绍芳,周艳芬,2,倪志华,2,武金霞,2,王振山,2
(1.河北大学 生命科学学院,河北 保定 071002;2.河北省生物工程技术研究中心,河北 保定 071002)
壳寡糖(chitooligosaccharide,COS)是由壳聚糖(chitosan)经水解处理后得到的一种低聚糖.因其分子质量较低,水溶性好,易被生物体吸收和降解,因此,在生物体内具有多种生物学活性.研究报道,COS能够调节肠道微生态[1-6],增强机体免疫力[4,7-9],促进骨折愈合[10],抗疲劳并增加运动的耐受力[11-13],降血糖[14]及抗肿瘤作用[15]等.壳寡糖的制备方法包括物理降解法、化学降解法以及酶降解法等.这些制备方法通常得到的壳寡糖分子质量大小不一,因此很难确定壳寡糖的生物学功能并进一步被开发利用.本研究采用金属配位氧化法降解壳聚糖对得到的产物进一步采用732型阳离子交换树脂去除金属离子并对产物进行纯化,得到的COS聚合度为4,经检测其能够有效诱导人肺腺癌细胞A549凋亡[16],且对人肾上皮细胞293T无明显抑制作用.为了进一步明确自制的COS对细胞凋亡的诱导作用及作用机制,本研究以Hela细胞为材料,经COS处理后,对细胞形态及细胞凋亡相关蛋白进行检测,明确COS对细胞的增殖抑制作用和对细胞凋亡的诱导作用,为COS的抗肿瘤作用及其开发利用提供实验支持.
1 材料与方法
1.1 材料与仪器
壳寡糖,本室自制[16];二甲基亚砜(DMSO),Solarbio公司;Hela细胞,河北省肿瘤医院科研中心;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、Wright's-Giemsa染液,Gibco公司;吖啶橙-溴乙锭(AOEB)试剂盒,北京索莱宝科技有限公司;HRP-羊抗兔、HRP-兔抗鼠补体C3(C3)抗体、二氨基联苯胺(DAB)显色剂,Invitrogen公司;兔抗人Bcl-2、鼠单抗Bax、兔抗人Survivin,Santa Cruz公司;异硫氰酸荧光素标记的膜联蛋白V(AnnexinV-FITC)凋亡检测试剂盒,武汉博士德生物工程公司.
CSANVAC冷冻干燥机,Gene公司;M 680 酶标仪,Bio-Rad 公司;倒置显微镜CKX41、荧光显微镜BX53,Olympus公司;流式细胞仪FC500,Beckman Coulter公司.
1.2 实验方法
1.2.1 细胞培养
Hela细胞培养于含体积分数10%的新生胎牛血清、100 U/mL 青霉素、100 U/mL 链霉素的DMEM(dulbecco's modified eagle medium)高糖培养基中,置于37 ℃、饱和湿度、体积分数为5%的CO2培养箱中培养,每2~3d换液传代培养.
1.2.2 MTT 法检测细胞的增值抑制率
取处于对数生长期且台盼蓝拒染率大于95%的Hela细胞,2 000r/min离心10 min,用含体积分数10%胎牛血清的DMEM 高糖培养液将沉淀细胞浓度调为1×105/mL 细胞悬液,每孔加细胞悬液100μL(1×104个细胞)接种于96孔培养板,于37 ℃、饱和湿度、体积分数为5% CO2培养箱中培养,贴壁后吸出培养液,分别加入质量浓度为1.0,2.0,3.0,4.0,5.0,6.0,7.0,10.0mg/mL的COS和不含COS的培养液各200μL,每组设5个复孔,调零孔不加含有Hela细胞的培养液200μL.混匀后分别继续培养12h和24h,向各孔中加入20μL MTT(质量浓度为5.0 mg/mL),相同条件下继续培养4h,每孔加入DMSO 150μL,震荡10min,使形成的甲臜颗粒充分溶解后,于酶标仪490nm 波长测定吸光度值(A 值),按以下公式计算细胞增殖抑制率:
细胞增殖抑制率=(1-A实验组/A对照组)×100%.
1.2.3 Wright's-Giemsa染色观察细胞形态
细胞培养至对数生长期时,用质量分数为0.25%的胰酶(含质量分数为0.01%的EDTA)消化并计数后,调整细胞密度为5×104/mL,加入到盛有盖玻片的6 孔板中,补足2 mL 的完全培养液,每孔加入约1×105个细胞,置于37 ℃、饱和湿度、体积分数为5% CO2培养箱中过夜培养后,吸去培养液,用PBS 洗3次,每次2min,实验组更换含有5.0mg/mL COS的培养液,阴性对照组加入不含COS的培养液,每组设5个复孔,相同条件下继续培养24h 后,再次用PBS 洗涤3 次,每次2 min,体积分数95%的乙醇固定10min,Wright's-Giemsa染色20min,显微镜下观察.
1.2.4 AO-EB染色法观察细胞凋亡形态
按1.2.3方法处理细胞并爬片,分别用PBS洗3次,加入AO/EB 染色液2mL(1mL PBS含有20μL的AO/EB),染色5min,吸出染液,PBS洗3次,立即将各组Hela细胞爬片置于荧光显微镜下观察细胞的形态变化,并拍照.
1.2.5 Annexin V-FITC/PI双染法定量分析细胞的凋亡率
将处于对数生长期的细胞以5×105/mL 的密度接种于25mL培养瓶中,细胞过夜贴壁后,实验组加入含有质量浓度为5.0mg/mL的COS培养液3mL,对照组加入不含COS的等量完全培养液,培养24h后.按照AnnexinV-FITC及PI试剂盒操作步骤,用不含EDTA 的胰酶消化收集,2 000r/min,离心5min.用冷PBS 洗涤细胞2次(2 000r/min,5min).超纯水1:4稀释结合缓冲液,以稀释的结合缓冲液重悬细胞,调整细胞浓度为1×106/mL.取195μL 细胞悬液,加入5μL AnnexinV-FITC 混匀,4 ℃避光条件下孵育15min,PBS洗细胞1次,再以190μL稀释的结合缓冲液重悬,加入10μL PI轻轻混匀于4 ℃避光条件下孵育5min,立即上流式细胞仪进行检测,光源为488nm 氩离子激光器,FITC受激发后发绿色荧光,PI发红色荧光.实验重复3次,计算细胞凋亡率.
1.2.6 免疫组织化学法检测凋亡相关蛋白的表达情况
按1.2.3方法处理细胞并爬片,加入体积分数4%的多聚甲醛(PFA)室温固定30 min.用体积分数0.5% Triton X-100孵育20min,勿洗,直接用5mg/mL 的牛血清白蛋白(BSA)37 ℃封闭30min,分别加入稀释倍数为1:400的Bax,Bcl-2,Survivin-抗1mL,4 ℃孵育过夜,PBS洗3次,每次2min.然后分别加入稀释倍数为1:400的HRP-羊抗鼠抗体和HRP-兔抗鼠补体C3(C3)抗体1mL,37 ℃避光孵育1h,PBS洗3次,每次2min.DAB显色8min,10μg/mL苏木素复染5min,显微镜下观察.
1.2.7 免疫组化染色阳性结果评估
阳性细胞产物染色呈黄色至棕黄色,主要定位于细胞胞质内.采用双盲法随机选择5个典型视野,每个视野内随机计数50个细胞,根据阳性细胞百分率(A)及阳性细胞着色强度(B)进行免疫组化评分[13,17].阳性细胞百分率A 分为5个等级:0~1%为0分,2%~10%为1分,11%~50%为2分,51%~80%为3分,81%~100%为4分;阳性细胞显色强度B 分为4个等级:0分为阴性,1分为弱阳性,2分为阳性,3分为强阳性,免疫组化最后得分(IHS):每个视野内阳性细胞着色细胞百分率与着色程度相乘得分即为该视野的最后得分(IHS=A×B).每张片子5个视野的平均分值为该标本的最后染色分值,将最后平均染色分值小于1者记为染色阴性标本,大于1者记为染色阳性标本.
1.2.8 统计学分析
采用SPSS19.0软件进行统计学分析,实验数据用均数±标准差(x±s)表示,组间比较采用单因素方差检验,以P<0.05为差异有统计学意义.
2 结果
2.1 壳寡糖对Hela细胞的增殖抑制作用
与阴性对照组相比较,COS处理组细胞12h和24h后,在1.0 ~5.0 mg/mL 内,随着作用时间的延长、质量浓度的升高,COS对Hela细胞增殖的抑制率逐渐增强,且呈量效和时效的依赖关系,当质量浓度为5.0mg/mL并作用24h时,COS对Hela细胞的增殖抑制率达到52.15%(P<0.01),且差异显著(表1),COS质量浓度在6.0,7.0,10.0mg/mL时,处理12h 和24h后,Hela细胞增殖抑制率均有所下降,且抑制水平相当.因此,本研究选用COS质量浓度为5.0mg/mL处理24h进行后续实验.
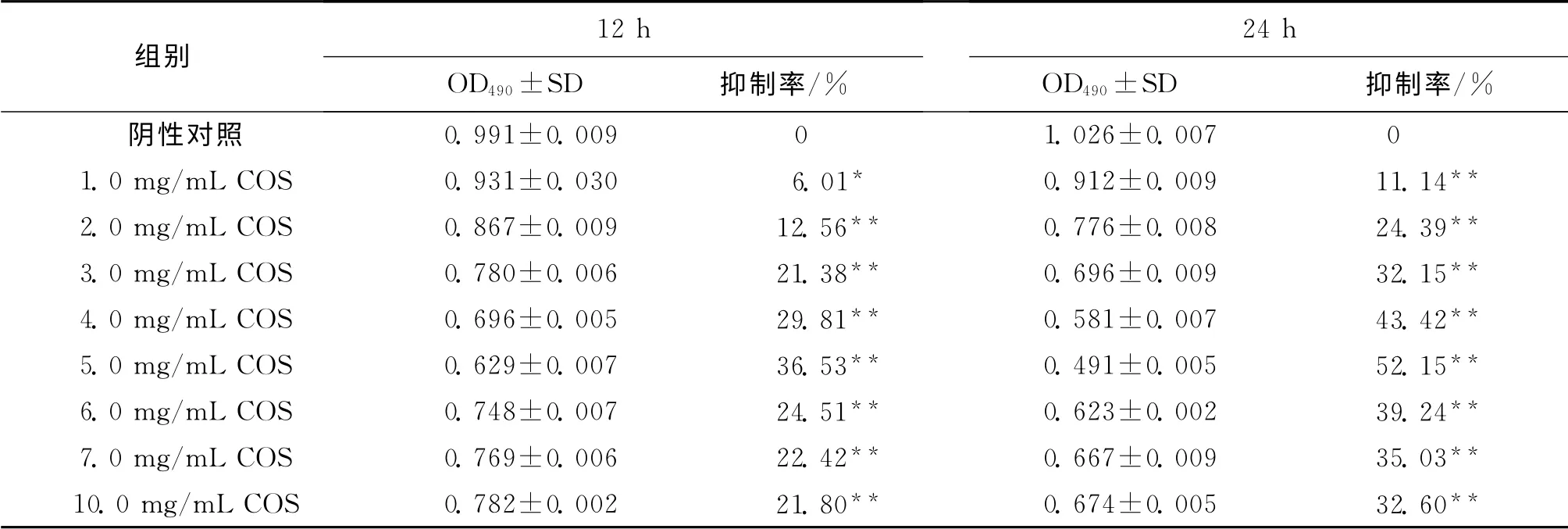
表1 COS对Hela细胞增殖的抑制作用Tab.1 Effect of inhibiting proliferation by COS on Hela cell
2.2 壳寡糖对Hela细胞凋亡形态学的影响
COS处理细胞24h后,经Wright's-Giemsa染色观察,对照组细胞膜完整,核仁及染色质分布在细胞核中,实验组细胞数量明显减少,细胞形态发生变化,主要表现为细胞贴壁能力减弱、细胞质萎缩、体积变小、部分呈现圆形、出现凋亡小体(图1).
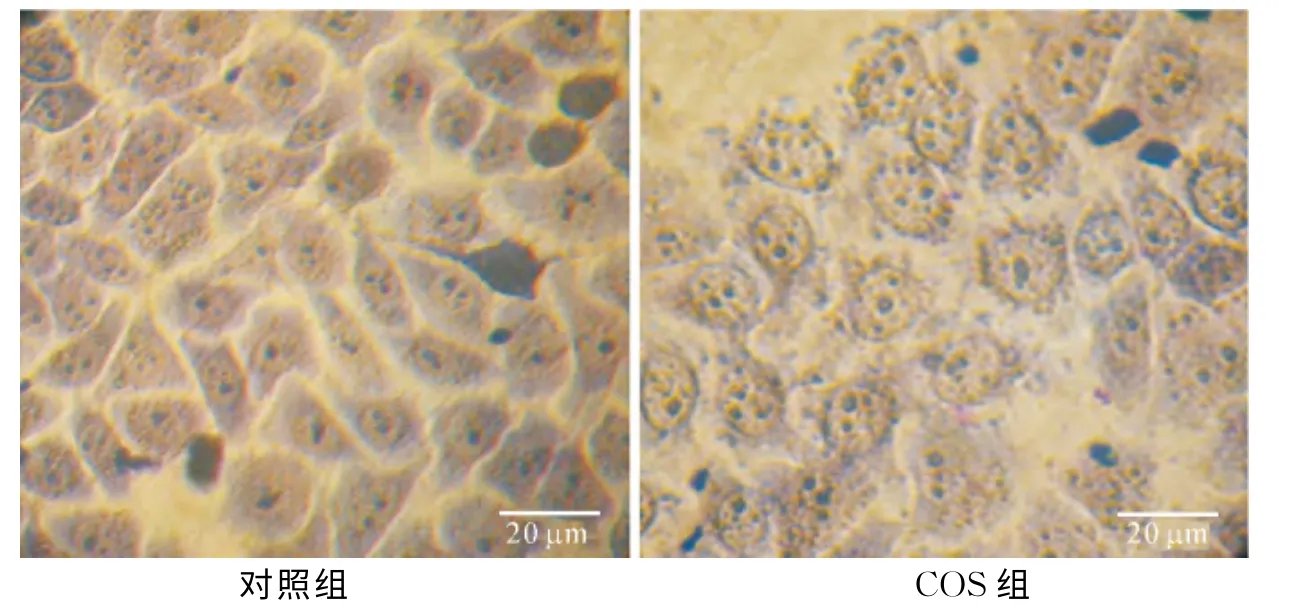
图1 Wright's-Giemsa染色结果Fig.1 Results of Wright's-Giemsa staining
经AO-EB染色,荧光显微镜下观察(图2),对照组细胞形态正常,核着色均匀,为绿色荧光,实验组观察到部分核染色质固缩状和圆珠状,为早期凋亡细胞,部分核染色质出现橘红色,为晚期凋亡细胞.这些结果表明,经COS处理的Hela细胞在形态上出现了细胞凋亡,说明COS能够诱导Hela细胞凋亡.

图2 AO-EB染色结果Fig.2 Results of AO-EB staining
2.3 壳寡糖诱导Hela细胞凋亡率的定量分析
COS处理细胞经AnnexinV-FITC/PI染色,流式细胞仪检测其凋亡率及坏死率(图3).图中左下象限(LL)代表活细胞量(FITC-/PI-),左上象限(UL)代表细胞处理过程中出现的损伤细胞(FITC-/PI+),右下象限(LR)代表早期凋亡细胞(FITC+/PI-),右上象限(UR)代表晚期凋亡细胞(FITC+/PI+).对照组与COS组相应的各象限细胞存活状态见表2.经COS 处理后的实验组细胞凋亡率为31.75%,坏死率为18.79%,P<0.05,差异具有统计学意义.
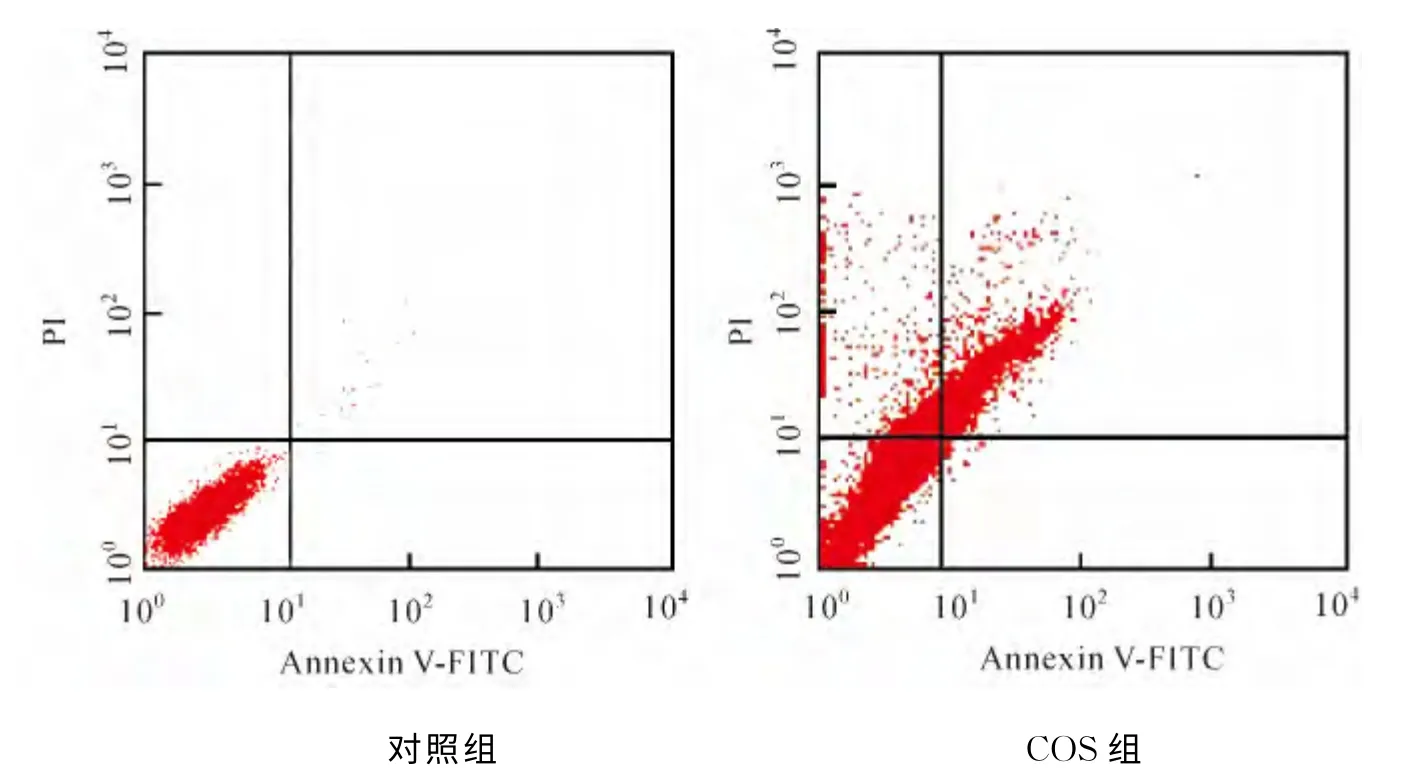
图3 AnnexinV-FITC/PI双染结果Fig.3 Results of AnnexinV-FITC/PI duble staining

表2 AnnexinV-FITC/PI双染细胞存活状态统计Tab.2 Statistics of AnnexinV-FITC/PI double staining of cell survival state
2.4 壳寡糖对Hela细胞中Bax,Bcl-2,Survivin表达量的影响
细胞爬片经COS处理后,分别检测Bax,Bcl-2,Survivin蛋白表达量(图4),与对照组相比,COS组的Bax蛋白细胞质着色增强,表明Hela经COS处理后细胞质中Bax表达量增加;Bcl-2蛋白与Survivin蛋白COS组细胞质着色程度较对照组明显减轻,表明Hela细胞经COS处理后细胞质中Bcl-2,Survivin表达量均降低.按1.2.7方法对免疫组化得分进行评估(表3),COS组的Bax IHS值明显高于对照组,Bcl-2,Survivin IHS值明显低于对照组,说明经COS处理后Hela细胞内Bax表达量明显上调,而Bcl-2和Survivin表达量明显下调.

表3 阳性细胞记数及免疫组织化学评分(5个视野)Tab.3 Positive cell count and immunohistochemistry score(five horizons)
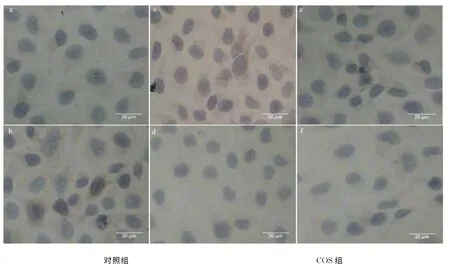
图4 COS处理Hela细胞后对Bax,Bcl-2,Survivin表达量的影响Fig.4 Impact on Bax,Bcl-2,Survivin expression of Hela cells after COS treatment
3 讨论
COS是由2~10个氨基葡萄糖或N-乙酰氨基葡萄糖经β-1,4糖苷键连接而成的线性寡糖,基于其优良的生物学特征,近年来被人们广泛关注.已有研究证实,COS能够诱导白血病HL-60细胞[18]、结肠癌LoVo细胞[15]凋亡,能够抑制肾肿瘤细胞OS-RC-2[19]、肝癌SMMC-7721细胞[20-21],S180肉瘤细胞[22]、膀胱癌细胞[23]的增殖并且促进其凋亡等.本实验采用金属配位氧化法制备的平均聚合度为4的COS作用于Hela细胞,通过MTT 法,确定5.0mg/mL的COS作用24h,对Hela细胞的增殖抑制率达到52.15%.作者进一步采用Wright's-Giemsa染色、AO-EB染色观察COS处理后细胞形态学上的变化,结果表明,COS组细胞产生了凋亡现象,如细胞体积变小,细胞核固缩,变圆,出现凋亡小体,AO-EB 染色出现早期和晚期凋亡细胞.采用流式细胞技术定量分析COS诱导Hela细胞凋亡情况,结果表明,细胞凋亡率为31.75%,且具有统计学意义.以上实验结果表明,自制的COS可抑制Hela细胞增殖并且能够诱导细胞凋亡.
细胞凋亡是一种主动的程序性死亡,涉及一系列基因的激活、表达以及调控等.在细胞凋亡相关蛋白的研究中,Bcl-2蛋白家族备受关注.按其对凋亡正、负调控作用,可将Bcl-2家族成员分为两类:一类为凋亡促进蛋白,如Bax,Bcl-xs,Bad等;另一类为凋亡抑制蛋白,如Bcl-2和Bcl-x2,Bcl-xl等[22].Bcl-2为重要的抗凋亡蛋白,对细胞凋亡担负着重要的作用[24-25].Bax可以与Bcl-2形成异源二聚体,从而阻止Bcl-2的抗凋亡作用[26].Survivin是近来发现的IAP家族新成员[27].研究表明,Survivin是迄今发现最强的凋亡抑制因子[28],其可直接作用于效应蛋白caspase-3和caspase-7,也可通过P21间接抑制caspase[29],从而阻断细胞的凋亡过程.诱导肿瘤细胞凋亡是治疗肿瘤的一种手段.本研究采用免疫组织化学法,发现自制的COS处理Hela细胞后Bax表达量上调,Bcl-2和Survivin表达量下调,表明COS对Hela细胞作用是通过抑制抗凋亡蛋白Bcl-2的表达,抑制caspase家族的抑制剂Survivin蛋白的表达,上调促凋亡蛋白Bax的表达从而促进肿瘤细胞的凋亡,为COS抗肿瘤作用机制及其开发利用提供实验支持.
[1] 严钦,沈月新,王造.壳寡糖的制备及其抑菌性能研究[J].食品研究与开发,2003,24(2):26-29.YAN Qin,SHEN Yuexin,WANG Zao.Preparation of chitooligosaccharide and its antimicrobial activity[J].Food Research and Developent,2003,24(2):26-29.
[2] 刘碧源,高仕瑛,李邦良,等.壳寡糖抗菌活性的实验研究[J].中国生化药物杂志,2003,24(2):73-75.LIU Biyuan,GAO Shiying,LI Bangliang,et al.Study on antimicrobial activity of chitooligosaccharide[J].Chinese Journal of Biochemical Pharmaceutics,2003,24(2):73-75.
[3] 竺国芳,赵鲁杭.几丁寡糖和壳寡糖的研究进展[J].中国海洋药物,2000,19(3):43-46.ZHU Guofang,ZHAO Luhang.The progress about study of N-acetyl-chitooligosaccharides and chitooligosaccharides[J].Chinese Journal of Marine Drugs,2000,19(3):43-46.
[4] 王秀武,杜昱光,白雪芳,等.壳寡糖对肉仔鸡肠道主要菌群、小肠微绒毛密度、免疫功能及生产性能的影响[J].动物营养学报,2003,15(4):32-35.WANG Xiuwu,DU Yuguang,BAI Xuefang,et al.The effect of oligochitosan on broiler gut flora,microvilli density,immune function and growth performance[J].Acta Zoonutrimenta Sinica,2003,15(4):32-35.
[5] HUANG R L,YIN Y L,WU G Y,et al.Effect of dietary oligochitosan supplementation on ileal digestibility of nutrients and performance in broilers[J].Poult Sci,2005,84(9):1383-1388.
[6] 何亚男,佘锐萍,吴襟,等.半乳甘露寡糖和壳寡糖对大鼠肠黏膜结构、碱性磷酸酶活性影响的动态观察[J].科学技术与工程,2006,6(2):131-135.HE Yanan,SHE Ruiping,WU Jin,et al.Effects of galacto-manno-oligosaccharides and oligochitosan on the structure of gut mucosa and the activity of AKP in rats[J].Science Technology and Engineering,2006,6(2):131-135.
[7] 陈虹,侯伟革,臧素敏.壳寡糖对鹌鹑生产性能和免疫功能的影响[J].经济动物学报,2006,10(1):18-21.CHEN Hong,HOU Weige,ZANG Sumin.Affect of oligochitosan on production performance and immune function of quail[J].Journal of Economic Animal,2006,10(1):18-21.
[8] 纪莹,赵轶,周翔,等.壳寡糖的制备及组分分析[J].中国现代应用药学,2003,20(3):195-196.JI Ying,ZHAO Yi,ZHOU Xiang,et al.The preparation of chitosan oligomer and the components analysis[J].Chinese Journal of Modern Applied Pharmacy,2003,20(3):195-196.
[9] 吴海明,华晓阳,何登全.壳寡糖抗肿瘤作用及免疫调节机理的研究[J].中华医学研究杂志,2005,5(8):729-732.WU Haiming,HUA Xiaoyang,HE Dengquan.Mechanism of anti-tumor and immune regulation of oligochitosan[J]Journal of Chinese Medicine Research,2005,5(8):729-732.
[10] 张伟,沈若武,王守彪.壳寡糖对骨折成骨细胞内骨形态发生蛋白的影响[J].齐鲁医学杂志,2005,20(3):247-248.ZHANG Wei,SHEN Ruowu,WANG Shoubiao.Effect of chitooligosaccharide on intraosteoblast bone morphogenetic protein in fractures[J].Medical Jurnal of Qilu,2005,20(3):247-248.
[11] 陈筱春,文质均,熊静宇.甲壳寡糖抗小鼠运动性疲劳的实验研究[J].湛江师范学院学报,2005,26(3):53-55.CHEN Xiaochun,WEN Zhijun,XIONG Jingyu.The effect of chitooligosaccharide on the delay of fatiguein trained mice[J].Journal of Zhanjiang Normal College,2005,26(3):53-55.
[12] JEONG H W,CHO S Y,KIM S,et al.Chitooligosaccharide induces mitochondrial biogenesis and increases exercise endurance through the activation of Sirt1and AMPK in rats[J].PLoS ONE,2012,7(7):e40073.
[13] CHO S Y,LEE J H,SONG M J,et al.Effects of chitooligosaccharide lactate salt on sleep deprivation-induced fatigue in mice[J].Biol Pharm Bull,2010,33(7):1128-1132.
[14] JU C,YUE W,YANG Z,et al.Antidiabetic effect and mechanism of chitooligosaccharides[J].Biol Pharm Bull,2010,33(9):1511-1516.
[15] 柳红,崔涛,刘莹.壳寡糖作用后人结肠癌LoVo细胞株bcl-2、bax表达改变[J].徐州医学院学报,2005,25(1):1-3.LIU Hong,CUI Tao,LIU Ying.Effect of chitooligosaccharide on the growth of human carcinoma of colon LoVo cell line[J].Acta Academic Medicine Xuzhou,2005,25(1):1-3.
[16] 杨欢欢,周艳芬,武金霞,等.壳寡糖诱导肺癌细胞A549凋亡及其机制初探[J].时珍国医国药,2013,2(24):268-270.YANG Huanhuan,ZHOU Yanfen,WU Jinxia,et al.The exploration of oligochitosan induces apoptosis in lung cancer cell line A549and its mechanism[J].Lishizhen Medicine and Materia Medica Research,2013,2(24):268-270.
[17] SOSLOW R A,DANNENBERG A J,RUSH D,et al.COX-2is expressed in human pulmonary,colonic,and mammary tumors[J].Cancer,2000,89(12):2637-2645.
[18] 徐广飞,李春建,仲齐庆,等.水溶性壳寡糖对人白血病细胞诱导分化的影响[J].南通大学学报,2006,26(4):247-248. XU Guangfei,LI Chunjian,ZHONG Qiqing,et al.The effect of differentiation on induction in human leukem ia cells by chitooligosaccharide[J].Journal of Nantong University,2006,26(4):247-248.
[19] 徐文华,韩宝芹,孔晓颖,等.壳寡糖的抑瘤作用及其作用机制研究[J].中国海洋大学学报,2013,9(43):54-59.XU Wenhua,HAN Baoqin,KONG Xiaoying,et al.Study on anti-tumor effect of chitooligosaccharides and its mechanism[J].Periodical of Ocean University of China,2013,9(43):54-59.
[20] 许青松,魏鹏,窦江丽,等.壳寡糖抑制肝癌细胞SMMC27721的增殖及其机制探讨[J].天然产物研究与开发,2009,21:152-154.XU Qingsong,WEI Peng,DOU Jiangli,et al.Studies on the inhibitory effects of oligochitosan on SMMC27721cells of hepatocarcinoma[J].Nat Prod Res Dev,2009,21:152-154.
[21] 罗福文,万莹,张翠丽,等.壳寡糖对肝癌细胞SMMC27721中Bcl-2和Caspase-3表达的影响[J].中国微生态学杂志,2009,10(21):906-909.LUO Fuwen,WAN Ying,ZHANG Cuili,et al.Effect of oligochitosan on the expression of Bcl-2and Caspase-3in SMMC27721cells of hepatocarcinoma[J].Chinese Journal of Microecolog,2009,10(21):906-909.
[22] 刘清华,孔庆兖,柳红.壳寡糖对S180肉瘤细胞凋亡、细胞周期以及凋亡相关蛋白Bcl-2、Bax的影响[J].徐州医学院学报,2006,26(4):290-293.LIU Qinghua,KONG Qingyan,LIU Hong.Effects of chitooligosaccharide on tumor apoptosis,cell cycle and changes of apoptosis-related proteins Bcl-2and Bax in sarcoma 180cells[J].Acta Academic Medicine Xuzhou,2006,26(4):290-293.
[23] HASEGAWA M,YAGI K,IWAKAWA S,et al.Chitosan induces apoptosis via caspase-3activation in bladder tumor cells[J].Jpn J Cancer Res,2001,92(4):459-466.
[24] KROEMER G,GALLUZZI L,BRENNER C.Mitochondrial Membrane Permeabilization in Cell Death[J].Physiol Rev,2007,87(1):99-163.
[25] TESTA U,RICCIONI R.Deregulation of apoptosis in acute myeloid leukemia[J].Haematologica,2007,92(1):81-94.
[26] BEERHEIDE W,TAN Y J,TENG E,et al.Downregulationof proapoptotic proteins Bax and Bcl-X(S)in p53overexpressing hepatocellular carcinomas[J].Biochem Biophys Res Commun,2000,273(1):54-61.
[27] AMBROSINI G,ADIDA C,ALTIERI D C.A novel anti-apoptosis gene,survivin,expressed in cancer and lymphoma[J].Nat Med,1997,3(8):917-921.
[28] IKEHARA M,OSHITA F,KAMEDA Y,et al.Expression of survivin correlated with vessel invasion is a marker of poor prognosis in small adenocarcinoma of the lung[J].Oncol Rep,2002,9(4):835-838.
[29] SUZUKI A,ITO T,KAWANO H,et al.Survivin initiates procaspase 3/p21complex formation as a result of interaction with Cdk4to resist Fas-mediated cell death[J].Oncogene,2000,19(10):1346-1353.

