巢式荧光PCR结合高分辨熔链曲线检测结核分枝杆菌及其亚型
邵雪君,朱宏,黄莉莉,陶云珍,徐俊,何萍,汪健
(苏州大学附属儿童医院1.检验科,2.普外科,江苏苏州215003)
巢式荧光PCR结合高分辨熔链曲线检测结核分枝杆菌及其亚型
邵雪君1,朱宏1,黄莉莉1,陶云珍1,徐俊1,何萍1,汪健2
(苏州大学附属儿童医院1.检验科,2.普外科,江苏苏州215003)
目的:建立一种检测结核分枝杆菌及其亚型的PCR方法。方法:根据人型及牛型结核分枝杆菌硝酸还原酶(nitrate reductase,narGHJI)基因启动子区215位上T-C的转换,设计巢式荧光PCR结合高分辨熔链曲线检测结核分枝杆菌及其亚型,测定其敏感性,并用琼脂糖凝胶电泳验证观察巢式荧光PCR产物的特异性。以人型结核杆菌标准株(H37Ra)、卡介苗培养菌液、人型临床分离株和牛型临床分离株为标本,高分辨熔链曲线分析结核分枝杆菌亚型正态化熔链曲线及熔链温度。结果:巢式荧光PCR特异性地检出结核分枝杆菌narGHJI基因,其敏感性比荧光定量PCR高10倍左右;人型及牛型结核分枝杆菌narGHJI基因PCR产物的高分辨熔链曲线分成2个不同组合,熔链温度分别为(83.08±0.08)℃和(83.96±0.09)℃,差异有统计学意义(t=217.23,P<0.05)。结论:成功建立检测结核分枝杆菌及其亚型的巢式荧光PCR结合高分辨熔链曲线法。
结核分枝杆菌;巢式PCR;熔链曲线;亚型
结核分枝杆菌感染是威胁公众健康的疾病之一。据中国疾病预防控制中心公共卫生科学数据中心统计数据显示(http://www.phsciencedata.cn),我国2012年肺结核发病总数为951 508例,2013年达129万多,而2014年统计每月有10万左右的发病例数。结核分枝杆菌的感染常采用结核菌素纯蛋白衍生物试验(PPD)或胸部X线检查来筛检,PPD阳性结果仅表示可能有活动性结核分枝杆菌感染,而胸部X线检查发现率较低,为0.05%~2.63%[1-2]。若能敏感、特异地从体液或痰标本中检出结核分枝杆菌,则能为结核的早期诊断及干预治疗提供确切依据。另外,若能对两类主要的结核分枝杆菌—人型及牛型结核杆菌做出分型,则能对理解结核的感染源、感染途径等提供重要信息,有利于结核的防治。因此,我们拟建立一种荧光PCR方法,同时根据结核杆菌硝酸还原酶基因(nitrate reductase,narGHJI)启动子区单核苷酸多态性,设计特异性引物,采用高分辨熔链曲线分析结核分枝杆菌亚型,以敏感、特异、快速地检测临床标本中是否存在人型或牛型结核分枝杆菌。
1 材料与方法
1.1 卡介苗培养及菌落计数
将卡介苗冻干粉剂0.25 mg(苏州市疾病预防控制中心惠赠)溶于200μL生理盐水,取100μL接种于分枝杆菌液体培养基(美国BD公司)中,于35℃培养箱培养15 d,达到对数生长期。测定并调整菌液浓度D(600 nm)=0.45(BiomerieuX分光光度计)。将菌液按1∶1 000稀释后,取10μL接种于罗氏培养基(珠海贝索生物技术有限公司),置35℃培养箱培养20 d,进行菌落计数。2份同一稀释度菌液各重复3次。
1.2 卡介苗菌液基因拷贝定量
取100μL卡介苗菌液[D(600 nm)=0.45],采用2种方法抽提核酸。一种为直接裂解法,按结核分枝杆菌基因荧光定量试剂盒(达安基因)说明书操作:取100μL卡介苗菌液,12 000 r/min离心5 min,弃上清液,加入50μL裂解液,98℃孵育10 min,冷却,12 000 r/min离心5 min,上清液即为检测待用的核酸样本。另一种采用硅胶膜离心柱法(北京天根生化科技有限公司),具体操作按说明书进行。两种不同方法获得的核酸均采用结核分枝杆菌基因荧光定量试剂盒(达安基因)检测结核分枝杆菌基因拷贝数(拷贝/mL)。同一菌液2种方法各重复10管。
1.3 巢式荧光PCR检测结核分枝杆菌
1.3.1 样本 取上述膜抽提法获得的卡介苗核酸分别按1∶1,1∶10,1∶100,1∶1 000,1∶10 000,1∶100 000,1∶1 000 000进行梯度稀释。
1.3.2 巢式荧光PCR 根据Stermann等[3]方法稍作修改检测结核杆菌的narGHJI基因。其中巢式荧光PCR第1轮扩增上游引物为5′-AACCGACGGTGTGGTTGAC-3′,下游引物为5′-ATCTCGATGGATGGGCGTC-3′,25μL反应体系含双蒸水15.7μL,10×缓冲液2.5μL,MgCl2(25 mmol/L)3μL,dNTP 0.5μL,上下游引物(终浓度为10μmol/L)各0.5 μL,Taq酶(5 U/μL,Promega公司)0.3μL,DNA模板2μL;反应条件采用touch-down法:95℃变性10 min,95℃15 s,68℃至62℃15 s,72℃延伸30 s,45个循环(Bio-Rad iCycle公司);其中前5个循环的退火温度设置在68℃,随后每个循环下降1℃直至62℃。第2轮扩增上游引物为5′-CGCCGTCAACTTGGTTAGA-3′,下游引物为5′-GTCCTGCCCGGAAGTTGT-3′,采用Roche公司LightCycler 480 High Resolution Melting Master试剂盒,反应体系含Master Mix 10μL,MgCl2(25 mmol/L)1.0μL,上下游引物(终浓度为10μmol/L)各0.25μL,双蒸水3.5μL,第1轮PCR稀释产物(1∶100稀释)5μL。反应条件为95℃15 min热启动,95℃5 s,54℃10 s,40个循环(Roche LightCycler 480)。每个稀释度均重复3管。
1.3.3 琼脂糖凝胶电泳 对巢式荧光PCR第2轮产物进行琼脂糖凝胶电泳。根据第2轮PCR引物设计,阳性扩增产物为108 bp,观察在相应片段位置是否有特异性产物。
1.3.4 巢式荧光PCR敏感性评价 对上述样本同步采用结核分枝杆菌基因荧光定量试剂盒(达安基因)检测,以评价与巢式荧光PCR检测的敏感性差异。达安基因试剂检测按说明书判断阴性与阳性;巢式荧光PCR以Ct值≤35,扩增曲线呈明显S型,且阴性对照不出现扩增曲线来判断为阳性。
1.4 巢式荧光PCR结合高分辨熔链曲线检测分析结核分枝杆菌及其亚型
1.4.1 样本 人型结核杆菌标准株(H37Ra)、卡介苗培养菌液、人型临床分离株和牛型临床分离株各8份,高温、高压灭活后采用硅胶膜离心柱法抽提核酸。
1.4.2 巢式荧光PCR结合高分辨熔链曲线分析巢式荧光PCR同“1.3.2”,在第2轮PCR结束后增加高分辨熔链曲线分析。具体为95℃变性1 min,40℃1 min,65~95℃连续监测荧光,升温速度为0.02℃/s,每2 s监测1次(Roche LightCycler480)。通过仪器自带的软件获得各个样本的正态化高分辨熔链曲线及相应的熔链温度。每份样本均重复3管。由于人型及牛型结核分枝杆菌在narGHJI基因启动子区215位上存在T-C转换(人型为T,牛型为C)[3],故两者熔链温度存在差异,并呈现不同的正态化高分辨熔链曲线。
1.5 统计学分析
采用SPSS 20.0软件进行数据分析,卡介苗菌液核酸直接抽提法与膜抽提法的基因定量,人型与牛型结核分枝杆菌PCR产物熔链温度的差异采用独立样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 卡介苗菌落计数及基因拷贝定量
D(600 nm)=0.45的卡介苗菌液1∶1 000稀释后,每10μL在Roche培养基上的菌落数分别为29、29、28、28、27、26 CFU。因此,D(600 nm)=0.45的卡介苗菌液的活菌浓度为2.8×106CFU/mL。
直接裂解法及硅胶膜离心柱法提取的卡介苗核酸基因拷贝数分别为(1.33±0.24)×106拷贝/mL和(1.57±0.35)×106拷贝/mL,差异无统计学意义(P>0.05)。
2.2 巢式荧光PCR检测结核分枝杆菌及其敏感性
建立的巢式荧光PCR荧光扩增曲线如图1所示,卡介苗菌液扩增曲线呈明显S型,阴性对照未出现荧光增加;琼脂糖凝胶电泳验证阳性扩增产物在108 bp处,无引物二聚体及其他非特异性条带,提示巢式荧光PCR扩增反应体系获得了结核分枝杆菌narGHJI基因特异性扩增片段。
巢式荧光PCR和达安基因荧光定量试剂检测不同稀释度的卡介苗核酸[硅胶膜离心柱法获得,初始浓度为(1.57±0.35)×106拷贝/mL],达安基因荧光定量试剂的检出限为1∶10 000,对应的预期拷贝数为1.57×102拷贝/mL,而巢式荧光PCR的检出限为1∶100 000,对应的预期拷贝数为1.57×10拷贝/mL(图1)。巢式荧光PCR产物采用琼脂糖凝胶电泳在1∶1~1∶10 000管中处观察到108 bp长度的阳性扩增产物,检出敏感性与达安基因荧光定量试剂一致。由此可见,巢式PCR比达安基因荧光定量试剂及巢式荧光PCR产物采用琼脂糖凝胶电泳检测相对高一个数量级,相对敏感性最高。
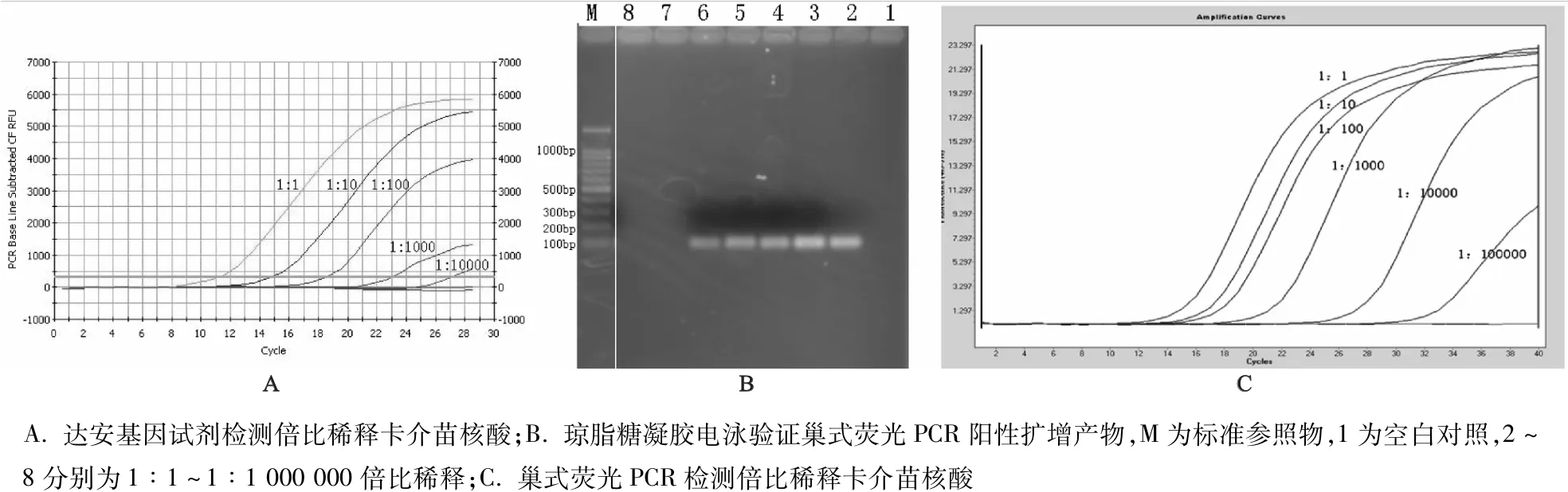
图1 不同方法检测结核分枝杆菌及其敏感性、特异性
2.3 巢式荧光PCR结合高分辨熔链曲线检测分析结核分枝杆菌及其亚型
巢式荧光PCR特异性地检出H37Ra、卡介苗培养菌液、人型临床分离株和牛型临床分离株narGHJI基因,阳性扩增曲线均呈典型S型,阴性空白对照扩增曲线未出现荧光增加。结合高分辨熔链曲线分析,由于人型和牛型结核杆菌narGHJI基因启动子区215位上存在T-C转换,故二者熔链曲线图分成2个明显不同的组合,其熔链曲线的正态化图如图2所示。人型及牛型结核杆菌PCR产物的熔链温度分别为(83.08±0.08)℃和(83.96±0.09)℃,差异有统计学意义(t=217.23,P<0.05)。
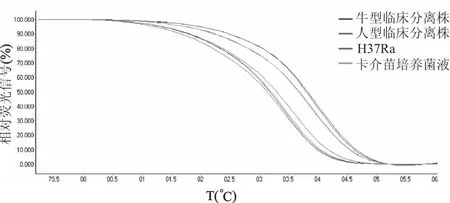
图2 巢式荧光PCR结合高分辨熔链曲线检测结核分枝杆菌亚型
3 讨论
结核分枝杆菌常规的检测方法有抗酸染色镜检法及培养法;抗酸染色镜检法样本中通常细菌需104~106/mL可获阳性结果;培养法相对更加敏感,但仍需要10~100个细菌/mL才可获得诊断,且获得结核分枝杆菌的阳性培养结果约需3~6周[4]。中国疾病预防控制中心公共卫生科学数据中心2012统计数据显示,在951 508例肺结核发病总数中,除81 744例未进行痰检外,涂片或培养检出结核杆菌的总数为348 773例,检出率为40.10%(348 773/869764)。因此,一方面说明涂片或培养检出结核杆菌的阳性率并不高,需采用敏感性更高的方法去检测;另一方面,此统计数据仅为肺结核发生情况,还不包括肺外结核,如骨、生殖系统等,在一定程度上还低估了结核的阳性率。
目前,PCR由于具有敏感、特异和快速等特点而逐渐成为检测结核分枝杆菌的有效方法[5-6]。考虑到有些标本中的结核杆菌含量很低,尤其是潜伏感染,故采用巢式PCR或荧光PCR具有更高的敏感性。另外,世界范围内人型结核分枝杆菌是人类结核的主要病原,牛型结核分枝杆菌引起的人类结核约占到所有人类结核病例的3.1%左右,引起肺或肺外结核分别占2.1%及9.4%[7]。发展中国家的人类新发的结核病例中约10%~15%由牛型结核杆菌引起[8]。所有的牛型结核杆菌对一线抗结核药物——吡嗪酰胺天然耐药[8-9],早期鉴别牛型结核杆菌亚型就可避免采用含该药的四联疗法,减少耐药菌株的产生。
传统的荧光PCR,包括采用荧光染料或TaqMan探针等,与巢式PCR后琼脂糖凝胶电泳观察通常具有相似的敏感性,这与本研究结果一致;但在巢式PCR的第2轮设计中采用荧光PCR,则可进一步提高检测的灵敏度,实验结果显示巢式荧光PCR比传统的荧光PCR及巢式PCR后琼脂糖凝胶电泳高出一个数量级,因此,采用巢式荧光PCR在进一步提高检测灵敏度上是切实可行的。另外,我们根据人型和牛型结核杆菌narGHJI基因启动子区215位上T-C的转换及相应PCR产物熔链温度间的差异,通过高分辨熔链曲线分析,可有效鉴别人型和牛型结核杆菌。
商品化的试剂盒内含的核酸抽提一般采用直接裂解法,对一些特殊标本可能并不适用;此外,原材料直接裂解不能有效去除内含的PCR反应可能抑制物,而硅胶膜离心柱法可排除杂质的影响,避免可能存在的PCR反应抑制物,获得高纯度的核酸材料。因此,我们比较了两种核酸抽提方法,虽然膜抽提法的均值相对高于直接裂解法,但两者差异无统计学意义,因此,实际操作中可根据标本来源采用合适的核酸抽提方法。
总之,我们建立的巢式荧光PCR结合高分辨熔链曲线检测结核分枝杆菌及其亚型的方法,既可敏感、特异地检出结核分枝杆菌,有利于早期筛检出感染病例,又可对人型和牛型结核做出初步分型,具有较好的实用性,值得推广使用。
[1] 张爱丽,侯兴华,卫芳,等.凯里市部分学生结核菌素纯蛋白衍生物试验结果调查分析[J].山西医药杂志,2014,43(6):646-647.
[2] 崔哲哲,区进,李建标,等.贺州市八步区中小学生结核病筛查结果和影响因素分析[J].中国热带医学,2012,12(6):706-708.
[3] Stermann M,Bohrssen A,Diephaus C,et al.Polymorphic nucleotide within the promoter of nitrate reductase(NarGHJI)is specific for Mycobacterium tuberculosis[J].JClin Microbiol,2003,41(7):3252-3259.
[4] Cheng VC,Yam WC,Hung IF,et al.Clinical evaluation of the polymerase chain reaction for the rapid diagnosis of tuberculosis[J].JClin Pathol,2004,57(3):281-285.
[5] Pereira-Suárez AL,Estrada-Chávez Y,Zúñiga-Estrada A,et al.Detection of Mycobacterium tuberculosis complex by PCR in fresh cheese from localmarkets in Hidalgo,Mexico[J].JFood Prot,2014,77(5):849-852.
[6] Zarden CF,Marassi CD,Figueiredo EE,et al.Mycobacterium bovis detection from milk of negative skin test cows[J].Vet Rec,2013,172(5):130.
[7] AyeleWY,Neill SD,Zinsstag J,etal.Bovine tuberculosis:an old disease but a new threat to Africa[J].Int JTuberc Lung Dis,2004,8(8):924-937.
[8] Pinsky BA,Banaei N.Multiplex real-time PCR assay for rapid identification of Mycobacterium tuberculosis complexmembers to the species level[J].JClin Microbiol,2008,46(7):2241-2246.
[9] BakshiCS,Shah DH,Verma R,etal.Rapid differentiation of Mycobacterium bovis and Mycobacterium tuberculosis based on a 12.7-kb fragment by a single tube multiplex-PCR[J].Vet Microbiol,2005,109(3/4):211-216.
Nested fluorescent PCR combined w ith high resolution melting curve to detect and distinguish Mycobacterium tuberculosis strains
SHAO Xue-jun1,ZHU Hong1,HUANG Li-li1,TAO Yun-zheng1,XU Jun1,HE Ping1,WANG Jian2
(1.Department of Clinical Laboratory,2.DepartmentofGeneral Surgery,Children′s Hospital of Soochow University,Suzhou Jiangsu 215003,China)
Objective:To establish a PCR method for detection of Mycobacterium tuberculosis strains.M ethods:According to the T-to-C transition at position 215 prior to the start codon of nitrate reductase gene(narGHJI)between Mycobacterium tuberculosis and Mycobacterium bovis,a nested fluorescent PCR combined with a high-resolutionmeltassaywas designed.The sensitivity of themethod was determined by comparing the quantitative resultswith commercial quantitative reagentusing Mycobacterium bovis BCG as specimen,and the PCR products were observed by agarose gel electrophoresis to verify the specificity.Then,themethod was applied to analyze the normalized melt curves and melting temperatures of the PCR product among Mycobacterium tuberculosis(H37Ra),Mycobacterium bovis BCG,clinical isolates of Mycobacterium tuberculosis and bovis.Results:narGHJI in Mycobacterium tuberculosiswas detected specifically by nested fluorescent PCR,and the sensitivitywas higher than comparedmethod about10 fold.By analyzing themelting curves of the PCR product for Mycobacterium tuberculosis using high-resolutionmelt assay,Mycobacterium tuberculosis and Mycobacterium boviswas divided by each other into two different combinations,and themelting temperature for Mycobacterium tuberculosis(83.08±0.08)℃was significantly lower than Mycobacterium bovis(83.96±0.09)℃(t=217.23,P<0.05).Conclusion:A nested fluorescent PCR combined with high-resolution melt assay was established successfully to detect and distinguish Mycobacterium tuberculosis strains.
Mycobacterium tuberculosis;nested PCR;melting curve;strain
邵雪君(1971—),男,江苏苏州人,副主任技师,博士,主要从事血液学与分子生物学研究;汪健(通讯作者),主任医师,wj196312@vip.163.com
R378.91;R393
A
1671-7783(2015)04-0342-04
10.13312/j.issn.1671-7783.y150054
苏州市科技发展项目(SYS201248);苏州市科技支撑计划社会发展项目(SS201244)
2015-03-20 [编辑] 刘星星

