强迫症大鼠模型敏感脑区代谢物的磁共振波谱动态分析
许晓杰,卢辉群,叶波,周玮,叶向阳,蔡杭美
(扬州大学附属泰兴市人民医院CT室,江苏泰兴225400)
强迫症大鼠模型敏感脑区代谢物的磁共振波谱动态分析
许晓杰,卢辉群,叶波,周玮,叶向阳,蔡杭美
(扬州大学附属泰兴市人民医院CT室,江苏泰兴225400)
目的:运用磁共振氢质子波谱(1H-MRS)技术对多巴胺激动剂喹吡罗强迫症模型大鼠的海马、额叶组织代谢物进行动态定量分析。方法:将40只行为学评分相近的SD大鼠随机分成对照组(10只)及喹吡罗组(30只),喹吡罗组大鼠每周进行2次喹吡罗颈部皮下注射,对照组给予同等剂量的生理盐水颈部皮下注射,共给药10次;每次给药后对每只大鼠进行3.0 T超高场强MRI扫描及磁共振质子波谱检测,检测指标包括N-乙酰天门冬氨酸(NAA)、肌酸(Cr)、胆碱复合物(Cho)及肌醇(MI),分别计算NAA、Cho、MI与Cr的比值。结果:①与对照组比较,喹吡罗组大鼠双侧海马区NAA/Cr自建模第10天起明显减低,自第24天起明显升高,P均<0.05;双侧额叶区NAA/Cr从第10天开始较对照组明显升高(P<0.05),第21-34天维持在第21天的水平左右。②喹吡罗组大鼠双侧额叶区Cho/Cr值自第21天起较对照组明显升高(P<0.05);而海马区Cho/Cr与对照组比较未见明显变化(P>0.05)。③喹吡罗组大鼠双侧海马区MI/Cr值从第7天开始较对照组明显减低(P<0.05),第21-34天维持在第21天水平左右;双侧额叶区MI/Cr值较对照组未见显著变化(P>0.05)。结论:喹吡罗组大鼠脑内多个代谢物指标存在异常,且部分呈现一定的规律性。
强迫症;氢质子磁共振波谱;组织代谢物
强迫症患者存在多个脑区功能异常,在目前研究较少的首发强迫症患者中,海马、额叶尤为值得关注[1]。但目前的磁共振氢质子波谱(1H-magnetic resonance spectrum,1H-MRS)研究大多局限于海马、额叶的代谢物指标是否存在改变,对其动态变化规律研究较少,导致追寻神经生物学变化基础及推测发病机制的方法不够全面。本研究利用1H-MRS技术对多巴胺激动剂喹吡罗强迫症模型大鼠的海马、额叶的组织代谢物N-乙酰天门冬氨酸(NAA)、肌酸(Cr)、胆碱复合物(Cho)及肌醇(MI)进行动态检测分析,旨在发现海马、额叶功能变化的特点和规律,寻找动态变化中最敏感的代谢指标,为强迫症的诊治提供依据和帮助。
1 材料与方法
1.1 动物
选取体质量为(160±5)g健康雄性SD大鼠,由泰兴市人民医院动物实验中心提供。经过1周适应性饲养及行为学评分后,选取评分相近的大鼠40只,随机分成对照组10只及喹吡罗组30只。
1.2 检查方法
1.2.1 强迫症大鼠模型的建立 喹吡罗组大鼠每周2次喹吡罗(0.5mg/kg)颈部皮下注射,对照组每次注射与喹吡罗溶液等体积的生理盐水,每周2次;经大鼠的返回“家”的频率、返“家”时间、运动总距离、参观地点、参观的序列等行为学数据的证实,注射10次后大鼠强迫症模型建立。
1.2.2 MRI扫描及1H-MRS数据采集 扫描工具及序列参数:每只大鼠扫描前进行1%戊巴比妥钠腹腔麻醉(剂量为50 mg/kg),采用西门子公司3.0 T高场强磁共振成像系统(型号为Magnetom Trio Tim)及大鼠3.0 T专用线圈(上海晨光公司,型号为CG-MUC21)对大鼠脑部进行常规MRI扫描。1H-MRS数据采集:在T2WI序列基础上对海马区、额叶进行波谱扫描前的定位,避开颅骨、脑脊液等影响,利用多体素(MVS)3D-CSI序列对受试大鼠海马区进行1H-MRS扫描(TR=1700 ms,TE=135 ms,体素为2.0 mm×2.0 mm×2.0 mm)。扫描完成后使用随机LEONARDO程序进行基线、相位校正。利用西门子工作站自带软件对检测数据进行处理,转化为波谱图形及数值,分别绘出NAA、Cr、Cho、MI的峰值,并以Cr值为参照物,记录NAA/Cr、Cho/Cr及MI/Cr的比值。所有资料及数据由专业图像处理人员进行光盘储存,所有数据均在同一时间内进行统一测量。
1.3 统计学分析
测得数据符合正态性分布,数据用Stata 11.0软件包进行统计分析,计量资料以均数±标准差±s)表示,两组均数比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 常规MRI序列检测结果
常规MRI序列扫描结果显示,对照组与喹吡罗组均未见明显异常信号及其他异常改变。
2.2 额叶、海马区NAA/Cr检测结果
喹吡罗组大鼠双侧海马区NAA/Cr值从第10天开始较对照组明显减低,第24天后开始较对照组明显升高,差异均有统计学意义(P<0.05);双侧额叶区NAA/Cr值从第10天开始较对照组明显升高(P<0.05);21天后维持在第21天水平左右(表1)。图1为大鼠海马波谱分析图。
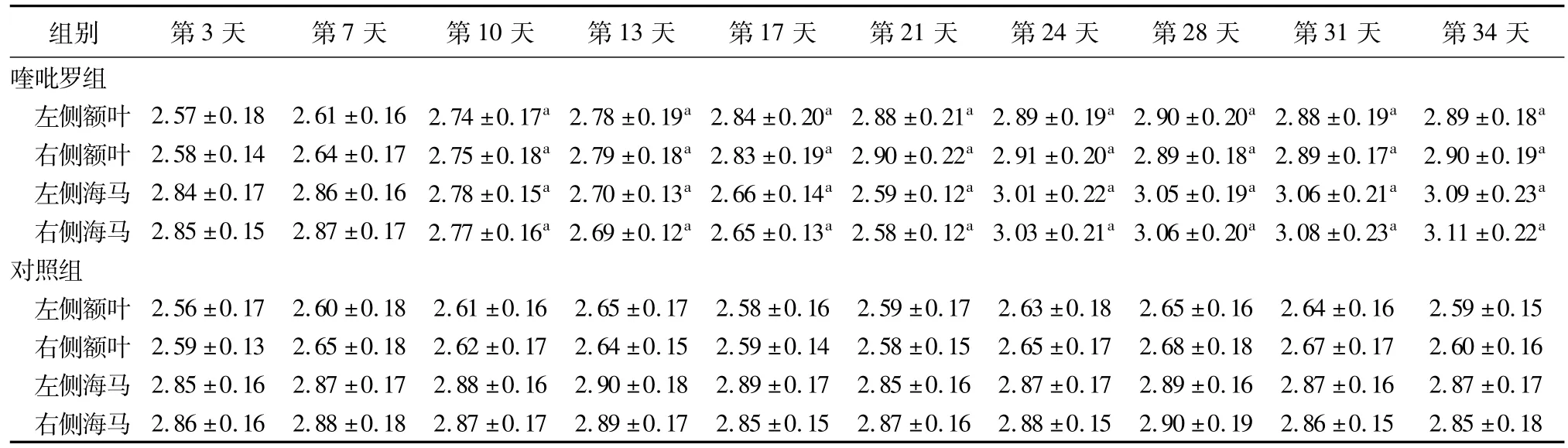
表1 喹吡罗组与对照组大鼠双侧额叶、海马区NAA/Cr的比较

图1 强迫症模型大鼠海马氢质子磁共振波谱
2.3 额叶、海马区Cho/Cr检测结果
喹吡罗组双侧额叶区Cho/Cr值从第21天开始较对照组明显升高,差异有统计学意义(P<0.05),未见明显规律性;而海马区Cho/Cr与对照组比较未见明显变化(表2)。
2.4 额叶、海马区MI/Cr检测结果
喹吡罗组大鼠双侧海马区MI/Cr值从第7天开始较对照组明显减低(P<0.05),降至第21天后维持在这一水平;额叶区MI/Cr值与对照组比较未见明显变化(表3)。

表2 喹吡罗组和对照组大鼠双侧额叶和海马区Cho/Cr的比较

表3 喹吡罗组与对照组大鼠双侧额叶、海马区M I/Cr的比较
3 讨论
强迫症作为一种精神类疾病,其发病机制极其复杂并与社会心理学、遗传学及生物化学等多种因素密切相关。相关研究显示海马及额叶结构及功能的异常在强迫症的发病中起着重要的作用[2]。因患者发病类型、年龄及用药情况等多方面的因素,研究者难以对首发类型的强迫症患者进行长期追踪观察。而利用喹吡罗给药建立的强迫症大鼠模型能很好地模拟人类强迫症患者的核心症状,同时这个过程也模拟了人类从正常到逐渐强迫的状态,并随着病程的进展而发生病理生理变化的过程[3]。
本实验结果显示喹吡罗组大鼠相对于对照组双侧海马区NAA/Cr先降低后升高,而双侧额叶区先上升然后维持在一定的水平。NAA是脑内含量仅少于谷氨酸的一种氨基酸,对一系列损害神经元及轴突完整性的病理过程较为敏感,NAA/Cr降低代表着神经元凋亡、神经元活性降低或功能损害[4]。本研究结果与国际上部分研究人类强迫症的波谱分析结果有一定差异,如Harris等[5]报道强迫症患者双侧海马区NAA/Cr较对照组升高,而Du等[6]认为人类强迫症患者额叶NAA/Cr较对照组降低。我们认为存在差异的原因可能与此类研究选择的病例多经过治疗,药物对研究结果可能有一定的影响。本研究结果提示喹吡罗强迫症大鼠额叶区神经元数量及功能异常在强迫症的发病中是一种渐进性加重的过程;额叶作为许多皮层下结构信息汇聚的中心,是人类认知功能的高级加工中枢,在强迫症发病的诸多神经环路中均起重要作用[7],其区域内神经元数量及功能的异常在强迫症的发病中可能起着极其重要的作用。而海马作为情感及情绪调节的重要部位,参与脑内很多神经环路的功能调节,其内神经元功能先减弱可能提示其与额叶或有额叶组成的神经环路间存在反馈调节的机制,而后随着疾病的发展,其内神经元的功能增强,可能是一种失代偿的表现。
Cho主要存在于神经胶质中,是神经胞膜磷脂代谢的成分之一,参与细胞膜的合成及降解,其含量的变化可以间接反应神经胶质细胞的完整性、密度以及细胞内信号转导的异常[8]。本实验结果显示喹吡罗强迫症大鼠在建模21天后双侧额叶Cho/Cr开始较对照组升高,未见明显规律性。此结果与部分研究人类强迫症的波谱分析结果有较大差异,如Li等[9]认为强迫症患者海马区Cho/Cr较对照组降低,Bittšanský等[10]发现强迫症患者额叶Cho/Cr较对照组未见明显差异。我们猜测可能的原因是以人类强迫症患者作为研究对象很难收集到病程相当的病例,患者的异质性是影响结果的一个重要因素。本实验结果提示强迫症大鼠相关脑区神经纤维连接可能存在异常,强迫症的发病可能是神经元功能异常和诸多脑区间神经连接障碍共同作用的结果。
MI是参与肌醇磷酸循环的重要物质,亦是一种重要的神经递质。MI降低提示肌醇磷酸循环可能存在障碍,随之磷脂酰肌醇代谢环发生异常,影响5-羟色胺的释放,进而影响着人类情感障碍等活动[11]。本研究结果显示喹吡罗强迫症大鼠的海马从建模第7天起MI/Cr较对照组降低,降低到一定程度后维持在一定水平。提示海马5-羟色胺系统存在异常。此结果与目前国际上研究人类强迫症结果较为接近,但此前的研究未能发现MI降低的规律。国外诸多研究显示5-羟色胺异常也是强迫症发病的一个重要原因[12],本实验结果提示多巴胺系统异常可能是5-羟色胺系统异常的一个原因。
综上,强迫症大鼠额叶、海马内确实存在功能和代谢异常,且部分代谢物的变化与强迫症的病程有一定的关联,但脑内其他脑区是否存在变化,这些脑区间是否存在联系,还需在以后的研究中进一步探讨。
[1] Gozzi A,Tessari M,Dacome L,et al.Neuroimaging evidence of altered fronto-cortical and striatal function after prolonged cocaine self-administration in the rat[J].Neuropsychopharmacology,2011,36(12):2431-2440.
[2] Perreault ML,Seeman P,Szechtman H.Kappa-opioid receptor stimulation quickens pathogenesis of compulsive checking in the quinpirole sensitization model of obsessive-compulsive disorder(OCD)[J].Behav Neurosci,2007,121(5):976-991.
[3] de Haas R,Seddik A,Oppelaar H,et al.Marked inbred mouse strain difference in the expression of quinpirole induced compulsive like behavior based on behavioral pattern analysis[J].Eur Neuropsychopharmacol,2012,22(9):657-663.
[4] 王冬青,朱彦,李月峰,等.首发抑郁症患者敏感脑结构的磁共振质子波谱分析研究[J].中华行为医学与脑科学杂志,2011,20(1):19-21.
[5] Harris JL,Yeh HW,Choi IY,et al.Altered neuro-chemical profile after traumatic brain injury:1H-MRSbiomarkers of pathologicalmechanisms[J].JCereb Blood Flow Metab,2012,32(12):2122-2134.
[6] Du F,Zhang Y,Zhu XH,etal.Simultaneousmeasurement of glucose blood-brain transport constants and metabolic rate in rat brain using in-vivo1H-MRS[J].J Cereb Blood Flow Metab,2012,32(9):1778-1787.
[7] Munasinghe J,Zhang Z,Kong E,et al.Evaluation of neurodegeneration in a mouse model of infantile batten disease bymagnetic resonance imaging andmagnetic resonance spectroscopy[J].Neurodegener Dis,2012,9(4):159-169.
[8] 李国海,刘珺,申变红,等.抑郁症患者额叶、前扣带回、海马N-乙酰天冬氨酸磁共振质子波谱研究[J].中华行为医学与脑科学杂志,2009,6(18):499-501.
[9] Li H,Li JP,Lin CG,et al.An experimental study on acute brain radiation injury:dynamic changes in proton magnetic resonance spectroscopy and the correlation with histopathology[J].Eur JRadiol,2012,81(11):3496-3503.
[10] BittšanskýM,VýbohováD,Dobrota D.Protonmagnetic resonance spectroscopy and its diagnostically important metabolites in the brain[J].Gen Physiol Biophys,2012,31(1):101-112.
[11] Lim TS,Hong YH,Choi JY,et al.Functional investigation of bilateral posterior cingulate gyriusingmultivoxel MR spectroscopy[J].Eur Neurol,2012,67(5):279-286.
[12] Djodari-Irani A,Klein J,Banzhaf J,et al.Activity modulation of the globus pallidus and the nucleus entopeduncularis affects compulsive checking in rats[J].Behav Brain Res,2011,219(1):149-158.
Dynam ic study ofmagnetic resonance spectrum about sensitive brain structure of rat obsessive com pulsive disorder model
XU Xiao-jie,LU Hui-qun,YE Bo,ZHOUWei,YE Xiang-yang,CAIHang-mei
(Department of Radiology,Taixing People′s Hospital Affiliated to Yangzhou University,Taixing Jiangsu 225400,China)
Objective:To analyze the metabolism of the hippocampus and frontal lobe tissue of the rat obsessive compulsive disordermodel by1H-MRS.M ethods:A total of 40 SD rats were randomly divided into control group and quinpirole group,10 rats in control group,30 rats in quinpirole group.The rats in quinpirole group received quinpirole subcutaneous injection twice a week,the control group received the same amount of saline injection.All of the ratswere injected ten times.Every time after delivery,all of the rats received 3.0TMRIand analyzing technology1H-MRS(indexes including NAA,Cr,Cho and MI).Results:①Compared with the control group,the values of NAA/Cr of the bilateral hippocampus of the quinpirole group were significantly reduced from the 10thday(P<0.05),and the values began to significantly rise from the 24thday(P<0.05);the values of NAA/Cr of the bilateral frontal lobe of the quinpirole group were significantly rose from the 10thday(P<0.05),and keep the same level on the 21-34thday.②The values of Cho/Cr of the bilateral frontal lobe of the quinpirole group were significantly rose from the 21thday(P<0.05);but the values of hippocampus had no obvious change(P>0.05).③The values MI/Cr of the bilateral hippocampus of the quinpirole group were significantly reduced from the 7thday,and keep the same level on the 21-34thday(P<0.05);but the values of frontal lobe had no obvious change(P>0.05).Conclusion:Many metabolite indexes were abnormal in quinpirole ratmodel,and some showed ___certain regularity.
book=283,ebook=12
obsessive-compulsive disorder;1H-magnetic resonance spectrum;metabolism
R749
A
1671-7783(2015)04-0282-04
10.13312/j.issn.1671-7783.y140322
许晓杰(1973—),男,江苏泰兴人,副主任医师,主要从事中枢神经系统的影像学研究;卢辉群(通讯作者),E-mail:aisulhq@ sohu.com
2014-12-10 [编辑] 何承志

