哮喘小鼠肺组织Nuocytes增多与GITR-GITRL表达的关系
张梦莹,徐芸芸,吴静,张盼,张淡宜,彭静静,齐晨,纪晓昀,夏圣,苏兆亮,王胜军,许化溪
(江苏大学医学院免疫学与免疫检验系,江苏镇江212013)
哮喘小鼠肺组织Nuocytes增多与GITR-GITRL表达的关系
张梦莹,徐芸芸,吴静,张盼,张淡宜,彭静静,齐晨,纪晓昀,夏圣,苏兆亮,王胜军,许化溪
(江苏大学医学院免疫学与免疫检验系,江苏镇江212013)
目的:检测哮喘小鼠肺组织中Nuocytes相关指标和GITR-GITRL的表达,探讨哮喘时Th2极化微环境的改变。方法:选择8只Balb/c小鼠,随机分为2组,模型组于第1天,第11天用OVA致敏,第22至26天用2%OVA溶液雾化激发,对照组用PBS处理;采用流式细胞术检测小鼠肺组织内GITR表达和Nuocytes细胞数量;qRT-PCR法检测Foxp3、RORα、ICOS、ST2、IL-5、IL-13和GITR及其配体GITRL的mRNA表达水平;对GITR-GITRL和Nuocytes及其相关分子的表达水平进行相关性分析。结果与对照组相比,模型组小鼠肺组织中Nuocytes细胞数和GITR表达均升高,且GITRL、Foxp3、RORα、ICOS、ST2以及IL-5和IL-13 mRNA表达水平均明显上调;GITR与RORα和ST2、IL-5、IL-13的表达水平均呈正相关。结论:哮喘小鼠肺组织中Nuocytes和GITR-GITRL表达增高,提示哮喘时GITR-GITRL上调的T细胞免疫应答可能与Th2主导的免疫失衡和Nuocytes极化相关。
Nuocytes;GITR;GITRL;哮喘;小鼠
哮喘是一种慢性过敏性气道炎症,病理特征主要表现为急性可逆性支气管气流受限、支气管-肺组织高反应性、气道嗜酸粒细胞浸润、黏液分泌增多等。目前,普遍认为机体哮喘时的免疫状态向Th2型偏倚[1],表现为2型细胞因子和转录因子IL-4、GATA3等表达水平升高。
近来发现一新型固有淋巴细胞Nuocytes[2-3]或称Ⅱ型固有免疫细胞(Group 2 innate lymphoid cells,ILC2s),在哮喘疾病中起重要作用。Nuocytes经IL-25、IL-33刺激活化,产生和分泌大量细胞因子,如IL-5和IL-13等。Nuocytes不表达T/B细胞、巨噬细胞、树突状细胞、嗜碱性粒细胞、嗜酸性粒细胞、肥大细胞等特异性标志,可诱导共刺激分子(inducible costimulator,ICOS)为阳性[4-5],维甲酸相关孤核受体α(retinoid acid receptor related orphan receptorα,RORα)是其分化和发挥生物学作用必需的转录因子。Nuocytes主要免疫作用是参与Th2应答过程,其极化可能是构成Th2细胞优势分化的重要因素。
糖皮质激素诱导的肿瘤坏死因子受体(glucocorticoid-induced TNF receptor family related protein,GITR)是肿瘤坏死因子受体(TNFR)超家族成员之一[6-8],为Ⅰ型跨膜蛋白,1997年由Nocentini等在杂交瘤细胞株上克隆出,其配体即GITRL。表达有GITR的Treg细胞能有效地发挥免疫抑制作用,控制和维持机体的免疫平衡。而当GITR与其配体GITRL共表达时,GITR-GITRL的相互作用则可消除Treg细胞的免疫抑制功能,并作为免疫应答的正向协同刺激信号,参与免疫性疾病的炎症损伤过程。本研究拟通过检测哮喘小鼠肺组织GITRGITRL和Nuocytes的分布以及相关细胞因子的表达水平,分析GITR-GITRL对Nuocytes及其相关分子表达水平的影响,从区域免疫学的角度了解哮喘时Th2极化微环境的变化。
1 材料与方法
1.1 小鼠哮喘模型的建立
SPF(Specific pathogen-free)级雌性Balb/c小鼠(6~8周龄)8只,购自扬州大学比较医学中心,动物合格证号:No.201403201。随机分为对照组和模型组,每组4只。模型组建模方法参照文献[9]并加以改进,即于第1天和第11天腹腔注射致敏液0.1 mL[50μg鸡卵清蛋白(OVA)+10%氢氧化铝凝胶2 mg],第22天至第26天以无菌PBS配制的2%OVA溶液超声雾化吸入60 min,最后一次雾化吸入24 h后处死小鼠。对照组用PBS处理。
1.2 试剂
OVA(Sigma公司),Trizol试剂(Invitrogen公司);反转录试剂盒、SYBR Premix Ex TaqTM(TaKaRa公司);GITR和Lin单克隆抗体(eBioscience公司),ST2、ICOS单克隆抗体(Biolegend公司)。
1.3 流式细胞术检测小鼠肺组织GITR的表达和Nuocytes细胞数
取小鼠肺组织,剪碎并用胶原酶消化,筛网过滤和ACK裂解液裂解红细胞,细胞计数后用抗GITRAPC或抗Lineage-FITC、抗ICOS-PerCP/Cy5.5和T1/ST2-PE作荧光抗体染色,然后用C6流式细胞仪分析。
1.4 RNA提取、引物设计及qRT-PCR
剪取约1/4肺组织块冲洗,剪碎后加1 mL Trizol提取总RNA,反转录成cDNA,再以cDNA为模板进行qRT-PCR(反转录和定量试剂均为TaKaRa公司产品)。实验过程中每份标本均设3个复孔并作3次重复检测。引物均用Oligo 6软件设计(表1),由上海生工生物技术公司合成。

表1 引物序列及产物长度
1.5 统计学分析
统计学分析采用GraphPad软件。组间数据比较用独立样本t检验,相关性分析用Pearson相关分析法。P<0.05为差异有统计学意义。
2 结果
2.1 哮喘小鼠模型诱导结果
建模后哮喘小鼠表现为烦躁不安,弓背且腹部鼓动明显,点头样喘息,呼吸加深加快等;HE染色镜下可见哮喘小鼠肺泡间及伴行血管周围有大量炎症细胞浸润、黏膜皱壁减少、杯状细胞肥大增生,见图1。与对照组相比,OVA模型组血清总IgE水平明显升高(t=2.427,P<0.05)。见图2。
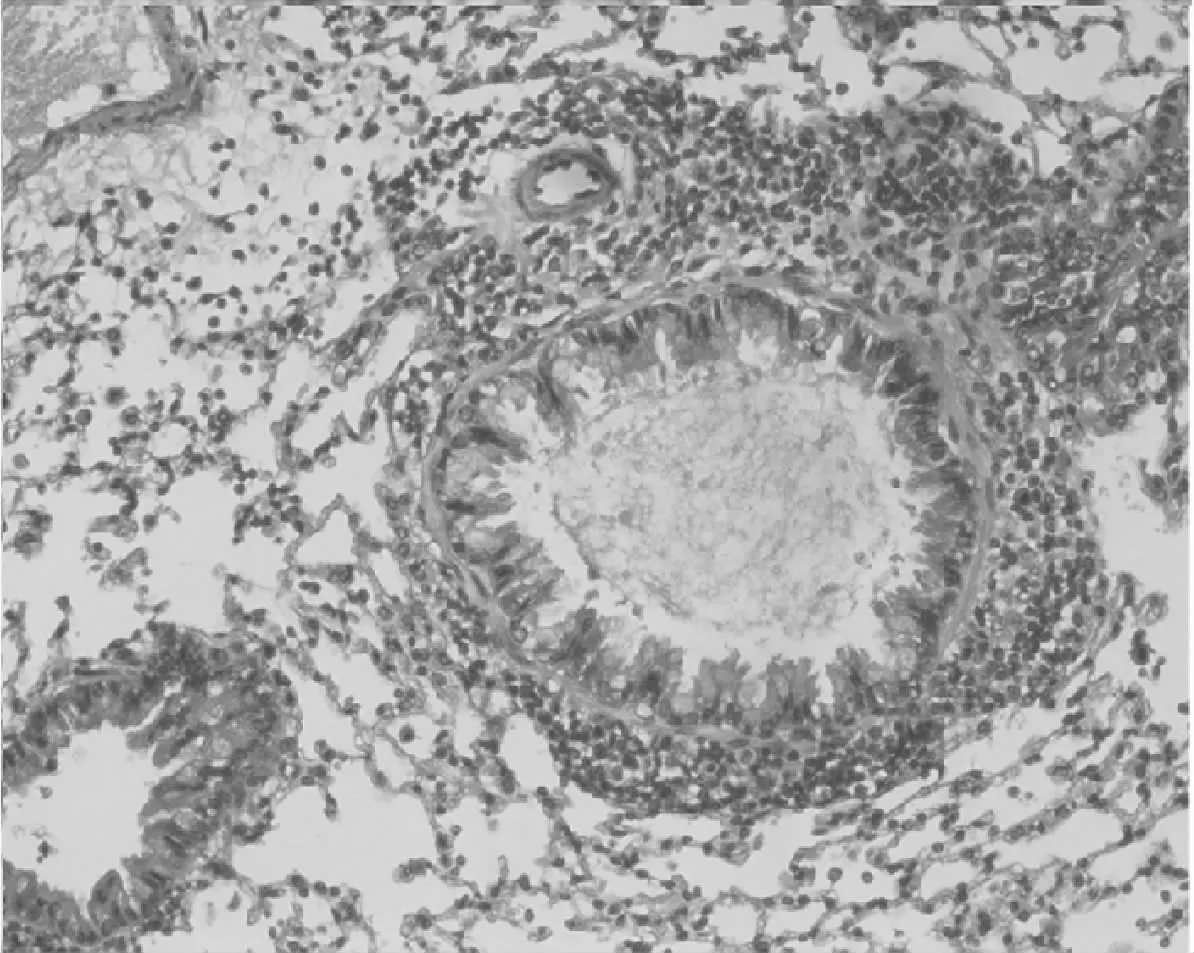
图1 模型组小鼠肺组织的病理改变(HE染色×10)
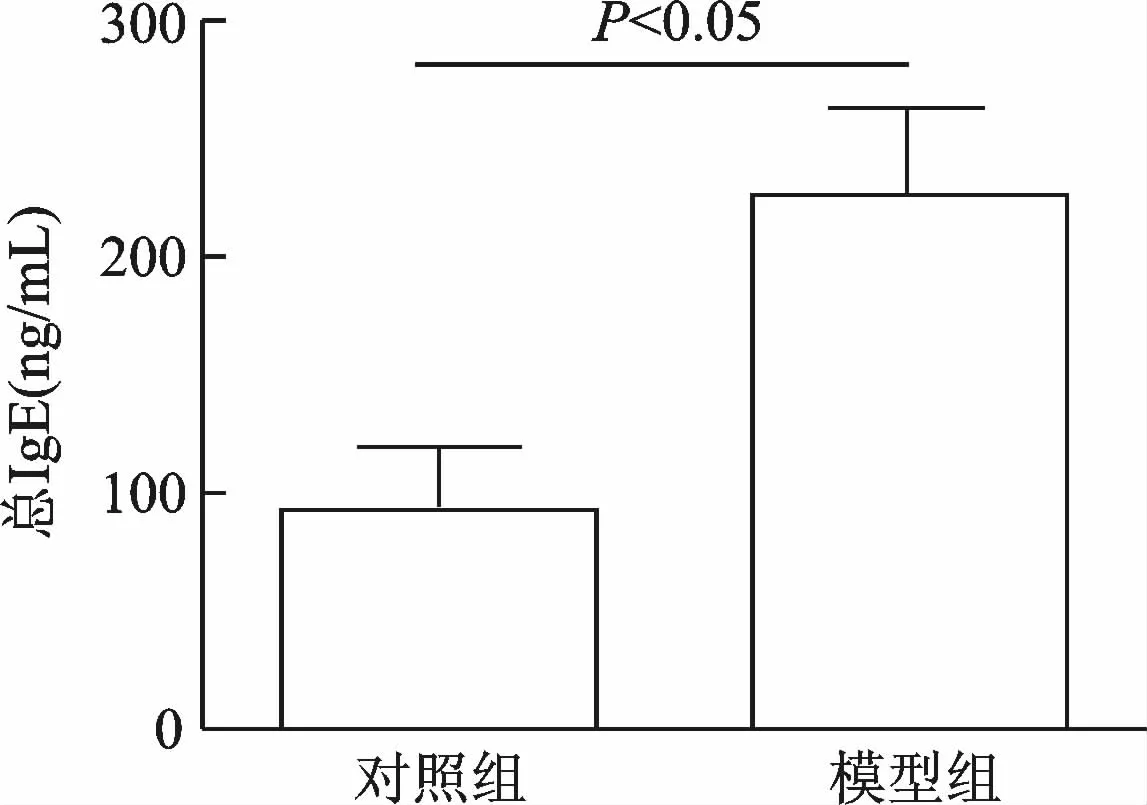
图2 小鼠血清总IgE水平比较
2.2 肺组织Nuocytes数量和GITR表达水平的改变
流式细胞术检测结果显示,与对照组比较,模型组小鼠肺组织内GITR阳性细胞增加,且伴有Nuocytes细胞数增多;免疫荧光抗体染色结果也显示GITR表达增强;qRT-PCR检测结果显示,与对照组比较,模型组小鼠肺组织GITR mRNA表达水平明显升高。见图3。
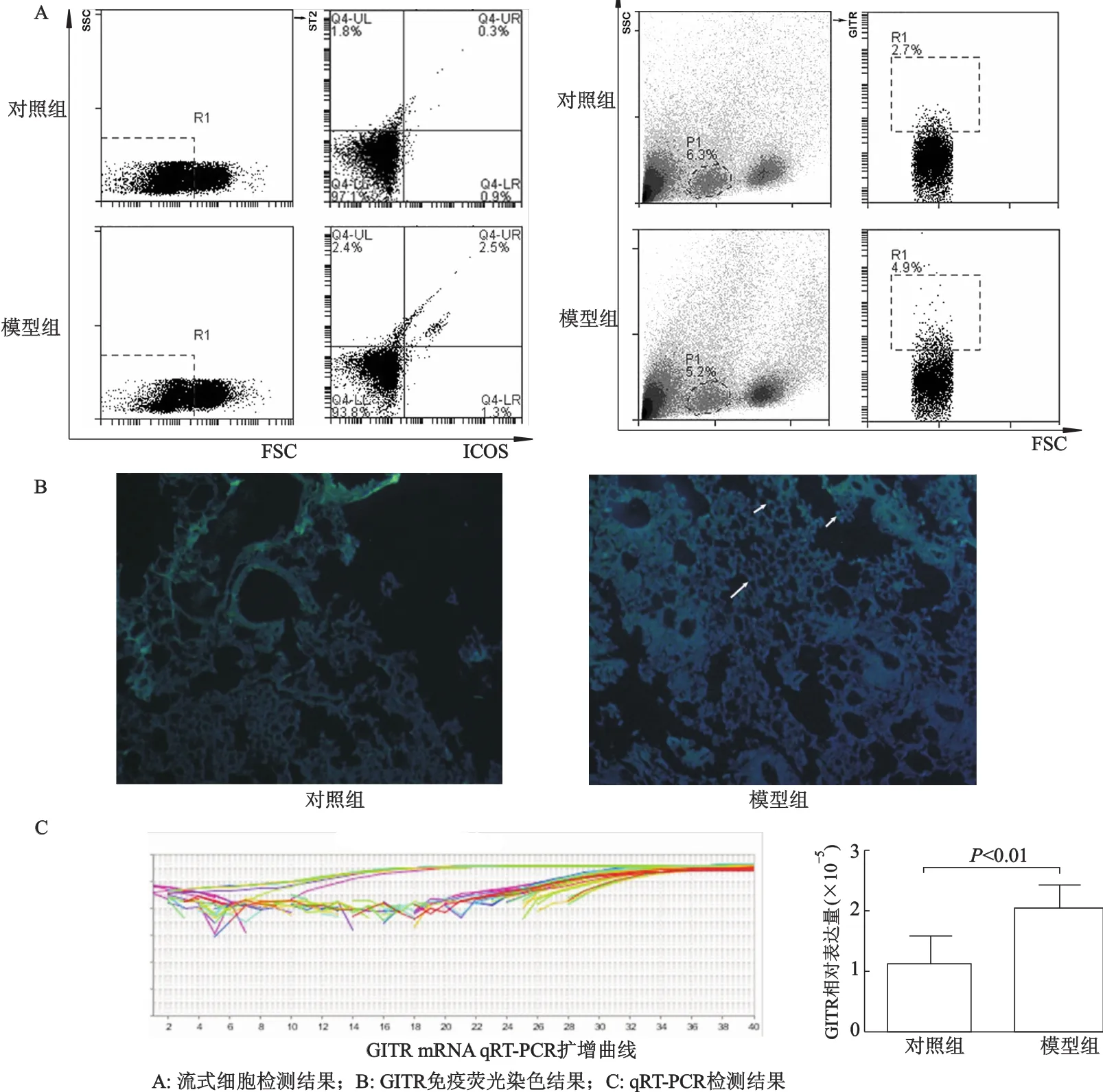
图3 小鼠肺组织内GITR表达和Nuocytes细胞数量
2.3 哮喘小鼠肺组织GITRL和Nuocytes相关分子的表达
qRT-PCR检测结果显示,模型组小鼠肺组织中GITRLmRNA水平明显高于对照组;此外,Foxp3以及Nuocytes细胞相关分子ICOS、ST2、RORα、IL-5和IL-13 mRNA表达水平均明显高于对照组(P均<0.05)。见图4。
2.4 哮喘小鼠肺组织GITR与Nuocytes相关分子表达水平的相关性分析
相关性分析结果表明,GITR表达与RORα,ST2,IL5和IL-13的表达呈明显正相关(P均<0.05)。见图5。

图4 GITR-GITRL和Nuocytes相关分子的mRNA表达

图5 GITR与nuocytes相关分子表达水平的相关性分析
3 讨论
支气管哮喘是以气道过敏性炎症为主要病理特征的免疫性疾病,近年来欧共体呼吸健康调查(ESRHS)和国际儿童哮喘与变态反应研究机构(ISAAC)的流行病学调查研究均显示,哮喘患病率明显升高。迄今为止,哮喘的病理机制尚不完全清楚。研究表明,哮喘患者体内Th1/Th2细胞处于失衡状态,Th2细胞呈优势分化[10]。Nuocytes可分泌大量的IL-5和IL-13,支撑和维持着Th2细胞的极化状态,促进哮喘的发展。
GITR组成性地高表达于Treg细胞表面,而静息的初始CD4+T细胞表面表达量相对较低,当抗原刺激活化T细胞后,Treg和CD4+T细胞表面的GITR表达量均会增高[11-13]。在缺乏足够GITRL时,高表达GITR的Treg细胞具有负向免疫调控作用,而GITR与其配体GITRL结合则构成T细胞活化的协同刺激信号,GITR-GITRL的相互作用影响Treg细胞的增殖及其免疫抑制功能[8-9]。
本研究显示,哮喘小鼠肺组织内GITR表达和Nuocytes数量升高;GITR及其配体GITRLmRNA表达水平相伴上调,同时nuocytes相关分子ICOS、ST2、IL-5、IL-13及转录因子RORα的mRNA水平也明显升高;GITR-GITRL表达量与Nuocytes细胞相关的细胞因子或转录因子水平呈正相关。由此推测,GITR和GITRL相伴高表达,一方面可阻碍Treg细胞的负向调控作用,另一方面可能对Th2细胞极化发挥促进作用。有研究表明,Th2细胞的特异性转录因子GATA3是炎症条件下稳定Foxp3(Treg转录因子)表达及功能的正调控因子[14-15],而Treg细胞中Foxp3也可通过上调去泛素化酶USP21的转录和表达,从而维持GATA3蛋白的稳定性[16]。本研究结果显示,哮喘小鼠肺组织Foxp3 mRNA呈高表达,由此可见其促进Th2细胞的极化。GITR-GITRL高表达与Nuocytes相关细胞因子或转录因子的上调呈正相关,可能是直接地相互影响,也可能是间接作用的结果,但最终都导致Th2细胞极化之微环境,构成哮喘的免疫失衡状态,其具体机制仍待进一步研究。
[1] Hams E,Fallon PG.Innate type 2 cells and asthma[J].Curr Opin Pharmacol,2012,12(4):503-509.
[2] Halim TY,Steer CA,Math L,et al.Group 2 innate lymphoid cells are critical for the initiation of adaptive T helper 2 cell-mediated allergic lung inflammation[J].Immunity,2014,40(3):425-435.
[3] Barlow JL,Bellosi A,Hardman CS,et al.Innate IL-13-producing nuocytes arise during allergic lung inflammation and contribute to airways hyperreactivity[J].J Allergy Clin Immunol,2012,129(1):191-198,e191-194.
[4] Neill DR,McKenzie AN.Nuocytes and beyond:new insights into helminth expulsion[J].Trends Parasitol,2011,27(5):214-221.
[5] Neill DR,Wong SH,Bellosi A,et al.Nuocytes represent a new innate effector leukocyte thatmediates type-2 immunity[J].Nature,2010,464(7293):1367-1370.
[6] Joetham A,Ohnishi H,Okamoto M,et al.Loss of T regulatory cell suppression following signaling through glucocorticoid-induced tumor necrosis receptor(GITR)is dependent on c-Jun N-terminal kinase activation[J].JBiol Chem,2012,287(21):17100-17108.
[7] Lommatzsch M,Julius P,Kuepper M,etal.The course of allergen-induced leukocyte infiltration in human and experimental asthma[J].J Allergy Clin Immunol,2006,118(1):91-97.
[8] Motta AC,Vissers JL,Gras R,et al.GITR signaling potentiates airway hyperresponsiveness by enhancing Th2 cell activity in a mouse model of asthma[J].Respir Res,2009,10(1):93.
[9] Fallon PG,Ballantyne ST,Mangan NE,et al.Identification of an interleukin(IL)-25-dependent cell population that provides IL-4,IL-5,and IL-13 at the onset of helminth expulsion[J].J Exp Med,2006,203(4):1105-1116.
[10] Cooper MA,Fehniger TA,CaligiuriMA.The biology of human natural killer-cell subsets[J].Trends Immunol,2001,22(11):633-640.
[11] Shimizu J,Yamazaki S,Takahashi T,etal.Stimulation of CD25+CD4+regulatory T cells through GITR breaks immunological self-tolerance[J].Nat Immunol,2002,3(2):135-142.
[12] Kanamaru F,Youngnak P,Hashiguchi M,et al.Costimulation via glucocorticoid-induced TNF receptor in both conventional and CD25+regulatory CD4+T cells[J].J Immunol,2004,172(12):7306-7314.
[13] Stephens GL,McHugh RS,Whitters MJ,et al.Engagement of glucocorticoid-induced TNFR family-related receptor on effector T cells by its ligand mediates resistance to suppression by CD4+CD25+T cells[J].J Immunol,2004,173(8):5008-5020.
[14] Nocentini G,Riccardi C.GITR:a modulator of immune response and inflammation[J].Adv Exp Med Biol,2009,647:156-173.
[15] Wohlfert EA,Grainger JR,Bouladoux N,etal.GATA3 controls Foxp3+regulatory T cell fate during inflammation inmice[J].JClin Invest,2011,121(11):4503-4515.
[16] Zhang J,Chen C,Hou X,et al.Identification of the E3 deubiquitinase ubiquitin-specific peptidase 21(USP21)as a positive regulator of the transcription factor GATA3[J].JBiol Chem,2013,288(13):9373-9382.
Relationship between increased nuocytes and GITR-GITRL expression levels in lung tissue of asthmatic m ice
ZHANGMeng-ying,XU Yun-yun,WU Jing,ZHANG Pan,ZHANG Dan-yi,PENG Jing-jing,QIChen,JIXiao-yun,XIA Sheng,SU Zhao-liang,WANG Sheng-jun,XU Hua-xi
(Department of Immunology,School of Medicine,Jiangsu University,Zhenjiang Jiangsu 212013,China)
Objective:To detect the changes of numbers of nuocytes and levels of GITR-GITRL in the lung of asthmaticmice,analyze the relationship between them,then to explore the changes of Th2-polarized micro-environment at the locus of allergic inflammation when with asthma.M ethods:Eightmice were devided into 2 groups randomly,asthmamodelswere sensitized with OVA on 1st,11st day,then nebulized inhalation with OVA on day 22-26,control group with PBS.Flow cytometry was used to detect numbers of nuocytes and cellswhich express GITR;qRT-PCR was also used to test themRNA levels of GITR-GITRL,molecules and cytokines associated with nuocytes;pearson correlation analysiswas used to detect the correlation between GITR-GITRL and nuocytes.Results:Compared with the control group,model group showed high levels of nuocytes and GITR-GITRL,meanwhile,with increased mRNA levels of GITRL,Foxp3,RORα,ICOS,ST2,IL-5 and IL-13;and there was a positive correlation between GITR expression and RORα,ST2,IL-5,IL-13 expression.Conclusion:Nuocytes and the expression of GITR-GITRL increased synchronously in lung of asthmaticmice,which suggested that the up-regulation of T cell-mediated immune response by GITR-GITRLmay be associated with Th2-biased response and polarization of nuocytes.
nuocytes;GITR;GITRL;asthma;mice
张梦莹(1990—),女,硕士研究生;苏兆亮(通讯作者),副教授,博士生导师,E-mail:szl30@yeah.net;许化溪(通讯作者),教授,博士生导师,E-mail:xuhx@ujs.edu.cn
R562.25
A
1671-7783(2015)04-0277-05
10.13312/j.issn.1671-7783.y150099
国家自然科学基金资助项目(31270947)
2015-05-06 [编辑] 刘星星

