外源性高糖对脾切除小鼠血糖的影响及其机制探讨
刘慧颖,任卫东,朱晓波
(1.河北北方学院附属第一医院内分泌科,河北张家口075000;2.河北北方学院病原生物研究所,河北张家口075000)
·论著·
外源性高糖对脾切除小鼠血糖的影响及其机制探讨
刘慧颖1,任卫东1,朱晓波2
(1.河北北方学院附属第一医院内分泌科,河北张家口075000;2.河北北方学院病原生物研究所,河北张家口075000)
目的探讨持续外源性葡萄糖干预是否影响胰岛β细胞的内分泌功能,以及脾脏是否也参与该过程。方法外科手术切除小鼠全脾。将实验小鼠分为8组,分别以不含葡萄糖的纯水及10%、15%和20%葡萄糖饮水喂养正常(4组)和脾切除小鼠(4组)3周。测定小鼠空腹血糖和胰岛素水平,计算各组小鼠高血糖发生率;进行胰岛素释放试验、胰岛组织免疫组织化学双染色、胰腺组织活性氧簇(ROS)测定及胰岛β细胞葡萄糖转运体-2(GLUT-2)表达分析。结果20%葡萄糖饮水喂养的正常组和脾切除组小鼠出现高血糖,发生率分别为60%和75%;所有高血糖小鼠胰岛素释放能力降低,出现胰岛β细胞凋亡。脾切除组高血糖小鼠,胰岛β细胞ROS水平升高,GLUT-2表达水平降低更加显著。结论脾脏参与外源性高糖对胰岛内分泌功能损伤的保护作用涉及胰岛β细胞ROS和GLUT-2表达水平的改变。
葡萄糖;脾切除;小鼠;胰岛β细胞;凋亡
葡萄糖是机体的碳源和能源物质,在物质代谢中发挥重要作用。血液中正常的葡萄糖浓度对维持机体的能量供给及胰岛β细胞的胰岛素分泌至关重要。胰岛素相对或绝对缺乏所致糖尿病的典型症状是机体糖代谢紊乱,血中葡萄糖水平异常升高。糖尿病状态下的持续高水平葡萄糖对许多组织产生毒性作用,即糖毒性。对胰岛β细胞的毒性作用抑制其正常分泌;对肝脏、脂肪、肌肉等组织的作用导致这些组织的胰岛素抵抗,相关领域已有广泛研究[1-3]。在正常机体,血糖受神经、内分泌和肝脏的严格调控,维持在一个狭窄的生理范围内。胰岛是调节血糖稳定的重要内分泌组织。血糖增高时,促进胰岛β细胞分泌胰岛素,维持血糖的稳定。尽管机体对血糖存在精细的调控机制,但是外源性葡萄糖的持续应用仍然可以引起正常机体的糖代谢紊乱。2002年加拿大蒙特利尔大学MIDAOUI等[4]观察到,给Sprague Dawley大鼠10%葡萄糖饮水3周能引起大鼠血糖的轻微升高、胰岛素受体抵抗和高血压。临床研究发现,静脉输注10%葡萄糖可以引起新生儿高血糖[5]。外源性葡萄糖摄入是否影响胰岛内分泌功能未见报道。
已有临床资料和实验研究显示,脾脏与胰岛内分泌功能关系密切[6-7]。本实验的前期研究表明,完全脾切除导致实验小鼠糖耐量异常[8],增加部分胰腺切除后的糖尿病发生率[9],增加实验小鼠对链尿佐菌素的敏感性,使不足以诱导糖尿病剂量的链尿佐菌素能够诱导小鼠糖尿病[10]。本研究中,笔者探讨持续外源性葡萄糖干预是否影响胰岛β细胞的内分泌功能,以及脾脏是否也参与该过程。同时通过分析小鼠胰岛β细胞形态学改变以及细胞内活性氧簇(reactive oxygen species,ROS)浓度和葡萄糖转运体2(glucose transporter-2,GLUT-2)的表达,探讨其可能机制。
1 材料与方法
1.1材料
1.1.1 实验动物健康4周龄雄性昆明小鼠,体重(20±2)g,由首都医科大学提供,生产许可证号:SCXK(京2014-0004)。
1.1.2 主要试剂和药物葡萄糖测定试剂盒购自中生北控生物科技股份有限公司,胰岛素测定试剂盒购自上海酶联生物科技有限公司,ROS化学荧光法测试盒、蛋白定量考马斯亮蓝法测试盒购自南京建成生物工程研究所,总蛋白提取试剂盒购自普利莱基因技术有限公司,细胞凋亡检测试剂盒购自武汉博士德生物有限公司,免疫组织化学染色试剂盒、二氨基联苯胺(Diaminobenzidine,DAB)染色试剂盒、兔抗鼠一抗、兔抗鼠葡萄糖转运蛋白2抗体、山羊抗兔IgG-辣根过氧化物酶(horseradish peroxidase,HRP)多聚体二抗、兔抗β-Actin抗体购自北京博奥森生物技术有限公司,预染低分子量蛋白质Marker(14.4~97.4 kD)购自北京索莱宝科技有限公司。
1.2方法
1.2.1 脾切除小鼠模型的制备适应性喂养1周后,实验小鼠按YIN等[11]的方法进行完全脾切除,即实验小鼠以1%戊巴比妥按45 mg/kg腹腔注射麻醉、备皮,常规消毒、开腹,结扎脾动脉和静脉,剥离脾脏,将脾脏切除,缝合皮肤,作为完全脾切除小鼠模型。
1.2.2 实验动物分组脾切除2 d后,将实验小鼠随机分为8组,每组20只,分别为不添加葡萄糖的单纯饮水喂养的正常对照组和脾切除对照组;10%葡萄糖饮水喂养的正常组和脾切除组;15%葡萄糖饮水喂养的正常组和脾切除组;20%葡萄糖饮水喂养的正常组和脾切除组。各实验组喂养3周,期间自由饮水,自由进食标准饲料。3周后去除葡萄糖喂养72 h,进行各项指标分析。
1.2.3 观察指标①空腹血糖和胰岛素:各实验组小鼠空腹8 h后,用毛细玻璃管在眼球后内眦静脉丛采血,1 088×g/min离心5 min制备血清,测定血糖或置于-80℃冰箱冷冻保存。血糖测定按照葡萄糖氧化酶法试剂盒说明书进行操作,20μl血清加3 ml酶酚混合试剂,37℃保温15 min,以722分光光度计在505 nm测定吸光度,按公式计算血糖浓度。胰岛素测定按照小鼠胰岛素酶联免疫分析试剂盒说明进行操作。分为空白孔和标准孔。样品孔加样50 ul,37℃温育30 min,洗涤拍干后加入酶标液50 ul,空白孔37℃温育30 min,洗涤拍干。每孔加入显色剂A、B各50 ul,37℃避光显色10 min,每孔加终止液50 ul,酶标仪450 nm波长测定各孔的吸光度。②胰岛素释放试验:实验小鼠空腹8 h后腹腔注射50%葡萄糖(2.0 g/kg,注射后0、30、60和120 min采血,1088×g/min离心5min制备血清,置于-80℃冰箱冷冻保存,用于胰岛素测定。③胰腺组织ROS测定:1%戊巴比妥45 mg/kg腹腔注射麻醉小鼠,立即完整取出胰腺组织,称重,按照重量(g)∶体积(ml)=1∶20的比例加入匀浆介质(100 mmol/L磷酸缓冲液),冰水浴条件下机械匀浆,1 000 g离心10 min,部分上清液按活性氧测定试剂盒说明书测定活性氧荧光强度,即在190μl匀浆上清液加入1 mmol/L荧光探针10μl。对照孔加入10μl磷酸盐缓冲溶液(phosphate buffer saline,PBS),充分混匀,37℃孵育30 min,荧光分光光度计以535 nm波长测定其荧光强度。部分上清用考马斯亮兰蛋白定量试剂盒测量蛋白含量,0.05 ml样品加3 ml考马斯亮蓝显色液,静置10 min后以722分光光度仪在595 nm处测定吸光度,计算蛋白质含量,结果以荧光强度/毫克蛋白表示。④免疫组织化学法染色胰岛β细胞和凋亡细胞:1%戊巴比妥45 mg/kg腹腔注射麻醉小鼠。迅速分离完整的胰腺组织,10%Bouin氏液固定24 h,乙醇梯度脱水,常规石蜡包埋,将标本切成4μm厚切片。切片二甲苯脱蜡,梯度乙醇至水化,0.3%双氧水H2O2处理后进行细胞凋亡及胰岛β细胞免疫组织化学法双染色。加入1∶100稀释的生物素化地高辛抗体,37℃孵育30 min,加入1∶100稀释链霉亲和素-生物素复合物(strept avidin-biotin complex,SABC),37℃孵育30 min,加入1∶200稀释的兔抗胰岛素抗体,4℃过夜,滴加辣根酶标记的二抗,3 min×3次,DAB显色,水溶性封片胶封片,日本Nikon Eclipse Ti显微镜系统镜下检测拍照。⑤Western blot检测GLUT-2的表达:实验小鼠颈椎错位法处死,立即分离出完整胰腺组织。按蛋白质提取试剂盒说明书操作提取样本蛋白。称取胰腺组织各50 mg,剪碎后分别加入500μl细胞裂解液,高速机械匀浆器12 000 r/min破碎组织,4℃、10 000×g/min离心10 min,收集上清液作为蛋白质样本。样品进一步Western blot检测,即以12.5%分离胶(pH=8.8)、5%浓缩胶(pH=6.8)进行十二烷基硫酸钠-聚丙烯酰胺(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)凝胶电泳,60 V、1.5 h湿法转膜。兔bs-10378R多克隆抗体(1∶500)作为一抗,HRP标记的山羊抗兔IgG(1∶5 000)作为二抗,增强化学发光法(enhanced chemiluminescence,ECL)显色,利用一体式微型化学发光成像仪进行灰度分析,通过与相应β-actin条带密度进行比较,计算出每个条带密度的相对值。
1.3统计学方法
采用SPSS 17.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,两样本比较用t检验,多组比较用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1各组小鼠空腹血糖异常发生率和血糖浓度改变
实验第3周去除葡萄糖干预后,分析各组小鼠空腹血糖。血糖浓度>7.2 mmol/L为血糖异常。不添加葡萄糖纯水喂养的正常对照组、脾切除对照组以及10%和15%葡萄糖饮水喂养的正常组、脾切除组未发现血糖异常小鼠,血糖浓度在正常范围,各组比较差异无统计学意义。20%葡萄糖饮水喂养的正常组和脾切除组空腹血糖异常的发生率分别为60%和75%,两组小鼠空腹血糖浓度分别为(7.78±2.19)和(10.05±4.15)mmol/L,两组空腹血糖比较差异有统计学意义(P<0.05)。见表1。
2.2各组小鼠空腹血清胰岛素浓度变化
空腹胰岛素检测结果表明,只有20%葡萄糖饮水喂养的正常组和脾切除组高血糖小鼠空腹血清胰岛素水平发生改变,分别为(18.32±6.38)和(17.54±5.42)mIU/ml,两组空腹胰岛素比较差异无统计学意义。见表2。
表1 各组小鼠不同葡萄糖饮水浓度的空腹血糖比较(n=20,mmol/L±s)
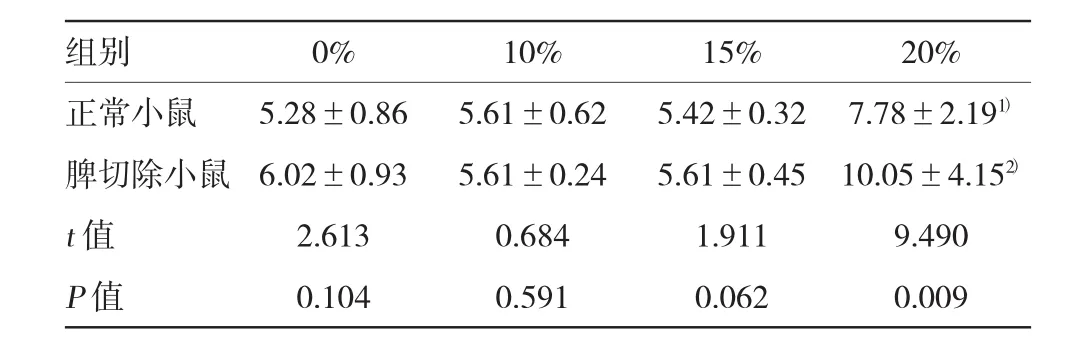
表1 各组小鼠不同葡萄糖饮水浓度的空腹血糖比较(n=20,mmol/L±s)
注:1)与正常对照组比较(0%葡萄糖),t=8.043,P=0.011;2)与脾切除对照组(0%葡萄糖)比较,t=18.202,P=0.024
组别0%10%15%20%正常小鼠5.28±0.865.61±0.625.42±0.327.78±2.191)脾切除小鼠6.02±0.935.61±0.245.61±0.4510.05±4.152)t值2.6130.6841.9119.490P值0.1040.5910.0620.009
表2 各组小鼠不同葡萄糖饮水浓度的空腹胰岛素比较(n=20,mIU/ml±s)
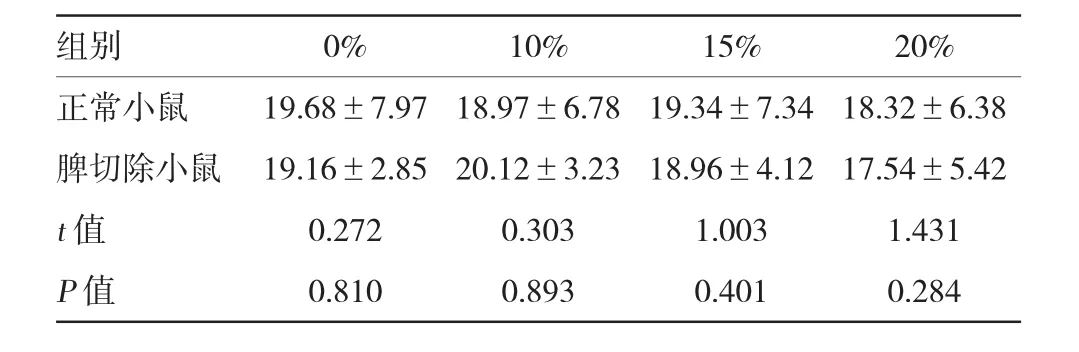
表2 各组小鼠不同葡萄糖饮水浓度的空腹胰岛素比较(n=20,mIU/ml±s)
组别0%10%15%20%正常小鼠19.68±7.9718.97±6.7819.34±7.3418.32±6.38脾切除小鼠19.16±2.8520.12±3.2318.96±4.1217.54±5.42t值0.2720.3031.0031.431P值0.8100.8930.4010.284
2.3正常和20%葡萄糖饮水喂养小鼠的胰岛素释放试验
葡萄糖饮水喂养3周后进行胰岛素释放试验以确定小鼠的高血糖是否与胰岛素分泌功能异常相关。0、30、60和120 min正常对照组胰岛素水平分别为(19.68±2.08)、(33.97±3.13)、(28.78±2.29)和(21.48±2.10)mIU/ml,0、30、60和120min脾切除对照组胰岛素水平分别为(19.16±2.83)、(35.24±1.85)、(27.63±1.27)和(20.72±1.81)mIU/ml,各时间胰岛素水平比较差异无统计学意义。30 min时,20%葡萄糖喂养的正常组小鼠胰岛素水平为(26.94±2.44)mIU/ml,与正常对照组比较,差异有统计学意义(t=2.660,P=0.018);60 min时,20%葡萄糖饮水喂养的正常组小鼠胰岛素水平为(22.45±2.05)mIU/ml,与正常对照组比较,差异有统计学意义(t=2.104,P=0.049)。30 min时,20%葡萄糖饮水喂养的脾切除组小鼠胰岛素水平为(24.40±1.13)mIU/ml,与脾切除对照组小鼠比较差异有统计学意义(t=2.941,P=0.012);60 min时,20%葡萄糖饮水喂养的脾切除组小鼠胰岛素水平为(19.37±1.25)mIU/ml与脾切除对照组小鼠比较差异有统计学意义(t=3.124,P=0.010)。20%葡萄糖饮水喂养的正常组与脾切除组小鼠各时间的胰岛素水平比较,差异无统计学意义。见图1。
2.4胰岛β细胞凋亡
对正常对照组、脾切除对照组、20%葡萄糖饮水喂养的正常组和脾切除组小鼠进行免疫组织化学法双染色,确定胰岛素释放异常是否与β细胞凋亡相关。20%葡萄糖饮水喂养的正常组与脾切除组小鼠胰岛(棕色)中可见凋亡细胞(核染色为深色)。同时也观察到20%葡萄糖饮水喂养的脾切除组小鼠胰岛细胞损伤更明显。见图2。
2.5正常和20%葡萄糖饮水喂养的小鼠胰腺组织ROS水平
葡萄糖喂养增加小鼠胰腺组织ROS水平。20%葡萄糖喂养的正常组和脾切除组小鼠的胰腺组织ROS水平显著升高,分别为(4.91±0.52)和(6.68±0.48)cd/mg,两组比较差异有统计学意义(t=9.354,P=0.004)。20%葡萄糖饮水喂养的正常组与正常对照组[(3.21±0.56)cd/mg]比较,差异有统计学意义(t=5.161,P=0.006);20%葡萄糖饮水喂养的脾切除组与脾切除对照组[(3.38±0.47)cd/mg]比较,差异有统计学意义(t=9.972,P=0.002)。见图3。
2.6正常和20%葡萄糖饮水喂养的小鼠胰岛细胞GLUT-2的表达
Western blot检测以β-actin为内参进行灰度分析。20%葡萄糖喂养的正常组和脾切除组小鼠GLUT-2表达降低,分别为(3.02±0.27)和(2.63±0.29)。20%葡萄糖喂养的正常组与正常对照组小鼠GLUT-2表达水平(3.87±0.32)比较,差异有统计学意义(t=8.174,P=0.004);20%葡萄糖喂养的脾切除组与对照组小鼠GLUT-2表达水平(3.96±0.33)比较,差异有统计学意义(t=8.651,P=0.003),见图4。
图1 正常及20%葡萄糖饮水喂养小鼠胰岛素释放试验

图2 胰岛组织的免疫组织化学法双染色(×10)
图3 化学发光法测定的正常和高血糖小鼠胰腺ROS水平
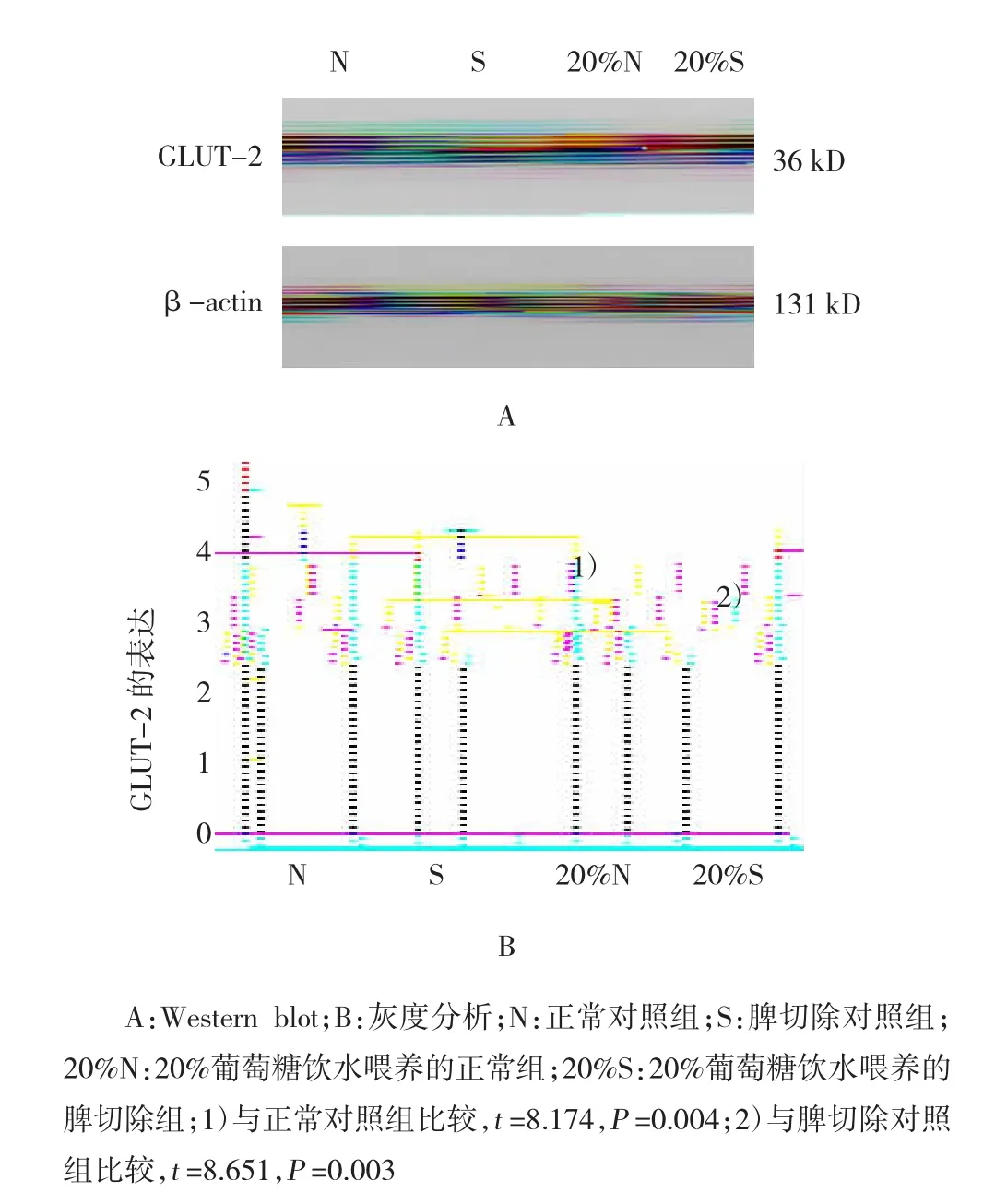
图4 Western blot测定正常和20%葡萄糖饮水喂养的小鼠胰岛β细胞GLUT-2的表达
3 讨论
体内外一系列研究表明,机体高浓度葡萄糖有毒性作用。在本研究中,20%葡萄糖饮水喂养3周可以导致正常及脾切除小鼠高血糖,而10%和15%葡萄糖饮水则不引起实验小鼠血糖异常改变,这与MIDAOUI等[4]的研究结果不一致。MIDAOUI给予SD大鼠10%葡萄糖饮水3周,导致血糖升高,但发病机制尚不清楚。
以往及本实验室的前期研究表明,脾脏对胰岛内分泌有保护作用[6-7]。在本研究中,葡萄糖饮水引起完全脾切除小鼠血糖明显升高,提示外源性葡萄糖干预引起的小鼠高血糖涉及胰岛内分泌功能的损伤,也提示脾脏对外源性葡萄糖所致的小鼠糖代谢紊乱具有一定的保护作用。
为确定外源性葡萄糖干预引起的小鼠高血糖是否与胰岛内分泌相关,本实验进行小鼠胰岛素释放试验。葡萄糖干预使高血糖小鼠胰岛素释放显著降低,表明外源性葡萄糖持续作用造成的小鼠高血糖涉及胰岛内分泌功能的降低。而脾切除小鼠胰岛素分泌功能更显著的降低表明脾切除可增加外源性葡萄糖的作用。进一步对胰腺组织进行的免疫组织化学法双染色分析显示,实验小鼠的胰岛组织有凋亡细胞出现,提示胰岛内分泌功能的下降与β胰岛凋亡相关。本研究中,外源性葡萄糖对胰岛β细胞损伤与糖尿病状态下高浓度葡萄糖在体内的毒性作用一致,也诱导胰岛β细胞凋亡。目前,关于糖尿病状态下葡萄糖在体内毒性作用的大量研究表明,其作用机制涉及对胰岛β细胞内分泌功能的毒性、胰岛β细胞凋亡及引起胰岛素受体的抵抗[12-13]。本研究中,外源性葡萄糖诱导的β细胞凋亡与葡萄糖干预下的ROS过量产生相关,ROS是胰岛β细胞损伤的重要机制,过量ROS可以氧化线粒体膜磷脂,损害细胞膜的完整性,导致细胞色素c释放,引起胰岛β细胞凋亡[14]。
本研究未探讨β细胞分泌胰岛素的合成、储存是否异常,也未进行与胰岛素分泌相关基因的分析,但是Western blot检测显示,外源性葡萄糖干预引起GLUT-2的表达降低。GLUT-2是胰岛β细胞膜上的血糖感受器,通过调控葡萄糖诱导的胰岛素分泌,可以有效调节血糖浓度[15]。有研究指出,GLUT-2的表达降低,使血糖葡萄糖主动转入β细胞受阻,β细胞胰岛素分泌功能降低[16]。本研究中,外源性葡萄糖诱导的高血糖小鼠也有ROS的显著增加,芝加哥大学的WANG等[17]指出,过量ROS产生与胰岛素基因表达降低、胰岛素分泌异常密切相关。基于GLUT-2和ROS的分析,笔者认为外源性葡萄糖干预也损害细胞的胰岛素分泌过程。本研究未探讨外源性葡萄糖干预是否引起胰岛素受体抵抗。实验小鼠发生高血糖是否与胰岛素抵抗有关,有待进一步研究。
本研究进行的各项分析显示,完全脾脏切除加重外源性葡萄糖引起的小鼠糖代谢紊乱及对β细胞的损伤程度,表明脾脏对外源性葡萄糖的β细胞损伤具有保护作用,其作用机制不明。该作用是有限的,并不能完全阻止外源性葡萄糖引起小鼠的糖代谢紊乱。尽管如此,本研究也为糖尿病的制病机制提供一定的实验依据和理论基础,为合理应用葡萄糖,特别是脾切除患者合理应用葡萄糖提供理论依据。
综上所述,20%葡萄糖饮水喂养3周可以引起小鼠发生高血糖。葡萄糖通过增加胰腺组织ROS水平和降低β细胞GLUT-2表达引起胰岛β细胞的凋亡,胰岛素分泌能力的低下。脾脏对葡萄糖干预引起的胰岛内分泌功能降低具有一定的保护作用。
参考文献:
[1]WU J,YAN LJ.Streptozotocin-induced type 1 diabetes in rodents as a model for studying mitochondrial mechanisms of diabetic β cell glucotoxicity[J].Diabetes Metab Syndr Obes,2015,2(8)∶181-188.
[2]QURESHI FM,DEJENE EA,CORBIN KL,et al.Stress-induced dissociations between intracellular calcium signaling and insulin secretion in pancreatic islets[J].Cell Calcium,2015,57(5/6)∶366-375.
[3]KONG X,YAN D,SUN J,et al.Glucagon-like peptide 1 stimulates insulin secretion via inhibiting RhoA/ROCK signaling and disassembling glucotoxicity-induced stress fibers[J].Endocrinology,2014,155(12)∶4676-4685.
[4]MIDAOUI AE,WU R,CHAMPLAIN JD.Prevention of hypertension,hyperglycemia and vascular oxidative stress by aspirin treatment in chronically glucose-fed rats[J].J Hyperterns,2002,20(7)∶1407-1412.
[5]FUKUDA I,MATSUDA H,SUGAHARA S,et al.The effect of intravenous glucose solutions on neonatal blood glucose levels after cesarean delivery[J].J Anesth,2013,27(2)∶180-185.
[6]MORIN J,FAIDEAU B,GAGNERAULT MC,et al.Passive transfer of flt-3L-derived dendritic cells delays diabetes development in NOD mice and associates with early production of interleukin(IL)-4 and IL-10 in the spleen of recipient mice[J].Clin Exp Immunol,2003,134(3)∶388-395.
[7]ZHOU RONGBIN,WEI H,TIAN Z.NK3-like NK cells are involved in protective effect of polyinosinic polycytidylic acid on type 1 diabetes in nonobese diabetic mice[J].J Immunol,2007,178(4)∶2141-2147.
[8]徐志伟,孟祥焕,朱晓波.全脾切除状态下小鼠糖耐量的异常改变[J].中国现代医学杂志,2004,24(23)∶19-25.
[9]朱晓波,常晓彤,宋桂芹,等.脾对部分胰腺切除小鼠血糖浓度的影响[J].中国现代医学杂志,2009,19(2)∶203-205.
[10]朱晓波,徐志伟,姜文静.完全脾切除增加了小鼠胰岛对STZ的敏感性[J].中国病理生理杂志,2011,27(6)∶1157-1161.
[11]YIN D,TAO J,LEE DD,et al.Recovery of islet beta-cell function in streptozotocin-induced diabetic mice∶an indirect role for the spleen[J].Diabetes,2006,55(12)∶3256-3263.
[12]MATSUNAGA T,LI S,ADACHI T,et al.Hyperoxia reverses glucotoxicity-inducedinhibitionofinsulinsecretionbinrat INS-1 β cells[J].Biosci Biotechnol Biochem,2014,78(5)∶843-850.
[13]CERNEA S,DOBREANU M.Diabetes and beta cell function∶frommechanismstoevaluationandclinicalimplications[J].Biochem Med,2013,23(3)∶266-280.
[14]MA ZA.The role of peroxidation of mitochondrial membrane phospholipids in pancreatic β cell failure[J].Curr Diabetes Res,2012,8(1)∶69-75.
[15]CERF ME.High fat diet modulation of glucose sensing in the beta-cell[J].Med Sci Monit,2007,13(1)∶12-17.
[16]LIN Y,SUN Z.In vivo pancreatic β cell specific expression of antiaging gene klotho∶a novel approach for preserving β cells in type 2 diabetes[J].Diabetes,2015,64(4)∶1444-1458.
[17]WANG N,KHAN SA,PRABHAKAR NR,et al.Impairment of pancreatic β cell function by chronic intermittent hypoxia[J].Exp Physiol,2013,98(9)∶1376-1385.
(申海菊 编辑)
Effect of exogenous high glucose on blood glucose of splenectomy mice and its mechanism
Hui-ying LIU1,Wei-dong REN1,Xiao-bo ZHU2
(1.Department of Endocrinology,the First Affiliated Hospital,2.Institute of Pathogen Biology,North University of Hebei,Zhangjiakou,Hebei 075000,P.R.China)
【Objective】To explore the impact of exogenous glucose intervention on the endocrine function of islet β cells and the possible participation of the spleen in this process.【Methods】Splenectomy was performed in mice.The mice were divided into 8 groups including 4 normal groups and 4 splenectomy groups,which were fed with glucose-free water,10%,15%or 20%glucose drinking water respectively for 3 weeks.Fasting plasma glucose and insulin levels were determined in the mice.The incidence of hyperglycemia of each group was calculated.Insulin release test,double immunohistochemical staining of the islet tissue,analyses of reactive oxygen species(ROS)in pancreatic tissue and glucose transporter-2(GLUT-2)expression in β cells were conducted.【Results】Hyperglycemia was induced in the normal and splenectomy mice fed with 20%glucose drinking solution;the incidence was 60%and 75%respectively.The insulin release capacity significantly reduced and apoptosis of the islet β cells occurred in all the hyperglycemic mice.ROS level in the pancreas tissue and the level of GLUT-2 expression changed more significantly in the hyperglycemic mice with splenectomy.【Conclusions】The spleen is involved in protection of the islet endocrine function from damage caused by exogenous glucose intervention.This process relates to increased ROS level and decreased GLUT-2 expression in the islet β cells.
glucose;splenectomy;mouse;islet β cell;apoptosis
R335.6
A
1005-8982(2015)35-0027-06
2015-05-15
朱晓波,E-mail:zjkzxb@sohu.com;Tel:0313-4029270

