间变性大细胞淋巴瘤动物模型的构建与鉴定*
陈芳,刘晓丽,陈玉玲,李亚军,牟东云,白雪芹,邓飞
(1.遵义医学院病理科,贵州遵义563003;2.遵义医学院附属医院肿瘤医院三病区,贵州遵义563000)
·论著·
间变性大细胞淋巴瘤动物模型的构建与鉴定*
陈芳1,刘晓丽1,陈玉玲1,李亚军2,牟东云1,白雪芹1,邓飞1
(1.遵义医学院病理科,贵州遵义563003;2.遵义医学院附属医院肿瘤医院三病区,贵州遵义563000)
目的探索间变性大细胞淋巴瘤(ALCL)小鼠模型的构建方法。方法选取BALB/c小鼠为研究对象,环磷酰胺抑制小鼠机体免疫功能,用Karpas299细胞在小鼠体内建立ALCL模型。结果①ALCL模型成功建立,免疫组织化学结果显示,CD30和间变性淋巴瘤激酶(ALK)阳性;②聚合酶链反应(PCR)结果显示,核基因重组激活基因2(RAG2)条带阳性,大小517 bp;③环磷酰胺腹腔注射后,小鼠外周血CD3、CD8、CD19和CD20阳性细胞比例显著降低,与空白组比较差异有统计学意义(P<0.05);④成瘤组小鼠外周血CD3、CD8、CD19及CD20阳性细胞比例显著低于未成瘤组小鼠(P<0.05)。结论采用环磷酰胺抑制小鼠机体免疫功能,可成功构建BALB/c小鼠ALCL模型;细胞免疫功能低下可能是模型成功建立的原因或机制。
BALB/c小鼠;环磷酰胺;间变性大细胞淋巴瘤;Karpas299细胞株
间变性大细胞淋巴瘤(anaplastic large cell lymphoma,ALCL)是一种T淋巴细胞来源的淋巴瘤。由于肿瘤细胞膜表面高表达CD30抗原,因而也被称为Ki阳性大细胞淋巴瘤。目前治疗ALCL的方法仍以CHOP方案化疗为主,但是该化疗方案对ALCL复发及晚期患者的效果不明显。近年来,以CD30抗原为靶向的治疗药物,如Brentuximabvedotin在晚期CD30阳性[1-2]、间变性大细胞淋巴瘤[3]及霍奇金淋巴瘤的治疗方面显示出良好效果[4-5],但是针对机体抗肿瘤方面的具体效应及药物安全性仍需进行大量的临床研究。由于ALCL发病率较低,约占非霍奇金淋巴瘤的2%~3%[6],收集到足够数量的患者作为研究对象是限制人们认识及治疗该疾病的一大障碍。而临床研究大都基于回顾性分析,因此人们对其认识和了解十分有限。建立ALCL模型,是开展ALCL发病机制、药物疗效等研究的基础。ALCL与免疫系统的关系密切,其发生、发展与机体的免疫微环境是密不可分的。无论是由于T淋巴细胞缺乏导致细胞免疫功能缺陷的裸鼠,还是T、B淋巴细胞联合缺乏导致细胞和体液免疫功能缺陷的SCID小鼠,又或是T、B淋巴细胞联合缺陷同时伴有巨噬细胞、NK细胞活性降低的NOD/SCID小鼠,因其免疫功能缺陷,这些动物模型并不能真实地模拟具有免疫功能的ALCL患者。为能更真实地模拟患者的临床发病,更好地进行针对ALCL的免疫靶向治疗方面的研究,在有免疫力的小鼠身上建立ALCL动物模型尤为重要。本研究经环磷酰胺暂时抑制BALB/c小鼠免疫功能后,成功地建立ALCL荷瘤模型,并运用流式细胞术(flow cytometry,FCM)检测小鼠成瘤过程中外周血T/B细胞表型的变化规律,初步揭示BALB/c小鼠的成瘤免疫学机制,为后期研究奠定良好的实验基础。
1 材料与方法
1.1细胞和动物
雌性BALB/c小鼠25只,4~6周龄,无特定病原体(specific pathogen free,SPF)级,购自北京阜康生物科技有限公司,动物生产许可证编号:SCXK(京)2014-0004。人间变性大细胞淋巴瘤细胞株Karpas 299购于美国菌种保藏中心细胞库。
1.2主要试剂及仪器
环磷酰胺购自吉林修正药业集团股份有限公司,鼠抗人间变性淋巴瘤激酶(anaplasticlymphoma kinase,ALK)单克隆抗体、鼠抗人CD30单克隆抗体、鼠抗人CD20单克隆抗体、鼠抗人CD45RO单克隆抗体、山羊抗鼠二抗购自北京中杉生物有限公司,Ezup柱式血液基因组DNA抽提试剂盒、核基因重组激活基因2(recombination activating gene,RAG2)特异性引物购购自上海生工生物工程有限公司,抗鼠CD3、CD4、CD8、CD19、CD20荧光抗体及相应同型对照购自美国eBiosciense公司,流式细胞仪及其配套的计算机软件数据处理系统购自美国Becton Dickinson公司。
1.3实验方法
1.3.1 肿瘤细胞培养复苏Karpas299,磷酸盐缓冲溶液(phosphate buffer saline,PBS)洗涤3次,无血清1640培养基洗涤3次,用含有20%胎牛血清、1%谷氨酰胺及双抗的1640培养液将细胞混匀,37℃、5%二氧化碳CO2培养箱中培养,每天换液1次。
1.3.2 苏木精-伊红染色法(hematoxylin-eosin staining,HE)及免疫组织化学法检测将25只BALB/c小鼠随机分为5组,A组为空白对照组,其余B、C、D及E组为实验组。用环磷酰胺(cyclophosphamide,CTX)250 mg/(kg·只)对BALB/c行一次腹腔注射,3 d后将制备好的ALCL细胞悬液(5×106个/0.5 ml)注入实验组小鼠的右上肢腋下,每隔3天在小鼠相同部位皮下注射,共种植3次。注射后0~2个月观察动物是否成瘤,待出现皮下肿块后,取该小鼠皮下肿块进行HE染色观察,免疫组织化学法检测肿瘤组织中CD30、ALK、CD45RO、CD20等抗原的表达。
1.3.3 RAG2基因表达聚合酶链反应(polymerase chain reaction,PCR)检测雌性BALB/c小鼠外周血中是否表达RAG2基因。按试剂盒说明书操作提取小鼠外周血DNA。BALB/c小鼠RAG2序列,正向引物:5'-GAGGAATCTCTGTCTCCAGTGC-3',反向引物:5'-TCAACATCACAAGTAGGGCAAC-3',产物大小517 bp。PCR反应体系为20μl。反应条件:95℃预变性3min,94℃变性30s,56℃退火30s,72℃延伸30s,共35个循环。4℃保存PCR产物,2%琼脂糖凝胶电泳检测PCR扩增产物及凝胶成像系统并拍照。
1.3.4 检测外周血T、B淋巴细胞亚群比例的变化流式细胞术检测建模中BALB/c小鼠外周血T、B淋巴细胞亚群比例变化。取环磷酰胺处理及皮下接种Karpas299细胞后的BALB/c小鼠,观察期为0~2个月。建模第24天将接种肿瘤细胞后的小鼠分为两组,即成瘤组和未成瘤组。在环磷酰胺注射后的第3、10、17和24天,摘眼取血法收集小鼠外周血于抗凝管中,加入3倍体积的红细胞裂解液,冰上静置10 min,4℃、1 500 r/min离心5 min,弃上清液;加入2 ml 0.1%的BSA-PBS洗涤,离心方法同前,重复3次;加入200μl PBS重悬,分装到流式管1号和2号各100μl;在1号管中加入1.0μl抗鼠CD3-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)、0.7μl抗鼠CD19-别藻蓝蛋白(Allophycocyanin,APC),在2号管中加入0.5μl抗鼠CD4-FITC、0.7μl抗鼠CD8-APC、1.3μl抗鼠CD20-藻红蛋白(Phycoerythrin,PE),各单克隆抗体相应同型对照按相同组合和相同剂量加入另外的流式管3号和4号中(抗体剂量参照美国eBiosciense公司相应流式抗体说明书)。涡旋振荡器震荡3次,避光孵育20 min,加入2 ml 0.1%BSA-PBS离心,弃上清液,加入1%多聚甲醛200μl固定。上机检测或4℃避光保存,检测外周血CD3、CD4、CD8、CD19及CD20的变化。
1.4统计学方法
采用SPSS 19.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,用正态分布、方差齐性检验,组间比较采用单因素方差分析(One-way,ANOVA),方差齐用LSD法,方差不齐用DunnettT3法,生存分析用Kaplan-Meier法,生存曲线的比较用Log-rank检验,P<0.05为差异有统计学意义。
2 结果
2.1小鼠一般及存活状况
环磷酰胺处理后观察各实验组无死亡现象,Karpas299细胞悬液移植到小鼠左或右上肢皮下,实验组(B、C、D及E组)小鼠于次日即出现明显的急性移植物抗宿主病(acute graft versus host disease,aGVHD)反应,表现为毛发竖立、不顺无光泽,活动量减小,进食量下降,体重减轻等,并出现小鼠聚堆现象,个别小鼠还出现弓背体位。移植后第1周反应较重,第2周开始aGVHD反应减轻。移植后第5天开始,各移植实验组小鼠皮下陆续出现肿块。最后一次移植细胞至处死小鼠,共观察60 d。移植组小鼠总体成瘤率为80%(16/20),肿瘤生长处皮肤出现脱毛及溃烂表现。仅C组有1只成瘤小鼠自然死亡,其余小鼠全部存活,为人为脱颈处死。见表1。
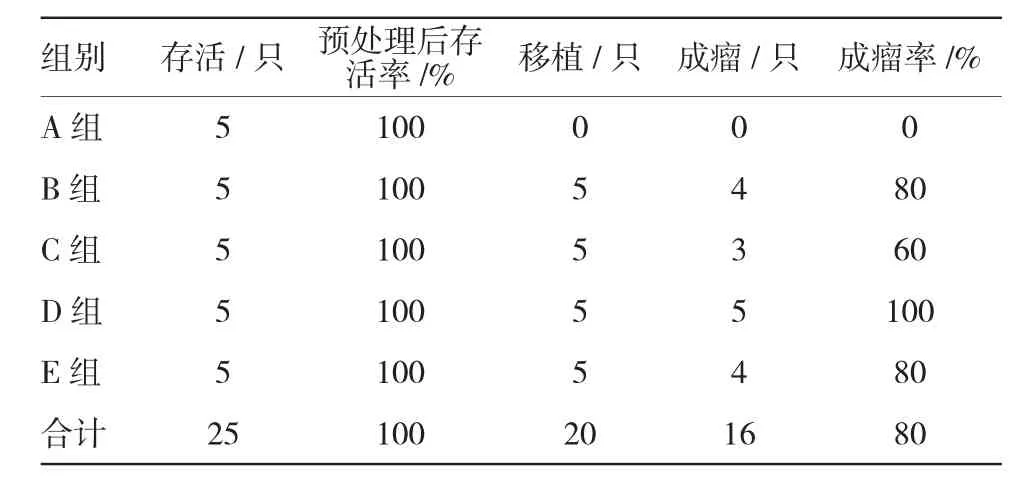
表1 各组小鼠成瘤率比较
2.2小鼠肿瘤的形态学观察和鉴定
2.2.1 肿瘤的形态学观察空白对照组小鼠(A组)未见异常变化。80%的实验组小鼠(B、C、D及E组)于左或右上肢皮下可见明显肿块,触之无波动感,因肿块位于小鼠上肢,影响小鼠活动,致各实验组小鼠活动量减小。解剖肿瘤组织发现,肿瘤组织固定分布于小鼠左或右上肢接种部位,与周围组织分界不清楚,圆形或椭圆形,肿块最大达20 mm×20 mm×10 mm,切面呈鱼肉状外观。解剖其他脏器,未见腹水形成及腹腔脏器粘连,未见其余脏器和远处淋巴结浸润及转移。小鼠种植肿瘤组织见图1。
2.2.2 肿瘤的组织学鉴定取肿瘤组织行HE染色观察,肿瘤细胞形态多样、体积较大(约为2~3个组织细胞体积大小),呈圆形、椭圆形或多边形。细胞核多样性,呈圆形、椭圆形或不规则形,见胚胎样核,核型弯曲,核膜一侧平滑微凸,另一侧凹陷见多个切迹。部分瘤细胞与霍奇金病瘤巨细胞(Reed-sternberg,R-S)的双核瘤细胞相似,但未见诊断性R-S细胞。免疫组织化学法检测显示,肿瘤组织CD30阳性,ALK阳性,CD45RO阳性,CD20阴性。经鉴定为ALK阳性的间变性大细胞淋巴瘤。见图2、3。

图1 小鼠肿瘤解剖图
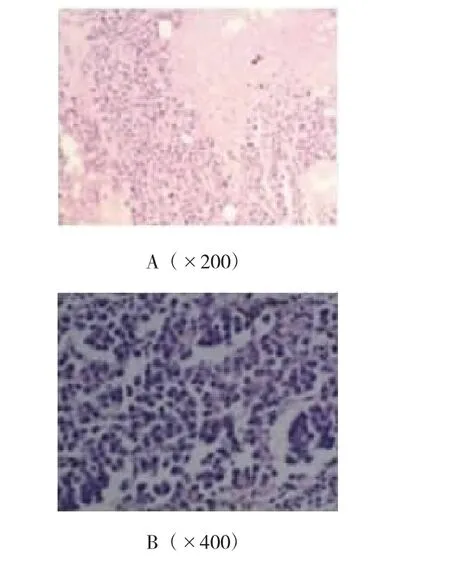
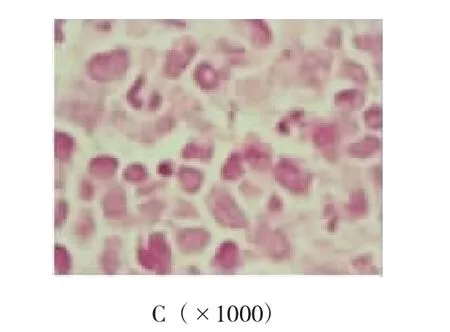
图2 小鼠肿瘤病理组织HE染色
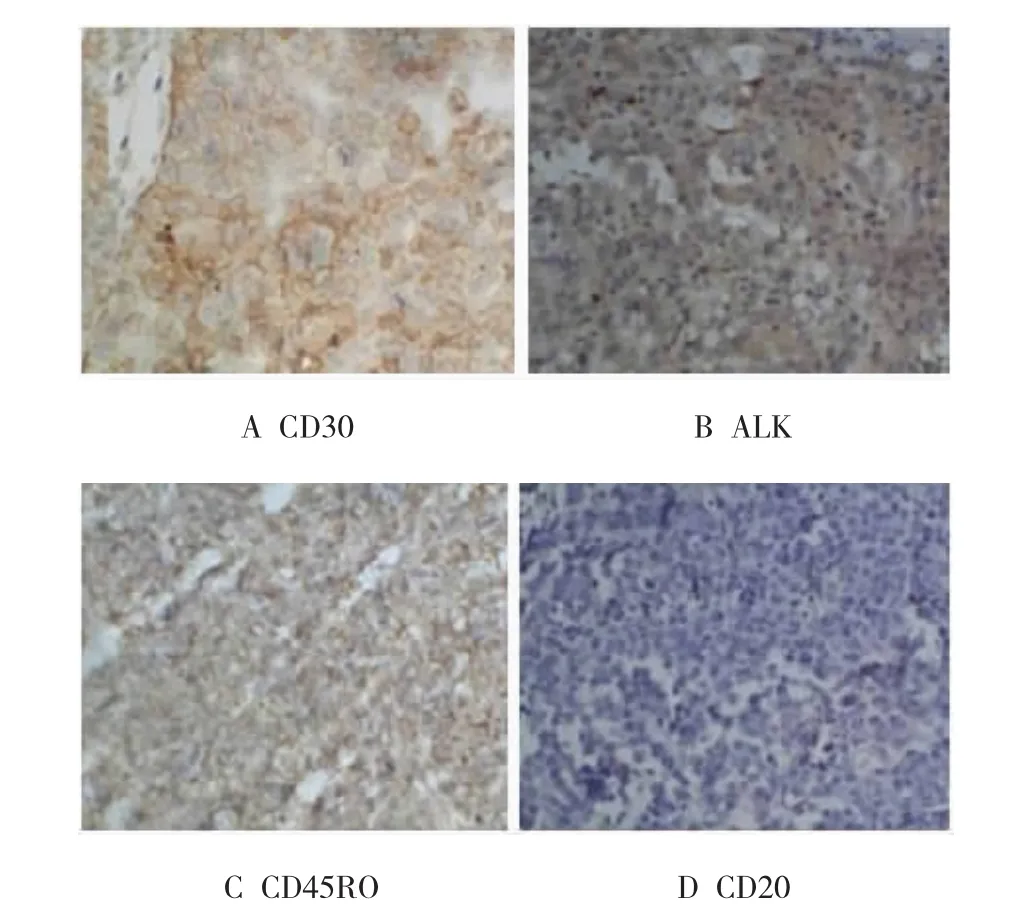
图3 小鼠肿瘤组织免疫组织化学法检测(×400)
2.3小鼠外周血中RAG2基因的表达
PCR检测雌性BALB/c小鼠外周血中RAG2基因表达结果显示,扩增出RAG2基因517 bp特异性DNA条带,而对照组NOD/SCID小鼠则未见该条带。见图4。
2.4不同时间BALB/c小鼠外周血T、B淋巴细胞亚群比例
按照上述建模方法重新订购36只小鼠,分别检测注射CTX前(空白组)及注射CTX后第3、10、17和24天小鼠T/B细胞免疫表型的变化,环磷酰注射后第3天,CD19阳性细胞比例首先下降,低于空白组(P<0.05);第10天,所有免疫参数值低于空白组,其中CD3、CD4、CD8、CD19及CD20阳性细胞比例下降,差异有统计学意义(P<0.05);第17天CD3、CD4、CD8及CD19阳性细胞较第10天开始回升,但CD8、CD19和CD20阳性细胞比例仍低于空白组(P<0.05)。至建模后第24天检测未成瘤组与成瘤组小鼠外周血T、B淋巴细胞,未成瘤组CD3、CD4、CD8及CD20阳性细胞比例明显高于成瘤组(P<0.05)。见表2、3。
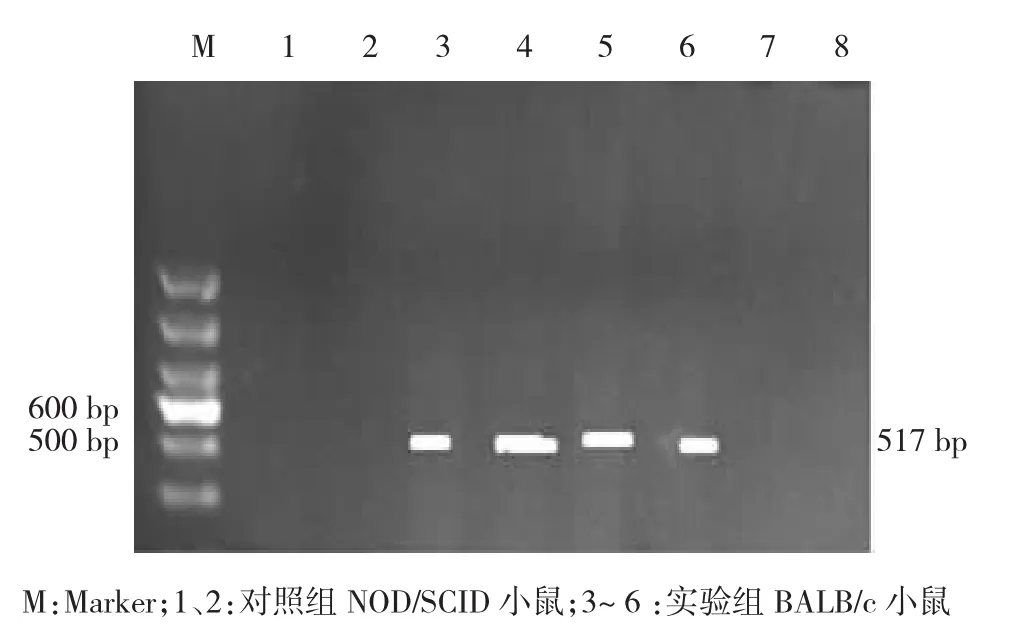
图4 小鼠外周血中RAG2的PCR检测
表2 各组小鼠外周血的免疫水平变化(n=6±s)
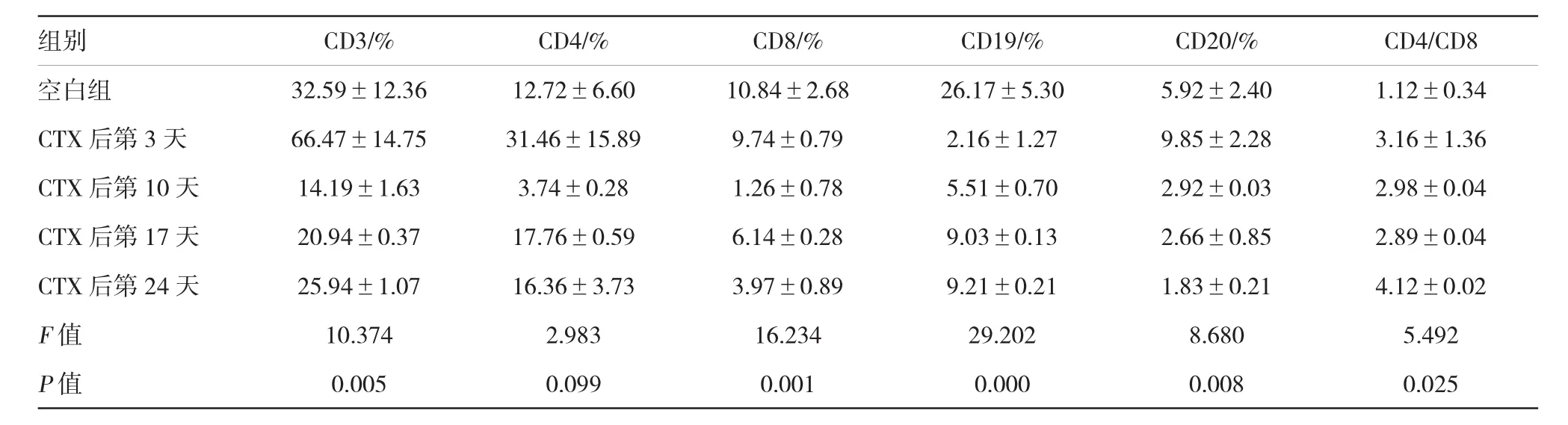
表2 各组小鼠外周血的免疫水平变化(n=6±s)
组别CD3/%CD4/%CD8/%CD19/%CD20/%CD4/CD8空白组32.59±12.3612.72±6.6010.84±2.6826.17±5.305.92±2.401.12±0.34 CTX后第3天66.47±14.7531.46±15.899.74±0.792.16±1.279.85±2.283.16±1.36 CTX后第10天14.19±1.633.74±0.281.26±0.785.51±0.702.92±0.032.98±0.04 CTX后第17天20.94±0.3717.76±0.596.14±0.289.03±0.132.66±0.852.89±0.04 CTX后第24天25.94±1.0716.36±3.733.97±0.899.21±0.211.83±0.214.12±0.02F值10.3742.98316.23429.2028.6805.492P值0.0050.0990.0010.0000.0080.025
表3 成瘤组与未成瘤组小鼠外周血T、B淋巴细胞亚群比例(n=6,±s)

表3 成瘤组与未成瘤组小鼠外周血T、B淋巴细胞亚群比例(n=6,±s)
组别CD3/%CD4/%CD8/%CD19/%CD20/%CD4/CD8成瘤组3.83±2.122.03±0.920.41±0.231.24±1.215.27±1.715.8±4.34未成瘤组P值37.10±21.31 0.010 29.42±19.45 0.007 1.95±0.48 0.000 0.49±0.18 0.000 33.12±15.07 0.001 14.29+6.45 0.094
3 讨论
1985年德国病理学家STEIN等在制备CD30单抗过程中首次描述间变性大细胞淋巴瘤,属于恶性侵袭性T细胞淋巴瘤的一个亚型。2008年,WHO在淋巴瘤的最新分类中,根据原发系统性ALCL是否表达ALK激酶,分为ALCL阴性、ALK阳性及ALCL阴性、ALK阴性[7-9]。因其发病率极低,收集到足够数量的ALCL临床病例来进行ALCL药物靶向治疗方面的研究较困难,故成功建立ALCL动物模型是深入研究该疾病及其治疗策略的重要途径。ALCL属淋巴造血系统的恶性肿瘤,与人体免疫系统密切相关,因此在具有免疫功能的小鼠身上建立肿瘤模型才能更真实地模拟肿瘤自然发生的过程。而目前建立的小鼠肿瘤动物模型中,选用的小鼠多为免疫缺陷鼠,如裸鼠、SCID及NOD/SCID小鼠[10-11]。而NOD/SCID小鼠,是SCID小鼠与非肥胖糖尿病小鼠(NOD/Lt)杂交而成,其不仅有SCID小鼠的V(D)J重排缺陷,还缺乏功能性自然杀伤细胞(natural killer cell,NK)及循环补体。正常小鼠体内RAG2基因参与淋巴细胞发育和V(D)J基因的重排[12-14]。而免疫缺陷的SCID小鼠及NOD/SCID小鼠,因抗原V(D)J基因重排受阻,体内无法检测到RAG2基因。本实验将RAG2基因作为鉴定BALB/c小鼠与免疫缺陷小鼠的一个鉴别点。
淋巴造血系统来源的肿瘤与复杂的免疫环境密切相关,而且患者并非都有免疫缺陷。因此无论是在T细胞缺陷还是T、B细胞联合缺陷的小鼠身上建立肿瘤模型,与真正肿瘤患者所处的免疫微环境并不一致,该模型并不能模拟具有免疫功能的ALCL患者。国内学者刘芳等[11]也在具有正常免疫力的BALB/c小鼠身上成功构建鼠源性的淋巴瘤动物模型,但在BALB/c小鼠身上建立人源性的ALCL模型国内外鲜见报道。
由于BALB/c小鼠直接接种人源性Karpas299细胞后有严重的免疫排斥反应,所以应首先对BALB/c小鼠进行暂时的免疫抑制后才能进行小鼠的成瘤实验。目前,暂时抑制小鼠免疫反应的方法主要有:①移植前采取亚致死剂量照射;②移植前应用NK细胞抗体降低NK细胞活性;③使用具有免疫抑制作用的化疗药物对动物进行预处理。因环磷酰胺是一种具有强烈骨髓抑制作用的经典烷化剂类免疫抑制剂,单次高剂量一次性腹腔注射可造成机体的免疫功能暂时性下降,调节性T细胞CD4+T细胞比例下调50%左右。免疫抑制2周后,机体的免疫功能可逐渐恢复[15]。该结果与本实验T/B细胞各亚型指标基本相符。有研究表明,大剂量环磷酰胺注射后可诱导动物对机体免疫耐受,对多种特异性抗原在一段时间内无应答反应。但是关于环磷酰胺建立动物免疫抑制模型的方法,目前国内外没有统一的给药剂量标准。本实验室经过长期的实验摸索,探索出环磷酰胺最佳建模剂量为250 mg/kg一次性腹腔注射。
本实验选取成熟T细胞的特异性标志细胞表型CD3及其分化后的CD4+(Th)、CD8+(CTL)和B细胞表型CD19、CD20作为检测指标。在抗瘤效应方面,CD4+T细胞的功能不仅限于辅助细胞毒T细胞,而且可以协助NK细胞清除和杀灭肿瘤,甚至还具有不依赖于CD8+CTL的肿瘤杀伤作用。CD8+CTL在肿瘤免疫中起关键性作用,主要通过FasL/Fas、颗粒酶的途径直接杀伤肿瘤细胞。CD19表达于全部B细胞上,是鉴定B细胞的重要标志之一。CD20发挥调节B细胞增殖、分化的功能,在B细胞激活后逐渐丢失。B细胞产生抗瘤抗体并通过抗体依赖性细胞介导的细胞毒作用(antibody-dependent cell-mediated cytotoxicity,ADCC)发挥抗瘤效应,还可对各种免疫细胞进行调节或作为抗原提呈细胞参与肿瘤免疫。通过检测经环磷酰胺处理后的外周血T、B淋巴细胞亚群发现,注射环磷酰胺第3天,CD19+B细胞开始下降,这符合B淋巴细胞较T细胞对环磷酰胺更为敏感的报道。而肿瘤细胞接种后的第1周,CD3+、CD8+细胞比例下降尤为明显,此时机体经历严重的免疫抑制过程;第10天,CD3+、CD4+、CD8+、CD19+及CD20+下降到最低水平。环磷酰胺所致小鼠体内免疫功能下降,为Karpas299细胞的免疫逃逸及在小鼠体内生长创造条件,因此本实验在注射环磷酰胺后的第3天开始注射Karpas299细胞。在实验前期的预实验中,笔者曾采用一次性注射肿瘤细胞的方法建立肿瘤模型,但小鼠成瘤率极低,个别成瘤小鼠有自发性消退现象。考虑为移植细胞数量太少,小鼠体内尚存的免疫功能使肿瘤细胞无法在体内存活,所以在后期实验中笔者采用间隔注射法,即每4天1次,共注射3次,使小鼠的成瘤率达80%。流式细胞术检测小鼠第17和24天外周血,与第10天CD3+、CD4+、CD8+、CD19+及CD20+比较,各检测指标虽然已开始恢复,但仍较空白组低。且小鼠体内肿瘤依旧能迅速生长,分析其原因可能是小鼠体内已发生肿瘤免疫耐受,形成适合肿瘤生长的免疫微环境。
注射肿瘤细胞24 d后,按小鼠注射部位是否有可见肿块将小鼠分为未成瘤组与成瘤组,检测小鼠外周血中T、B淋巴细胞表型。未成瘤组CD3+、CD4+、CD8+及CD20+细胞比例较成瘤组高(P<0.01),考虑可能是小鼠对环磷酰胺的耐受存在个体差异。即使对环磷酰胺耐受较强的小鼠按照250 mg/kg体重给药,机体仍存在较高的免疫力,使Karpas299细胞在体内无法正常存活。同时机体庞大的免疫网络和肿瘤的相互作用使肿瘤免疫异常复杂,肿瘤细胞在小鼠体内正常生长需经历一系列适应过程。但未成瘤组小鼠的T、B细胞各亚群比例较成瘤组高,说明在机体的抗肿瘤免疫过程中,细胞免疫和体液免疫均为重要的免疫杀伤因素。本实验检测间变性大细胞淋巴瘤成瘤过程中特异性免疫细胞T、B细胞在建瘤过程中的免疫表型变化,而对T、B细胞在抗肿瘤中的具体作用及其分泌的细胞因子对肿瘤影响的研究,尚需实验来进一步验证。
综上所述,本实验使用环磷酰胺免疫抑制处理BALB/c小鼠后,可成功建立ALCL模型,为后续ALCL的免疫靶向治疗提供较好的实验基础。
[1]FERRERI AJ,GOVI S,PILERI SA,et al.Anaplastic large cell lymphoma,ALK-negative[J].Crit Rev Oncol Hematol,2013,85(2)∶206-215.
[2]YOUNES A,GOPAL AK,SMITH SE,et al.Results of a pivotal phaseⅡstudy of brentuximab vedotin for patients with relapsed or refractory Hodgkin's lymphoma[J].Journal of Clinical Oncology,2012,30(18)∶2183-2189.
[3]BARTLETT NL,CHEN R,FANALE MA,et al.Retreatment with brentuximabvedotin in patients with CD30-positive hematologic malignancies[J].J HematolOncol,2014,7(1)∶24.
[4]YOUNES A,CONNORS J,PARK SI,et al.Brentuximabvedotin combined with ABVD or AVD for patients with newly diagnosed Hodgkin'slymphoma∶aphase1,open-label,dose-escalation study[J].Lancet Oncol,2013,14(13)∶1348-1356.
[5]VAKLAVAS C,FORERO-TORRES A.Safety and efficacy of brentuximabvedotin in patients with hodgkin lymphoma or systemicanaplasticlargecelllymphoma[J].TherAdvHematol,2012,3(4)∶209-225.
[6]FALINI B,MARTELLI MP.Anaplastic large cell lymphoma∶changes in the World Health Organization classification and perspectives fortargetedtherapy[J].Haematologica,2009,94(7)∶897-900.
[7]REUSCH U,BURKHARDT C,FUCEK I,et al.A novel tetravalent bispecific TandAb(CD30/CD16A)efficiently recruits NK cells for the lysis of CD30 tumor cells[J].MAbs,2014,6(3)∶34-37.
[8]TURTURRO F,ARNOLD MD,FRIST AY,et al.Effects of adenovirus-mediatedexpressionofp27Kip1,p21Waf1and p16INK4A in cell lines derived from t(2;5)anaplastic large cell lymphoma and Hodgkin's disease[J].Leuk Lymphoma,2002,43(6)∶1323-1328.
[9]GEORGE SK,VISHWAMITRA D,MANSHOURI R,et al.The ALKinhibitorASP3026eradicatesNPM-ALK(+)T-cell anaplasticlarge-celllymphomainvitroandinasystemic xenograft lymphoma model[J].Oncotarget,2014,5(14)∶5750-5763.
[10]TURTURRO F,HEINEKE HL,DREVYANKO TF,et al.Adenovirus-p53-mediated gene therapy of anaplastic large cell lymphoma with t(2;5)in a nude mouse model[J].Gene Ther,2000,7(11)∶930-933.
[11]刘芳,张弓,陈小艳,等.播散性鼠B细胞淋巴瘤动物模型的建立[J].临床与实验病理学杂志,2008,24(3)∶353-357.
[12]THEOCHARIDES A,LOOSER R,SKODA RC,et al.EngraftmentofhumanpolycythemiaveraCD34+cellsinhSIRPα-transgenic-human-tpo-ex pressingRAG2-/-,IL2R-/-immunodeficient mice[J].Blood,2013,122(21)∶2844-2844.
[13]ZHANG M,YAO Z,ZHANG Z,et al.The anti-CD25 monoclonal antibody 7G7/B6,armed with the alpha-emitter 211At,provides effective radioimmunotherapy for a murine model of leukemia[J].Cancer Res,2006,66(16)∶8227-8232.
[14]WADA S,YOSHIMURA K,HIPKISS EL,et al.Cyclophosphamideaugmentsantitumorimmunity∶studiesinanautochthonous prostate cancer model[J].Cancer Res,2009,69(10)∶4309-4318.
[15]王聪,王一腾,魏鑫.环磷酰胺的临床应用现状[J].临床和实验医学杂志,2008,7(8)∶179.
(申海菊 编辑)
Establishment of anaplastic large cell lymphoma model in mice*
Fang CHEN1,Xiao-li LIU1,Yu-ling CHEN1,Ya-jun LI2,Dong-yun MOU1,Xue-qin BAI1,Fei DENG1
(1.Department of Pathology,Zunyi Medical College,Zunyi,Guizhou 563003,P.R.China;2.The Third Ward,the Affiliated Tumor Hospital,Zunyi Medical College,Zunyi,Guizhou 563000,P.R.China)
【Objective】To evaluate the establishment method of anaplastic large cell lymphoma(ALCL)model in mice.【Methods】BALB/c mice were chosen as research subjects.Cyclophosphamide(CTX)was used to inhibit the immune function of mice,and then the ALCL model was established by Karpas 299 subcutaneous injection.【Results】①ALCL model was successfully established.The immunohistochemistry result showed both CD30 and anaplastic lymphoma kinase(ALK)were positive.②The PCR result showed that the RAG2gene was positive and had 517 bp.③The percentages of CD3+,CD8+,CD19+and CD20+cells after CTX injection were lower than those before injection((P<0.05).④The percentages of CD3+,CD8+,CD19+and CD20+cells in the tumor group were significantly lower than those in the non-tumor group(P<0.05).【Conclusions】Using cyclophosphamide to inhibit the immune function,ALCL model of BALB/c mice can be successfully established.The low cellular immune function may be the reason or mechanism of successful establishment of ALCL model.
BALB/c mouse;cyclophosphamide;anaplastic large cell lymphoma;Karpas 299 cell line
1005-8982(2015)35-0001-06
R733
A
2015-03-25
国家自然科学基金(No:81160300)
邓飞,E-mail:hishnuj778@126.com

