猪圆环病毒2型PCR快速检测方法的建立
于新友 李天芝 王金良 李 峰 沈志强,(山东绿都生物科技有限公司,山东滨州56600;山东省滨州畜牧兽医研究院,山东滨州56600)
猪圆环病毒2型PCR快速检测方法的建立
于新友1李天芝1王金良2李峰2沈志强1,2
(1山东绿都生物科技有限公司,山东滨州256600;2山东省滨州畜牧兽医研究院,山东滨州256600)
摘要:根据GenBank公布的猪圆环病毒2型保守序列设计了一对引物,建立了检测猪圆环病毒2型PCR方法,并对其特异性、敏感性进行了研究。该PCR方法对猪圆环病毒2型的扩增结果为阳性,而对对照毒株的扩增结果均为阴性;对猪圆环病毒2型检测的灵敏度为1 pg总DNA量。以上结果表明该PCR方法特异性强、敏感性高、简便、快速,可用于猪圆环病毒2型的早期确诊和病毒鉴定。
关键词:猪圆环病毒2型;PCR方法;快速检测
猪圆环病毒依据其致病性和基因组差异分为无致病性的猪圆环病毒1型(Porcine Circovirus 1, PCV1)和有致病性的猪圆环病毒2型(Porcine Circovirus 2, PCV2),PCV2是引起仔猪断奶后多系统衰竭综合征(post -weaning multisyste wasting syndrome, PMWS)[1]的主要病原,此外,PCV2还与猪皮炎与肾炎综合征(porcine dermatitis andnephropathy syndrome, PDNS)、猪呼吸道综合征(porcine respiratory disease complex, PRDC)及繁殖障碍以及肠炎等疾病有关[2],是一种免疫抑制性疾病,给世界养猪业造成严重的经济损失[3-5]。2000年,我国首次报道了PCV2感染,目前,PCV2感染在我国猪群中广泛存在,种猪有很高的感染率,与其他疾病混合感染的现象严重,临床上表现为不同的综合征。
PCV2的传统检测方法有病毒分离、酶联免疫吸附试验、免疫荧光法和免疫组化法等,这些方法均有很多缺点,如耗时长、检测敏感性较低及准确性差等,尤其不能检测亚临床感染的猪。PCR检测方法以检测快速、灵敏度高、特异性好等特点已经广泛应用于细菌和病毒的检测,并具有良好的应用前景。为调查山东省PCV2的流行情况,本研究根据GenBank公布的PCV2基因(DQ104423)序列建立了一种特异、敏感的PCV2检测方法,并用该法对采自山东省各地的PCV2疑似病料进行检测。
1 材料和方法
1.1病毒株与病料
猪圆环病毒2型(PCV2)、猪圆环病毒1型(PCV1)、猪瘟病毒(CSFV)、猪蓝耳病病毒(PRRSV)、猪细小病毒(PPV)、猪伪狂犬病毒(PRV)及流行性乙型脑炎病毒(JEV)由山东省滨州畜牧兽医研究院预防兽医学与动物生物技术重点开放实验室保存,临床疑似病料为2013年10月—2014年11月采自山东省各地猪场临床诊断为PCV2感染猪的脾脏及淋巴结等。
1.2工具酶及试剂盒
pMD18-T载体、限制性内切酶、PCR相关试剂、DNA Marker 和DNA凝胶回收试剂盒,购自宝生物工程(大连)有限公司;AxyPrep体液病毒DNA小量试剂盒购自爱思进生物技术(杭州)有限公司。
1.3PCR引物设计与合成
根据GenBank中登录的PCV2基因序列(DQ104423),应用Primer Premier 5.0软件,设计1对特异性引物,扩增PCV2的515 bp基因片段。引物在生工生物工程(上海)股份有限公司合成。上游引物:5′-GTGGTTGTTATTGATGAC -3′,下游引物:5′-AATCAGCTTTG GCTGAGGC-3′。
1.4PCV2基因组DNA的提取
按AxyPrep体液病毒DNA小量试剂盒的使用说明书提取PCV2 的DNA,并提取PCV1、CSFV、PRRSV、PPV、PRV、JEV等病毒的核酸。
1.5PCV2的PCR反应条件的确立
以提取的PCV2 DNA作为模板,进行PCR反应,扩增。在其他条件不变的情况下,对反应的退火温度进行优化,分别采用40、42、44、46、48及50℃6种不同的退火温度进行扩增;在其他条件不变的情况下,对反应的引物浓度进行优化,分别采用0.2、0.4、0.6、0.8、1.0、及1.2 μmol/L 6种不同引物浓度进行扩增。反应体系保持为25 μL,PCR反应的条件保持不变,为95℃预变性5分钟,95℃30秒、46℃30秒,72℃30秒,共30个循环,最后72℃延伸10分钟。
1.6PCR扩增产物的检测及鉴定
取5 μL PCR产物用1.5%琼脂糖凝胶进行电泳检测,紫外灯下观察扩增结果。如果有目的条带,则切下目的条带,按照DNA凝胶回收试剂盒的说明书操作,回收目的片段。将回收后的片段与pMD18-T连接。将连接产物转化大肠杆菌感受态DH5α,37℃过夜培养后,挑取单菌落摇菌过夜,按质粒提取试剂盒的说明书抽提培养菌液的质粒,用建立的PCR方法检测质粒是否含有。如果含有,将提取的质粒发送生工生物工程(上海)股份有限公司进行测序。将测序结果与参照的PCV2基因序列进行基因相似性分析。
1.7特异性试验
分别提取PCV2、PCV1、CSFV、PRRSV、PPV、PRV、JEV等7种不同的病毒核酸作为模板,用已建立的PCR检测方法进行扩增。
1.8敏感性试验
提取PCV2基因组DNA,用仪器测定含量,然后10倍系列稀释,使PCV2基因组DNA的含量分别为10 ng、1 ng、100 pg、10 pg、1 pg 及0.1 pg。分别将其作为模板,用建立的方法分别进行PCR检测扩增,确定PCR检测方法的敏感性。
1.9重复性试验
为了验证所建立PCR检测方法的重复性,分别提取3批PCV2阳性病料、阴性病料以及6种阴性对照病毒如PCV1、CSFV、PRRSV、PPV、PRV及JEV的核酸作为模板,进行PCR扩增反应。
1.10临床样品的检测
提取临床上送检的35份PCV2疑似病料的基因组DNA为模板,用建立的PCR检测方法扩增检测。
2 结果与分析
2.1扩增产物的检测
用1.5%琼脂糖凝胶电泳检测PCR产物,结果在约515 bp出现目的DNA条带(图1),和预期大小一致。
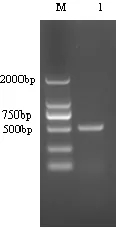
图1 PCV2扩增结果
2.2特异性试验
利用所设计的引物及所确定的最佳反应条件分别对PCV2、PCV1、CSFV、PRRSV、PPV、PRV和JEV进行PCR扩增。结果7个毒株中只有PCV2能扩增出相应的片段,大小为515 bp(预期515 bp),而其他均未扩增出相应的片段(图2)。说明本研究建立的方法特异性很好。
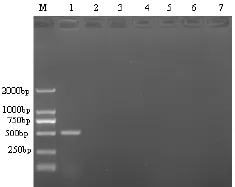
图2 特异性试验
2.3敏感性试验
用1.5%琼脂糖凝胶电泳分别检测5 μL PCR扩增产物,1~5号样品产物在515 bp位置均有目的条带,6号样品产物无扩增条带。结果显示,引物的检测灵敏度可达1 pg DNA(图3)。

图3 敏感性试验
2.4重复性试验
重复性试验结果显示,3批不同病料的检测结果相同,说明建立的PCR检测方法重复性好、可靠、稳定。
2.5临床样品的检测
用建立的方法检测的35份临床疑似PCV2病料中,有10份结果呈阳性。
3 讨论
本试验对GenBank公布的PCV2基因序列进行比对,发现PCV2相对比较保守,查找出其高度保守区域,参照GenBank中登录的PCV2基因序列(DQ104423),利用Primer Premier5.0设计1对引物,通过PCR扩增出目的基因,连接到pMD18-T载体,送样测序,对测序结果与模板序列进行比对,其同源性为100%。对退火温度优化,发现只有当退火温度为46℃时,才能获得较为理想的产物,其他温度即使相差2℃也不能获得理想的试验结果。对引物浓度进行优化,在引物浓度为0.2、0.4、0.6、0.8、1.0及1.2 μmol/L时不影响PCR反应的扩增效率,扩增效率相对较高的引物浓度为0.6μmol/L,扩增效率相对较低的引物浓度为1.2μmol/L。敏感性试验结果显示,本检测方法的灵敏度可以达到1 pg DNA。本试验所建立的PCV2 PCR检测方法能够扩增出515 bp目的片段,而对常见的猪病病毒,如PCV1、CSFV、PRRSV、PPV、PRV 和JEV均无扩增产物,证明本方法具有很好的特异性。用建立的PCV2 PCR检测方法,检测35份临床疑似PCV2病料,检出10份PCV2阳性病料。因此,本试验为PCV2的流行病学调查和检测提供了一种简单、快速和有效的检测方法。
参考文献
[1] Clark EG. Post -weaning multisystemic wasting syndrome [J]. Proceeding of the American Association of Swine Practitioners, 1997(28):499-501.
[2]游一,许保疆,王克领,等.规模化猪场猪圆环病毒病的诊断及综合防制[J].中国畜牧兽医, 2009, 36(9):152-154.
[3]殷震,刘景华.动物病毒学[M].第2 版.北京:科学出版社, 1997:1175-1182.
[4] Harms PA, Sorden SD, Halbur PG. Three cases of porcinerespiratory disease complex associated with porcine circovirustype2 infection [J]. Swine Health and Production, 2002(38):528-539.
[5] Neumann EJ, Dobbinson, Welch EB, et al. Descriptive sum-mary of an outbreak of porcine post -weaning multisystemicwasting syndrome (PMWS) in New Zealand [J]. New Zeal-and Veterinary Journal, 2007 (55):346-352.
中图分类号:S828.28
文献标识码:B
文章编号:1673-4645(2015)03-0048-03
收稿日期:2014-11-27
基金项目:山东省现代农业产业技术体系生猪产业创新团队项目(SDAIT-06-011-14)
作者简介:于新友(1983-),男,汉族,山东菏泽人,助理研究员,硕士,主要从事动物传染病诊断技术研究,Email:yuxinyou_2006@126.com

