急性脑梗死患者血清hsCRP水平与颈动脉粥样硬化斑块的相关性研究
于源东
急性脑梗死患者血清hsCRP水平与颈动脉粥样硬化斑块的相关性研究
于源东
目的探讨急性脑梗死患者超敏C-反应蛋白(hs-CRP)表达水平与颈动脉粥样硬化性斑块发生的相关性。方法选取2010年6月—2012年3月住院治疗的急性脑梗死患者178例为研究对象,同时选取同期健康人60名作为对照组。分别检测不同观察者hs-CRP表达水平,对比分析急性脑梗死患者与对照组hs-CRP水平。对于急性脑梗死患者按照颈动脉内-中膜厚度(IMT)、斑块类型分组,对比分析不同组别间hs-CRP水平,分析hs-CRP与颈动脉粥样硬化斑块发生的相关性。结果急性脑梗死组患者血清hs-CRP表达水平为(7.87±3.94)mg/L,组间对比发现,急性脑梗死组的hs-CRP表达水平显著升高;斑块形成组患者的hs-CRP表达水平最高,达到(12.40±3.57)mg/L,与IMT正常组、内膜增厚组相比显著升高,且内膜增厚组患者的hs-CRP水平与IMT正常组相比也显著升高;不稳定斑块组的血清hs-CRP表达水平为(14.63±3.41)mg/L,与稳定斑块组患者相比显著升高。结论急性脑梗死患者血清hs-CRP的表达水平显著升高,同时hs-CRP表达水平与颈动脉粥样硬化斑块的形成及其稳定性程度间存在相关性。
急性脑梗死;超敏C-反应蛋白;颈动脉粥样硬化斑块;相关性
动脉粥样硬化是造成脑梗死等脑血管疾病的主要原因,其中尤以颈动脉粥样硬化危害性最为严重[1]。多项研究表明,斑块的位置、类型对于急性脑梗死的发生具有重要作用[2]。随着现代生活水平的提高,饮食习惯的改变,导致动脉粥样硬化的发生越来越严重,对其研究也逐渐增加。动脉粥样硬化不仅只是简单的脂肪累积结果,炎症因子的产生也是重要的因素之一,能够用于急性脑梗死等发生的预测[3]。本研究选取2010年6月—2012年3月住院治疗的急性脑梗死患者178例,通过检测超敏C-反应蛋白(hs-CRP)的表达水平,分析hs-CRP与颈动脉粥样硬化斑块发生的相关性。
1 资料与方法
1.1 临床资料 选取2010年6月—2012年3月住院治疗急性脑梗死患者178例,所有患者发病至入院治疗间隔时间<72 h,符合1995年全国脑血管病学术会议修订的急性脑梗死诊断标准[4],且经过头部CT或MRI确诊。男105例,女73例,年龄45岁~76岁(62.53岁±10.62岁)。选取同期于我院进行体检的健康人60名作为对照组,男37名,女23名;年龄46岁~78岁(62.76岁±10.54岁)。两组均无严重心、肝、肾功能障碍,恶性肿瘤、重大外科疾病等。两组年龄、性别等资料间差异无统计学意义(P>0.05),具有可比性。
对于急性脑梗死患者,采用ATL-HDI-5000型彩色多普勒超声仪,探头频率7.5 Hz,进行颈动脉彩超,检测颈动脉内-中膜厚度(IMT)。按照IMT厚度划分为颈动脉IMT正常组、颈动脉内膜增厚组、颈动脉斑块组。颈动脉IMT正常组42例,男25例,女17例,年龄(61.75±12.07)岁;颈动脉内膜增厚组44例,男26例,女18例,年龄(62.63±10.72)岁;颈动脉斑块组92例,男54例,女38例,年龄(62.46± 11.34)岁。对于出现颈动脉斑块的患者,采用彩色多普勒超声检测斑块形成的位置、形态、回声特点,并判断斑块所属的类型,根据斑块类型的不同分为稳定斑块组和不稳定斑块组。不稳定斑块组43例,男26例,女17例,年龄(62.27±12.65)岁;稳定斑块组49例,男28例,女21例,年龄(62.57±11.76)岁。按照IMT和斑块类型分类的各组患者年龄、性别等资料差异无统计学意义(P>0.05)。
1.2 观察指标 所有患者于入院后及时抽取适量肘前静脉血,分别检测血清hs-CRP的表达水平,检测采用罗氏全自动生化分析仪进行。
1.3 统计学处理 采用SPSS 17.0统计软件包进行,计量资料以均数±标准差(x±s)表示,组间对比行t检验,以P<0.05为差异具有统计学意义。
2 结 果
2.1 急性脑梗死患者与对照组血清中hs-CRP水平急性脑梗死组患者血清hs-CRP表达水平为(7.87± 3.94)mg/L,对照组为(3.12±1.34)mg/L,较对照组急性脑梗死组的hs- CRP表达水平显著升高(P< 0.01)。
2.2 颈动脉斑块形成与hs-CRP的关系 斑块形成组患者的hs-CRP表达水平最高,达到(12.40± 3.57)mg/L,与IMT正常组、内膜增厚组相比均显著升高(P<0.01);内膜增厚组与IMT正常组相比, hs-CRP水平也显著升高(P<0.01)。详见表1。
表1 IMT正常组、内膜增厚组、斑块形成组hs-CRP水平(±s)
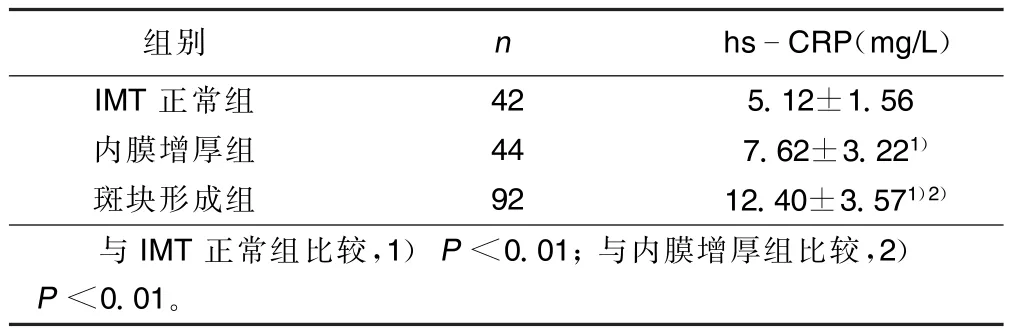
表1 IMT正常组、内膜增厚组、斑块形成组hs-CRP水平(±s)
组别n hsCRP(mg/L) IMT正常组425.12±1.56内膜增厚组447.62±3.221)斑块形成组9212.40±3.571)2)与IMT正常组比较,1)P<0.01;与内膜增厚组比较,2) P<0.01。
2.3 稳定斑块组和不稳定斑块组hs-CRP水平比较(见表3)
表2 稳定斑块组和不稳定斑块组hs-CRP水平±s)
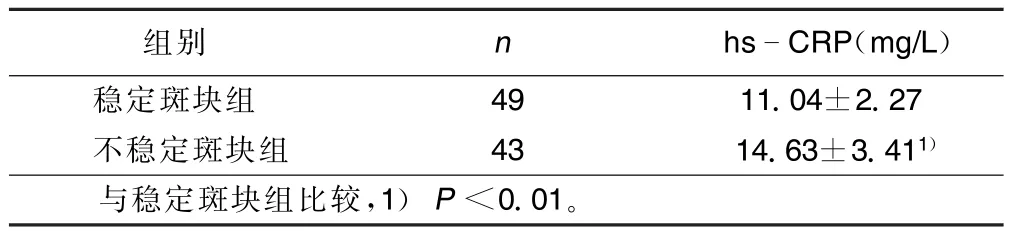
表2 稳定斑块组和不稳定斑块组hs-CRP水平±s)
组别n hsCRP(mg/L)稳定斑块组4911.04±2.27不稳定斑块组4314.63±3.411)与稳定斑块组比较,1)P<0.01。
3 讨 论
慢性炎症反应与动脉粥样硬化的发生有着密切的联系,其中对于hs-CRP与动脉粥样硬化的研究报道较多。张世阳等[5]对hs-CRP与代谢综合征(MS)及其颈动脉粥样硬化的关系研究发现,有颈动脉粥样斑块者显著高于颈动脉IMT增厚患者,且颈动脉IMT增厚患者显著高于颈动脉IMT正常组,表明血清hs-CRP参与了颈动脉粥样硬化的进程。杨淼[6]在对颈动脉粥样硬化与hs-CRP的关系研究发现,脑梗死患者的血清hs-CRP水平较对照组明显增加,且组内对比发现其与颈动脉IMT、斑块稳定程度成正比。闫海成等[7]在对血清hs-CRP与颈动脉粥样硬化的关系研究发现,86例颈动脉斑块患者的血清hs-CRP水平,与25例正常对照组相比显著升高,同时不稳定型斑块组的血清hs-CRP高于稳定型斑块组,表明血清hs-CRP水平的升高与颈动脉粥样硬化形成具有密切的联系,且血清中hs-CRP的异常升高与不稳定斑块形成具有相关性。
本研究结果显示,急性脑梗死组患者血清hs-CRP表达水平为(7.87±3.94)mg/L,组间对比发现,急性脑梗死组的hs-CRP表达水平显著升高;斑块形成组患者的hs-CRP表达水平最高,达到(12.40± 3.57)mg/L,与IMT正常组、内膜增厚组相比显著升高,且内膜增厚组患者的hs-CRP水平与IMT正常组相比也显著升高;不稳定斑块组的血清hs-CRP表达水平为(14.63±3.41)mg/L,与稳定斑块组患者相比显著升高。这些都表明血清hs-CRP水平与急性脑梗死以及其颈动脉粥样硬化斑块的发生具有相关性。hs-CRP水平的升高增加了颈动脉粥样硬化斑块的发生率,同时其表达水平的高低也体现着颈动脉粥样硬化斑块的危险程度,与国内的研究结果相一致[8,9]。
急性脑梗死患者血清hs-CRP的表达水平显著升高,同时hs-CRP表达水平与颈动脉粥样硬化斑块的形成及其稳定性程度间存在相关性。
[1] 温慧军,杨金锁,张建军.急性脑梗死患者颈动脉粥样硬化斑块与血液炎症因子水平的关系[J].临床神经病学杂志,2012(1): 54-56.
[2] 吴敏,辛小燕,杨健,等.急性期脑梗死与颈动脉粥样硬化斑块的关系[J].医学研究生学报,2009(8):830-832;900.
[3] 喻明,聂本刚.急性脑梗死患者颈动脉斑块稳定性与炎性机制研究[J].中国社区医师(医学专业),2012,25:33-34.
[4] 谢东玲.急性脑梗死患者颈动脉斑块与血清高敏C反应蛋白的关系[J].中国药物经济学,2013,5:142-143.
[5] 张世阳,谈敏,徐修才,等.高敏C反应蛋白与代谢综合征患者颈动脉粥样硬化的关系[J].中国临床保健杂志,2009(5):457-459.
[6] 杨淼.急性脑梗死患者颈动脉粥样硬化与血清高敏C反应蛋白水平的关系[J].中国实用神经疾病杂志,2009,20:3-4.
[7] 闫海成,王涛,武文元,等.Hs-CRP、Hcy及UA与颈动脉粥样硬化的相关性研究[J].临床神经外科杂志,2012(4):193-195.
[8] 杨丽萍,张晓炜,张国华,等.急性脑梗死患者血清YKL-40、hs-CRP水平与颈动脉粥样硬化斑块的相关性研究[J].中风与神经疾病杂志,2013(4):306-308.
[9] 王华.动脉粥样硬化性脑梗死患者血清YKL-40与hs-CRP相关性研究[J].心脑血管病防治,2013(3):205-207.
R743 R255
:Bdoi:10.3969/j.issn.1672-1349.2015.03.050
:1672-1349(2015)03-0396-02
2014-01-17)
(本文编辑王雅洁)
吉林省通化市中心医院(吉林通化134000),E-mail: ydyu024@163.com

