基于肺与大肠相表里研究电针对大承气汤在急性胰腺炎大鼠体内药动学的影响
薛桂君,黄 伟,李 娟,郭 徽,赵先林,唐文富,陈光远△
(1.四川大学华西医院,四川 成都610041;2.成都市第五人民医院,四川 成都611130)
急性胰腺炎(Acute pancreatitis,AP)是临床常见急腹症之一,系多种病因所引起的以胰腺组织自身消化为特点,并伴随组织水肿、出血甚至坏死的炎症反应。现代医学尚缺乏有效治疗手段,基于传统中医理论所衍生的“益活清下”中医药综合治疗方法[1-3],对重症急性胰腺炎(SAP)有显著的治疗效果,其中大承气汤作为“益活清下”治法的代表方剂,前期研究证实可减轻AP 患者胰腺自身及肺、肠等胰外器官的炎症反应[4-9]。基于传统中医针灸学及经络腧穴学理论,结合现代科学技术应运而生的电针,已经作为现代针灸学的重要方法之一普遍应用于临床和动物实验,尤以“止痛”效果突出[10],前期研究表明电针有助于AP 患者胃肠功能障碍的有效恢复[11-12],且可减轻AP 患者炎性损伤[13-14]。
笔者基于“肺与大肠相表里”,根据中医针灸“俞募配穴法”,通过俞穴和募穴的不同配伍来研究电针对大承气汤在SAP 大鼠体内药动学的影响,以探索针药合用相互影响的效应及机理,为阐明针药结合治法中针刺与药物的相互影响奠定药动学基础。
1 实验方法
1.1 实验动物模型制作
本实验采用Sprague- Dawley(SD)雄性大鼠12只,体重250 ~300 g,清洁级,均由四川大学实验动物中心提供,许可证号为SCXK(川)2009-09,于四川大学动物实验中心饲养。所有SD 大鼠分笼饲养,饲养环境统一:清洁级动物实验室,室温控制在22℃~26℃,相对湿度控制在60% ~80%,饲养室保持定时通风换气,所有大鼠均用标准大鼠颗粒饲料常规喂养。实验开始前将大鼠适应性饲养1 周。急性胰腺炎动物模型的制作方法较多,为确保实验大鼠SAP 模型存活率及成功率,笔者采用3.0%牛黄胆酸钠逆行胰胆管微量泵泵入造模,造模完毕后将大鼠轻置于铺垫有木屑的保温箱内,及时放回保温室,禁食,保证大鼠自由充足饮水。
1.2 主要试剂
牛黄胆酸钠(美国Sigma 公司,2℃~8℃低温保存);水合氯醛(成都市科龙化工试剂厂);乙酸铵(成都科龙化工);甲醇(色谱纯,TEDIA 公司);乙酸乙酯(色谱纯,成都科龙化工)以及冰醋酸(成都科龙化工)。标准对照品为:布洛芬化学对照品(由中美天津史克制药有限公司提供,批号 SKF50953,含量99.6%,w/w)。柚皮素、大黄素甲醚均购置于南京崇原生物科技有限公司;1,8-二羟基蒽醌、芦荟大黄素(110795-200504)、大黄酚(110796-20041)、大黄素(0756-200110)、厚朴酚(110729-200208)、大黄酸(0757-200206)、柚皮苷以及橙皮苷购置于中国药品检验检定所。
1.3 中药大承气汤配制
大承气汤方各成分用量古今、各家均有差异,为保证实验的准确性、方便性及可靠性,笔者选择大承气汤颗粒剂灌胃,按邓中甲所著《方剂学》组方:大黄12 g、厚朴24 g、枳实12 g、芒硝9 g。颗粒剂购于成都绿原药业有限公司,根据生药颗粒剂比率,大黄为5∶1;厚朴为10∶1;枳实为20∶3;芒硝为3∶1[15]。按邓中甲所著生药换算为颗粒剂剂量后分别为:大黄颗粒剂2.4 g、厚朴颗粒剂2.4 g、枳实颗粒剂1.8 g、芒硝颗粒剂3 g,共计9.6 g(相当于大承气汤生药总量57 g)。配置成生药浓度2 g/ml,按10 ml/kg 体重的剂量灌胃。
1.4 电针操作
实验选取双侧“肺俞”(大鼠背部,第3 胸椎棘突下旁开5 mm,左右各一穴)和“大肠俞”(大鼠腰部,第4 腰椎棘突下旁边5 mm,左右各一穴)。
大鼠的固定:实验采用大鼠俯卧位,用纱布条将老鼠固定于长方体木块上实施针刺操作,固定位置分别选择于大鼠背部前肢后方及后肢前端,松紧适宜,既保证大鼠呼吸通畅,又避免大鼠滑脱、挣扎。固定后,用75%医用酒精行双侧肺俞、大肠俞常规消毒,取环球牌无菌针灸针(苏州针灸用品有限公司)32 号0.25 mm×13 mm,向脊柱内斜刺肺俞穴,进针5 mm,大肠俞穴用1 寸毫针直刺5 mm,行轻微捻转。待毫针稍有紧滞感后,接用SDZ-II 型电针治疗仪(上海华谊医用仪器厂)行微电刺激。双侧“肺俞”、“大肠俞”各为一对电极,同时予以疏密波,刺激频率交替于2/100 Hz,刺激强度以大鼠背部肌肉轻微颤动、大鼠无嘶叫为度[16]。其中针刺组每次治疗20 min,每天两次,共2天。中药组不做特殊处理。实验过程始终保持大鼠禁食,自由饮水,针刺时间点和尾静脉取血时间点交替,造模48 h 时间点处死大鼠,处死前心脏取血备用。
1.5 标本采集与检测方法
针刺组造模后开始予以电针处理,每天两次,每次留针20 min,中药组造模后予以同时间量的捆绑处置。两组大鼠均在造模后24 h 时间点灌胃中药大承气汤,灌胃剂量为5 ml/kg,分别于灌胃后10 min、20 min、40 min以及1 h、2 h、3 h、4 h、8 h、12 h、24 h 尾静脉取血0.3 ~0.5 ml,注入肝素化的离心管内,以3000 rpm/min 速率离心10 min,取上清液放入冻存管内,-80℃保存备用。
实验采集血浆标本均送往四川大学华西医院临床药理研究中心,采用大鼠血浆中大承气汤各成分HPLC-MS-MS 测定方法测定中药组、针刺组大鼠灌胃大承气汤后各主要成分大黄素、大黄酸、大黄酚、大黄素甲醚、芦荟大黄素、橙皮苷、柚皮苷、柚皮素、厚朴酚的血浆浓度,再建成各成分的经时曲线[17]。
2 液质联用仪检测及药代动力学统计分析
2.1 仪器设备
岛津公司HPLC 仪(SIL-HTc 型);美国ABI 公司API3000 型三重四极杆串联质谱;Analysis1.4 工作站;ODS C18 色谱柱(150 ×4.6 mm,5 μm)。
2.2 LC-MS-M 分析方法
基于课题组前期研究工作中所建立的大承气汤LC-MS-MS 分析方法,检测本实验两组大鼠血浆中大承气汤各成分的血药浓度。其检测流动相为甲醇:5 mmol/L,乙酸铵(92 ∶8,v/v,10% 甲酸调节pH 约5.6);流速:0.4 ml/min;柱温:室温;内标选择:布洛芬(20 μg·L-1)。同时,本实验LC-MS-MS 检测方式为多反应离子监测(MRM),离子源为ESI 源,行负离子模式扫描。大黄酸为283.2 ~238.8(m/z),大黄素为269.0 ~241.2(m/z),大黄素甲醚为283.2 ~239.9(m/z),芦荟大黄素为269.0 ~239.9(m/z),柚皮苷为579.1 ~459.1(m/z),大黄酚为253.2 ~224.7(m/z),厚朴酚为265. 1 ~247. 0(m/z),橙皮苷为609. 4 ~301.2(m/z),柚皮素为271.2 ~150.9(m/z)。工作液Ⅰ、工作液Ⅱ和内标工作液均根据标准曲线工作液的建立方法配制。取10 份空白鼠血浆,每份0.2 ml,分别加入标准曲线系列工作液Ⅰ和标准曲线系列工作液Ⅱ各0.05 ml,得到标准曲线样品;然后用0.1 mol/L NaOH 溶液分别将工作液Ⅰ、工作液Ⅱ按一定比例稀释,再加入空白鼠血浆中,配制成高、中、低四个水平方法学验证及质控样品。根据相应各组分的标准曲线计算各组分的浓度、各组分的峰面积与内标峰面积之比。
2.3 药代动力学参数分析
实验所得药物-时间曲线,均由药代动力学软件DAS2.1 拟合药动学参数,计算出药物代谢的药物峰浓度(peak concentration,Cmax)、血药浓度达峰时间(time of maximum plasma concentration,Tmax)、分布相半衰期(distribution phase half-time,T1/2)以及血药浓度-时间曲线下面积(area under the plasma concentration-time curve,AUC)等。
2.4 统计学分析
使用PEMS3.1 统计学软件对大承气汤各主要药物成分进行统计学分析,计量资料均使用均数±标准差的形式。两组间比较采用方差分析,组间两两相比较采用成组t 检验:若方差齐则采用方差检验,若方差不齐则用秩和检验。P <0.05 认为有统计学差异。
3 实验结果
表1 为针刺组、中药组大鼠24 h 内血清大承气汤各成分药动学参数(n=6),封三彩图1 为大承气汤各成分血药浓度-时间曲线(红色为针刺组,蓝色为中药组,n=6)。
由封三彩图1(a)、表1 可以看出,两组大鼠在给药后24 h以内,针刺组大黄素峰药浓度高于中药组大黄素峰药浓度,且针刺组Tmax 达峰时间较中药组提前而半衰期T1/2 较中药组缩短,针刺组AUC(0 ~24 h)大于中药组AUC(0 ~24 h),但两者无统计学差异。结果亦可表明电针有促进大黄素在SAP 大鼠体内吸收的效果。
由封三彩图1(b)、表1 可以看出,两组大鼠在给药后24 h以内,针刺组大黄酸峰药浓度Cmax 低于中药组大黄酸峰药浓度Cmax,但针刺组Tmax 达峰时间比中药组提前而半衰期T1/2 比中药组缩短,但无统计学差异;针刺组AUC(0 ~24 h)小于中药组AUC(0 ~24 h),两者比较有统计学差异(P <0.05)。结果表明电针明显抑制大黄酸在SAP 大鼠体内的吸收。
由封三彩图1(c)、表1 可以看出,两组大鼠在给药后24 h以内,中药组芦荟大黄素峰药浓度Cmax 明显高于针刺组芦荟大黄素峰药浓度Cmax,两者比较有统计学差异(P <0.05);且中药组Tmax 比针刺提前且半衰期T1/2 比针刺组缩短,两者比较无统计学差异;针刺组AUC(0 ~24 h)明显小于中药组AUC(0 ~24 h),两者比较有统计学差异(P <0.05)。结果表明电针明显抑制芦荟大黄素在SAP 大鼠体内的吸收。
走过自由路,走过步行街,走过迎春路,走过丽水桥……汪小波抱着麦小秋,在D城的夜色里走着……后来,汪小波掬着麦小秋的头,说:“小秋,你看,一个新的太阳出来了。”麦小秋勉强地抬起头,看见一缕正漫过楼顶的金色的阳光。
由封三彩图1(d)、表1 可以看出,两组大鼠在给药后24 h以内,针刺组大黄酚峰浓度及AUC(0 ~24 h)大于中药组,而针刺组Tmax 比中药提前,半衰期T1/2比中药组延长,两者比较无统计学差异。但结果显示电针有促进大黄酚在SAP 大鼠体内吸收的趋势。
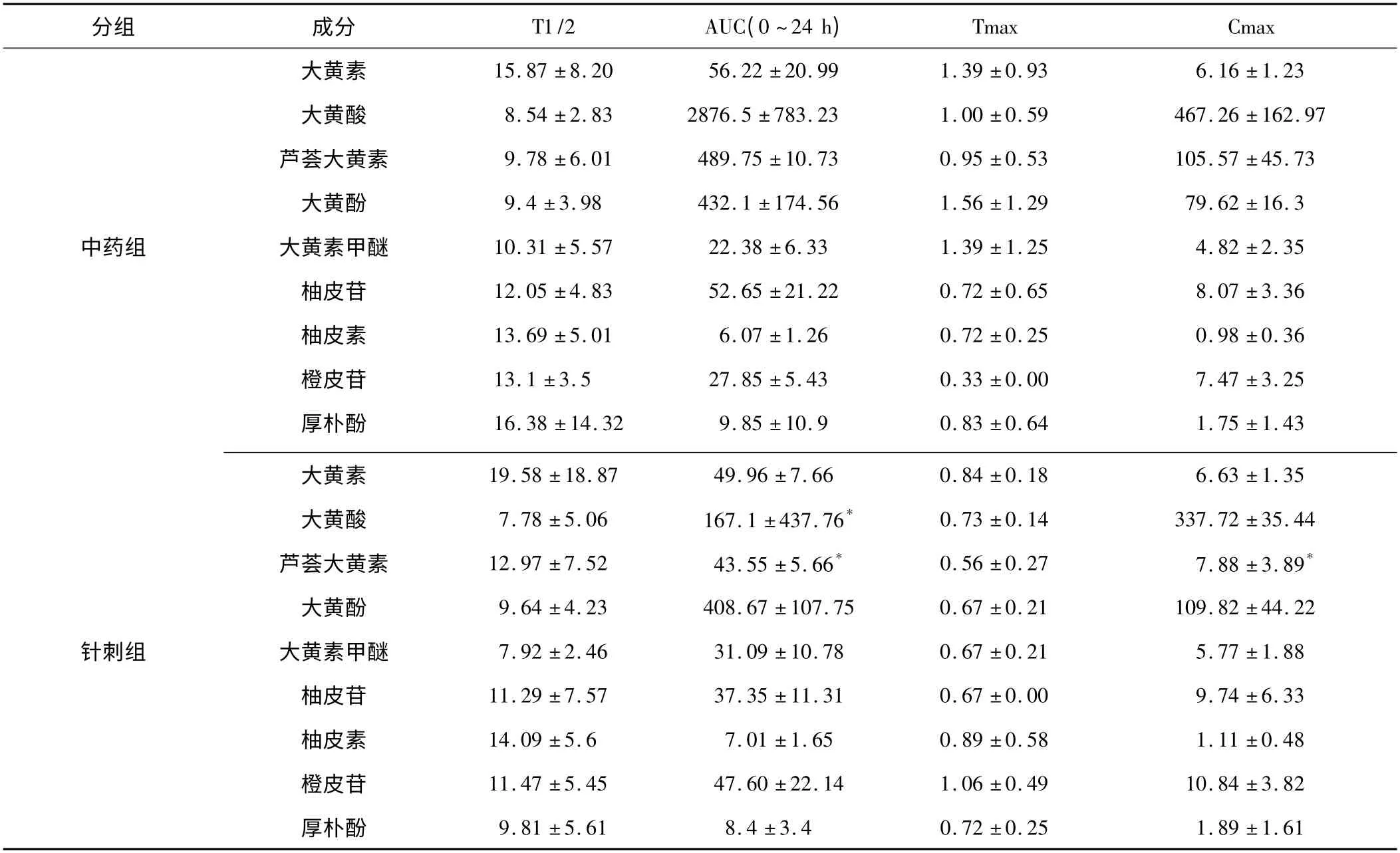
表1 针刺组、中药组大鼠24 h 内血清大承气汤各成分药动学参数(n=6)
由封三彩图1(e)、表1 可以看出,两组大鼠在给药后24 h以内,针刺组大黄素甲醚峰浓度及AUC(0 ~24 h)大于中药组,而针刺组Tmax 及T1/2 均比中药组延后,但两者比较无统计学差异。结果表明电针可促进大黄素甲醚在SAP 大鼠体内的吸收。
由封三彩图1(f)、表1 可以看出,两组大鼠在给药后24 h以内,针刺组柚皮苷峰浓度Cmax 略微大于中药组柚皮苷峰药浓度Cmax,而中药组AUC(0 ~24 h)大于针刺组AUC(0 ~24 h),针刺组半衰期T1/2 比中药组缩短而Tmax 比中药组延后,两者比较无统计学差异。结果亦可表明电针有促进柚皮苷在SAP 大鼠体内吸收的趋势。
由封三彩图1(h)、表1 可以看出,两组大鼠在给药后24 h 以内,针刺组柚皮素峰浓度Cmax 及AUC(0 ~24 h)略大于中药组柚皮素峰药浓度及AUC(0 ~24 h),针刺组半衰期T1/2 比中药组延长而Tmax 比中药组提前,但两组比较无统计学差异。结果表明电针可能会促进柚皮素在SAP 大鼠体内的吸收。
由封三彩图1(i)、表1 可以看出,两组大鼠在给药后24 h 以内,针刺组橙皮苷峰浓度Cmax 及AUC(0 ~24 h)均大于中药组橙皮苷峰药浓度Cmax 及AUC(0 ~24 h),而针刺组半衰期T1/2 较中药组缩短并且Tmax 比中药组提前,但两组比较无统计学差异。结果表明电针可能促进橙皮苷在SAP 大鼠体内的有效吸收,但会阻碍其较快吸收。
由封三彩图1(j)、表1 可以看出,两组大鼠在给药后24 h 以内,针刺组厚朴酚峰浓度Cmax 及AUC(0 ~24 h)均大于中药组,针刺组半衰期T1/2 比中药组缩短而Tmax 比中药组提前,但两组比较无统计学差异。结果表明电针有缩短厚朴酚在SAP 大鼠体内半衰期的趋势,但是对厚朴酚的吸收无太大影响。
4 讨论
本研究发现,针刺组芦荟大黄素Cmax 明显低于中药组芦荟大黄素Cmax,两组比较有统计学差异(P <0.05),中药组大黄酸及芦荟大黄素AUC(0 ~24 h)均大于针刺组,两组比较有统计学差异(P <0.05);而针刺组大黄素、大黄酸、芦荟大黄素、大黄酚、大黄素甲醚、柚皮苷和厚朴酚Tmax 均比中药组提前,同时针刺组大黄素、大黄酚、大黄素甲醚、柚皮苷、橙皮苷、柚皮素、厚朴酚Cmax 均大于中药组Cmax,针刺组大黄酸、大黄素甲醚、橙皮苷、柚皮苷半衰期T1/2均较中药组缩短,但两组间比较无统计学差异。由此可以看出,电针明显和大黄抑制芦荟大黄素酸的吸收,而对大黄素、大黄酚、大黄素甲醚、柚皮苷、橙皮苷、柚皮素、厚朴酚的吸收和代谢有促进的趋势,却并未起到明显促进作用,电针通过明显抑制大承气汤中大黄酸及芦荟大黄素两种成分的生物利用度,而影响大承气汤在机体内吸收、分布、代谢、和排泄等药动学过程。
本实验发现,电针可能抑制大承气汤成分在急性胰腺炎大鼠体内的药动学过程,其可能的机制和原因还不清楚。第一,部分原因可能是由于电针的刺激作用,会使大鼠产生相应的应激表现,且对大鼠精神心理产生一定影响,催生大鼠焦躁、恐惧等负面情绪。而现代研究发现精神因素和胃肠功能障碍息息相关[18-19],精神和心理的异常往往通过影响中枢神经/胃肠神经(CNS/ENS)轴来破坏小丘脑与边缘系统的平衡关系,兴奋交感神经,而迷走神经张力降低,环形肌收缩力也随之下降,进而胃收缩频率和传导速度减慢,胃动力明显受到抑制,而发生胃肠动力障碍[20];传统中医理论亦认为,怒为肝志,思为脾志,情志内伤,郁怒则肝伤,肝损则失疏泄之功,肝气横逆而致脾病,则脾失升清降浊之功,而中焦气滞食积、水谷不化,由此影响大承气汤的吸收、分布和代谢过程。同时,大承气汤各单体成分理化性质的不同且单体间在不同环境下可能产生不同的相互作用及大鼠生理、病理情况下胃肠道功能的不同,都可能影响电针针刺调节下中药各成分不同的吸收、分布、代谢过程。第二,在实验过程中,为避免大鼠在针刺过程中因过分挣扎松脱而对针刺组大鼠的捆绑操作过严,可能人为造成针刺组大鼠腹腔因捆绑过紧所致腹内压增高,肠壁血管可能因受压引起反射性血流灌注不足,以及胃肠道淤血、水肿,进而影响胃肠道平滑肌的功能,由此影响大承气汤吸收及代谢过程。第三,人与大鼠生理结构的差异以及SAP 疾病病理生理情况下胃肠功能的特殊性,都可能影响针药合用时针刺对药物吸收、分布和代谢,因此本研究结果与临床预期不完全吻合,疾病模型下针药合用的相互作用机制还需进一步探求。
不足之处:本研究是在肺与大肠相表里理论指导下,基于俞募配穴研究针药合用在SAP 中的效应及其机理,但由于时间关系,仅仅完成了肺与大肠两经腧穴对大承气汤药动学的影响,还难以全面从肺与大肠和俞募配穴出发阐释电针与大承气汤相互影响以改善胃肠动力、减轻肺损伤的药动学-药效学机理。目前相关研究还在进行中,以期最终能阐明SAP 针药结合的相互影响及其机理。
综上,电针能明显抑制大承气汤中芦荟大黄素和大黄酸的吸收,并表现出促进大黄素、大黄酚、柚皮素、柚皮苷、厚朴酚等成分的吸收和代谢的趋势。电针“肺俞”、“大肠俞”可以影响大承气汤在SAP 大鼠体内药动学过程。
[1] 夏庆,黄宗文,蒋俊明,等.以“益活清下”为主的中西医结合综合疗法治疗重症急性胰腺炎1161 例疗效报告[J].中国中西医结合急救杂志,2006,13(3):131-134
[2] 唐文富,吴秀丽,朱林,等. 益活清下法治疗重症急性胰腺炎并发高热的临床观察[J].成都中医药大学学报,2005,28(1):4-6
[3] 任燕怡,万美华,唐文富,等. 活血化瘀法治疗重症急性胰腺炎并发胰腺假性囊肿[J].华西医学,2009,24(3):632-634
[4] Jianlei Zhao,Jian Chen,Wenfu Tang,et al.Effect of Da-Cheng-Qi decoction on pancreatitis- associated lung injury in patients and anti-inflammatory responses in rat models[J].Pharmaceutical Biology,2011,49(10):1058-1064
[5] Wei Wu,Jia Guo,Xiaonan Yang,et al. Effect of Chaiqinchengqi decoction on serum amyloid A in severe acute pancreatitis patients[J].Asian Pacific Journal of Tropical Medicine,2012,5(11):901-905
[6] Meihua Wan,Juan Li,Hanlin Gong,et al.Clinical observation on the effect of dexamethasone and chinese herbal decoction for purgation in severe acute pancreatitis patients[J]. Chinese Journal of Integrative Medicine,2011,17(2):141-145
[7] Jia Wang,Guangyuan Chen,Hanlin Gong,et al. Amelioration of Experimental Acute Pancreatitis with Dachengqi Decoction via Regulation of Necrosis-Apoptosis Switch in the Pancreatic Acinar Cell[J].PLoS ONE,2012,7(7):1-7
[8] 薛育政,刘宗良,黄中伟,等.核转录因子-κB 在大鼠重症急性胰腺炎中的表达[J].中国危重病急救医学,2007,19(3):176-177
[9] 李永红,黄宗文,薛平,等. 柴芩承气汤对急性坏死性胰腺炎大鼠胰腺核因子-κB 活化的影响[J].中西医结合学报,2008,6(2):180-184
[10] JW Kerr Grieve,Shona Flucker,Jonathan O'Riordan. Acupuncture is an effective treatment for pain and other MS symptoms[J]. J Neurol Neurosurg Psychiatry,2013,84(11):76
[11] 李杰,石秀峰,周凌云,等. 电针对急性胰腺炎大鼠胃肠运动功能的影响[J].中国针灸,2008,28(5):365-368
[12] 罗艳红,钟广伟,赵双平,等. 应用电针干预重症早期急性胰腺炎并发肠麻痹[J].中国针灸,2011,31(2):105-109
[13] Hyo-Jin An,Ji-Hyun Lee,Hye-Jung Lee,et al. Electroacupuncture Protects against CCK-Induced Acute Pancreatitis in Rats[J].Neuroimmunomodulation,2007,14(2):112-118
[14] 薛奇明,黄露,李宁.电针天枢穴对重症急性胰腺炎大鼠血清促炎和抗炎因子的影响[J].中西医结合学报,2011,9(6):658-664
[15] 任燕怡,龚翰林,唐文富,等. 大承气汤诱导实验性急性胰腺炎大鼠胰腺细胞凋亡的研究[J].中西医结合学报,2009,7(7):651-656
[16] 王智君,李为民.电针对肠易激综合征大鼠肠道运动异常的调节作用[J].中西医结合学报,2010,8(9):883-887
[17] Yu Q,Xiang J,Tang W,et al. Simultaneous determination of the 10 major components of Da-Cheng-Qi decoction in dog plasma by liquid chromatography tandem mass spectrometry[J]. J Chromatogr B Analyt Technol Biomed Life Sci,2009,877(22):2025-2031
[18] 艾立新,雷达,黄业芳.功能性消化不良与精神因素的关系探讨[J].现代中西医结合杂志,2003,12(18):1951-1952
[19]EJ Bennett,C Piesse,K Palmer,et al.Functional gastrointestinal disorders:Psychological social,and somatic features[J]. Gut,1998,42(3):414-420
[20] Drossman DA. Gastrointestinal illness and the biopsychosocial model[J].J Clin Gastroenterol,1996,22(4):252-254

