化疗对晚期肺癌患者凝血、纤溶、血小板及肿瘤标志物变化研究
王健,廖珩,付伟
(河北省唐山市工人医院 肿瘤介入科,河北 唐山 063000)
化疗对晚期肺癌患者凝血、纤溶、血小板及肿瘤标志物变化研究
王健,廖珩,付伟
(河北省唐山市工人医院 肿瘤介入科,河北 唐山 063000)
目的 探讨化疗对晚期肺癌患者凝血、纤溶、血小板及肿瘤标志物影响及其意义。方法 选取2013年8月~2015年2月于肿瘤科已确诊为晚期肺癌的患者21例,同期选取20例在体检中心体检健康的正常人作为对照,实验组行化疗治疗,检测实验组患者化疗前后和对照组凝血纤溶系统各指标水平的变化,并分析其临床意义。结果 与实验组化疗前比较,化疗后患者凝血酶原时间(prothrombin time,PT)、部分凝血活酶时间(activated partial thromboplastin time,APTT)及凝血酶时间(thrombin time,TT)水平较低,血浆纤维蛋白原(fibrinogen,FIB)浓度水平较高(P<0.05);血浆蛋白(protein C,PC),游离蛋白S(free protein s,FPS)水平较低,D-二聚体(D-dimer,D-D),纤溶酶原激活剂抑制物-I(plasminogen activator inhibitor type-1,PAI-I)浓度水平较高(P<0.05);血小板计数(platelet count,PLT)、平均血小板体积(mean platelet volume,MPV)、血小板分布宽度(platelet distribution width,PDW)水平较低(P<0.05);癌胚抗原(carcinoembryonic antigen,CEA)、神经元特异性烯醇化酶(neuron-specific enolase,NSE)、细胞角蛋白(cytokeratin 19 fragment ,CYFRA21-1)、碳水化合物抗原125(carbohydrate antigen 125,CA125)水平较低(P<0.05)。结论 化疗对晚期肺癌患者凝血系统具有促进增强作用,对纤溶系统具有抑制作用,对肿瘤标志物具有降低作用。
晚期肺癌;凝血纤溶系统;化疗;血小板;肿瘤标志物
肺癌是近年来发病率和死亡率增长速度最快、对人群健康和生命威胁最大的恶性肿瘤之一。据相关流行病学统计发现,肺癌发病和死亡均居恶性肿瘤发病和死亡的第一位,分别占恶性肿瘤发病率和死亡率的25.91%和33.29%[1],女性发病率和死亡率占第二位。肺癌的发病原因目前仍未完全明确,但调查显示,吸烟者的发病率明显高于不吸烟者,发病频数与吸烟量及吸烟年限有显著关系。当吸烟危险指数≥400时[2],肺癌发生的危险度明显增加,且年龄越小的吸烟者,其患肺癌的几率越高。肺癌临床主要以手术治疗以及化疗方法为主,晚期肺癌患者现凝血、纤溶系统紊乱导致的静脉血栓栓塞症(VTE)是肺癌患者的主要并发症,发生率约为20%左右,并且是导致患者死亡的主要原因之一。大量临床数据证明[3-4],化疗是导致肺癌患者并发静脉血栓栓塞症的主要危险因素,但化疗又是治疗晚期肺癌的主要方法,由此可见明确2者之间的关系对晚期肺癌的治疗具有重要意义。因此,本研究通过对晚期肺癌患者凝血纤溶系统相关指标进行分析研究,以探讨晚期肺癌患者凝血纤溶系统的变化以及化疗对其的影响,为晚期肺癌患者的诊断和治疗提供新的思路和方法。
1 资料与方法
1.1 一般资料 病例来源选择2013年8月~2015年2月于河北省唐山工人医院肿瘤科以肺癌晚期为诊断而收入院的患者21例作为实验组,同期选取20例在我院体检中心体检健康的正常人作为对照组,2组研究对象的年龄均在20~75岁。其中实验组男性12例,女性9例,平均年龄(51.23±7.44)岁;病理分型:小细胞肺癌患者7例,非小细胞肺癌患者6例,其中腺癌4例、鳞癌4例;临床分期(按TNM分期标准):ⅢA期7例,ⅢB期10例,Ⅳ期4例;所有晚期肺癌患者其临床及影像学诊断均符合诊断标准,均已丧失手术治疗机会。对照组男性10例,女性10例,平均年龄(49.72±7.25)岁。患者签署知情同意书,并由我院伦理协会跟踪随访。
诊断及排除标准:参照2011年中华医学会第五届全国胸部肿瘤及内窥镜学术会议论《NCCN及ASCO非小细胞肺癌指南解读》[5]中关于晚期肺癌的诊断标准而拟定以下纳入标准:①初次入院并诊断为肺癌者;②年龄在45~70岁之间者;③为肺癌晚期失去手术机会并自愿同意接受化疗者;④实验前1个月内未用过任何相关抗凝或促凝药物者;⑤患者或其家属同意并自愿参与本实验。排除标准:①不愿参与本研究或不符合诊断标准者;②同时患有慢性阻塞性肺疾病等影响凝血、纤溶系统指标者;③近3个月内有手术史者;④同时患有其他系统肿瘤者;⑤患有艾滋病等具有较重传染性疾病患者;⑥合并有严重心、肾功能不全疾病患者;⑦患有精神类疾病不能配合研究者。
1.2 研究方法 所有晚期肺癌患者严格按照《ASCO不可手术切除的非小细胞肺癌治疗指南——2003新版推荐指南》[6]中关于晚期肝癌的治疗标准予以治疗:进行NP方案化疗,顺铂注射液(锦州九泰药业有限责任公司,批准文号:国药准字H20033936)70 mg/(m2.d),分3次使用;长春瑞滨注射液(江苏豪森药业股份有限公司,批准文号:国药准字H20031377)25 mg/(m2.d),与第1、8天使用。在治疗过程中,如并发其他临床症状,均予相应的对症处理。以4周为1个周期进行治疗,共化疗2个周期。
1.3 观察指标及检测方法 比较对照组和实验组化疗前后血清中凝血系统、纤溶系统、血小板及肺癌肿瘤标志物浓度水平变化比较研究。
血清采集:实验组患者化疗前、化疗后及对照组均空腹采集5mL肘静脉血,3.8%枸橼酸钠抗凝,于室温下用水平离心机以3000 r/min离心20 min,待离心结束后将上层血清装入EP管中,放入-80 ℃冰箱中保存备用。所有健康对照者均同期空腹采集5 mL肘静脉血做一次同样处理。
凝血系统指标检测:本研究采用本院检验科全自动血凝仪检测所有研究对象凝血酶原时间(prothrombin time,PT)、部分凝血活酶时间(activated partial thromboplastin time,APTT)及凝血酶时间(thrombin time,TT)及血浆纤维蛋白原(fibrinogen,FIB)浓度水平。
纤溶系统指标检测:本研究采用双抗体夹心酶联免疫吸附(ELISA)法检测;所有研究对象血清中D-二聚体(D-dimer,D-D)、血浆蛋白(protein C,PC)、纤溶酶原激活剂抑制物-I(plasminogen activator inhibitor type-1,PAI-I)、游离蛋白S(free protein s,FPS)浓度水平(试剂盒均由郑州安塞生物科技有限公司提供,其操作方法按照说明书严格操作)。
血小板参数测定:本研究采用本院检验科全自动血液分析仪(OLYMPUSAU5400)检测所有研究对象血清中血小板计数(platelet count,PLT)、血小板压积( platelet hematocrit,PCT)、平均血小板体积(mean platelet volume,MPV)、血小板分布宽度(platelet distribution width,PDW)水平。
肿瘤标志物指标检测:本研究采用双抗体夹心酶联免疫吸附(ELISA)法检测所有研究对象血清中癌胚抗原(carcinoembryonic antigen,CEA)、神经元特异性烯醇化酶(neuron-specific enolase,NSE)、细胞角蛋白(cytokeratin 19 fragment ,CYFRA21-1)、碳水化合物抗原125(carbohydrate antigen 125,CA125)等肿瘤标志物指标的浓度水平(试剂盒由郑州安塞生物科技有限公司提供,其操作方法按照说明书严格操作)。
以上所有操作均由本院检验科专业人员负责操作。
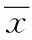
2 结果
2.1 实验组化疗前后及对照组凝血系统指标水平比较 本研究显示,晚期肺癌患者入院时 PT、APTT、TT水平低于正常对照组,血清FIB浓度水平高于正常对照组(P<0.05);经过化疗后,实验组患者PT、APTT、TT水平低于化疗前,血清FIB浓度水平高于化疗前(P<0.05)。见表1。
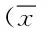
表1 实验组化疗前后及对照组凝血系统指标水平比较±s)Tab.1 Comparison of coagulation system index of two ±s)
#P<0.05,与对照组比较,compared with control group;*P<0.05,与治疗前比较,compared with before treatment
2.2 实验组化疗前后及对照组纤溶系统指标水平比较 本研究显示,晚期肺癌患者入院时血清 PC、FPS水平低于正常对照组,血清D-D、PAI-I浓度水平高于正常对照组(P<0.05);经过化疗后,实验组患者 PC、FPS水平低于化疗前,血清D-D、PAI-I浓度水平高于化疗前(P<0.05)。见表 2。
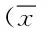
表2 实验组化疗前后及对照组纤溶系统指标水平比较±s)Tab.2 Comparison of fibrinolytic system index of two ±s)
#P<0.05,与对照组比较,compared with control group;*P<0.05,与治疗前比较,compared with before treatment
2.3 实验组化疗前后及对照组血清血小板参数水平比较 本研究显示,晚期肺癌患者入院时血清 PLT、PCT、PDW水平均高于正常对照组(P<0.05);经过化疗后,实验组患者血清 PLT、MPV、PDW水平均低于化疗前和对照组。差异均有统计学意义(P<0.05)。见表3。
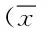
表3 实验组化疗前后及对照组血清血小板参数水平比较±s)Tab.3 Comparison of serum platelet parameters of two ±s)
#P<0.05,与对照组比较,compared with control group;*P<0.05,与治疗前比较,compared with before treatment
2.4 实验组化疗前后及对照组血清肺癌肿瘤标志物水平比较 本研究显示,晚期肺癌患者入院时血清 CEA、NSE、CYFRA21-1、CA125水平均高于正常对照组(P<0.05);经过化疗后,实验组患者血清 CEA、NSE、CYFRA21-1、CA125水平均较化疗前有所降低。差异均有统计学意义(P<0.05)。见表4。
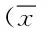
表4 实验组化疗前后及对照组血清肺癌肿瘤标志物水平比较±s)Tab.4 Comparison of tumor markers of lung cancer of two ±s)
#P<0.05,与对照组比较,compared with control group;*P<0.05,与治疗前比较,compared with before treatment
3 讨论
肺癌是我国较为常见的恶性肿瘤之一,其高发病率、高死亡率的特点严重危害我国人民的健康和生命,足以引起人们的重视。化疗是晚期肺癌的主要治疗方法,90%以上的晚期肺癌需要接受化疗治疗,能有效延长患者生存和改善生活质量。但是,化疗除能杀死肿瘤细胞外,对人体正常细胞也有损害,现已证实[7],抗癌药物对骨髓具有较强的抑制作用,使粒细胞及血小板降低,从而影响了药物剂量强度的提高和化疗计划的完成。肿瘤患者血液呈高凝状态,易形成血栓,且肿瘤细胞膜可产生凝血酶,引起血小板粘附与聚集而发生静脉血栓。文献证明,晚期肺癌患者PT、APTT、TT时间明显延长[8],可见晚期肺癌患者存在着凝血功能失常,其患DVT的风险较正常人高出4.5倍左右,接受化疗的晚期肺癌患者其患VTE的几率更高。
本研究结果发现,化疗对晚期肺癌患者凝血系统具有明显促进其增强作用。表1表明,实验组患者在化疗前,其凝血系统PT、APTT、TT时间均低于正常对照组,FIB高于正常对照组,说明晚期肺癌患者已经出现高凝状态,这一结果与其他学者得出的晚期癌症患者凝血功能紊乱的结果达到一致性。实验组患者化疗结束后,其PT、APTT、TT时间较化疗前又有降低,差异有统计学意义,可见化疗对晚期肺癌患者凝血系统具有明显促进其增强的作用,其原因可能与化疗过程中血管内皮的损伤进一步加剧了机体凝血因子的释放有关。
目前,大量研究表明[9-11],癌症晚期的化疗会导致患者纤溶系统受抑制,本研究中也证明了此结果的正确性。从表2中可知,实验组在治疗前其血清 PC、FPS水平低于正常对照组而血清D-D、PAI-I浓度水平高于正常对照组,可见在化疗前晚期肺癌患者即已出现纤溶系统异常。D-D具有特异性反应机体纤溶亢进的意义,当其水平升高时说明机体已经发生纤维蛋白溶解亢进,机体处于高凝状态;PC具有灭活凝血因子的作用,PC水平的降低说明机体抗凝机制受到抑制。经过化疗后,实验组患者 PC、FPS水平低于化疗前,血清D-D、PAI-I浓度水平高于化疗前,说明患者纤溶系统受抑制状态进一步加重。有临床实验证明,对于癌症患者在抗癌治疗的同时予以适当的抗凝治疗能有效延长患者生存期,可见对于癌症患者调整凝血、纤溶系统的平衡具有重要意义。
本研究发现,化疗会导致晚期肺癌患者血小板含量的降低。在高凝状态下血小板的聚集会促进血管内皮生长因子的分泌,从而增加肿瘤组织局部血管密度,促进肿瘤转移。表3表明,化疗前患者血清PLT、MPV、PDW均高于正常参照组,其原因可能与癌症患者骨髓巨核细胞反应性增加、产生较多的血小板有关。化疗后患者血清PLT、MPV、PDW均较化疗前有所降低,其原因可能是提示晚期肺癌患者化疗药物直接入血,导致血小板被大量破坏以及骨髓造血功能受到抑制有关。
本研究发现,化疗对晚期肺癌患者血清肺癌肿瘤标记物具有明显降低作用,说明化疗对晚期肺癌的治疗具有一定的积极意义。CEA是一种细胞表面酸性糖蛋白,对肺癌尤其是腺癌的辅助诊断具有一定意义。NSE起源于神经内分泌细胞的肿瘤组织的异常表达,而小细胞肺癌是具有神经分泌性质的肿瘤,因此NSE是小细胞性肺癌的最敏感、最特异的肿瘤标记物。CYFRA21-1是近年来才被推广的新型肺癌标记物,存在于单层和复层上皮肿瘤细胞的胞浆内,当细胞死亡时溶解的片段释放到血清中,使血清中CYFRA21-1含量升高。现已发现CA125在非小细胞肺癌患者中显著升高,可作为独立的预后指标,对预测肺癌患者预后具有重要意义[12]。在本研究中,表4表明,化疗后实验组患者肿瘤标志物水平均较治疗前有所降低,向正常水平靠近,说明化疗后晚期肺癌患者病情得到一定程度的缓解。
本研究通过对晚期肺癌患者的凝血、纤溶系统、血小板参数以及肿瘤标志物等指标水平动态变化进行分析,证实了化疗能够增强晚期肺癌患者凝血系统、抑制纤溶系统。因此,对于晚期肺癌患者在化疗时及时地检测其凝血、纤溶系统指标对VTE的预防具有重要意义。在未来的研究中,本研究将对化疗对患者的凝血、纤溶系统的影响实质进行更深入的研究,为本实验所得出的结果做出进一步的论证和分析。
[1] 刘巍,吴树岭,孙喜文,等.哈尔滨市南岗区居民肺癌发病死亡10年动态分析[J].中国肿瘤,2003,12(7):384-386.
[2] 樊圣,贾丽莎,张丽.吸烟与肺癌发生的回顾性分析[C]// 第四届中国肿瘤学术大会暨第五届海峡两岸肿瘤学术会议论文集.2006.
[3] 罗勤利,李琴.导致肺癌化疗患者发生静脉血栓栓塞症的相关因素及其治疗[J].实用癌症杂志,2015,30(2):314-316.
[4] 陈泉芳,王威,邹小英,等.肺癌化疗患者合并静脉血栓栓塞症的危险因素及治疗分析[J].实用医学杂志,2014,30(6):891-894.
[5] 宋勇.NCCN及ASCO非小细胞肺癌指南解读[C]// 中华医学会第五届全国胸部肿瘤及内窥镜学术会议论文汇编.2011.
[6] 施春雷,韩宝惠.ASCO不可手术切除的非小细胞肺癌治疗指南--2003新版推荐指南[J].循证医学,2004,4(2):115-124.
[7] 张廷梅,夏云丽,查小芳,等.惠若舒对联合化疗中白细胞,血小板减少的治疗作用[J].贵州医药,2000,24(2):101-102.
[8] 田玉玲,雷力民,徐文丽.晚期恶性肿瘤患者凝血指标测定的临床意义[J].检验医学与临床,2010,7(15):1598-1599.
[9] 薛英波,倪婷婷,俞婕,等.化疗对晚期肺癌患者凝血、纤溶系统影响的临床研究[J].实用临床医药杂志,2012,16(19):46-48.
[10] 李鸿波,许启霞.晚期肺癌患者凝血-纤溶系统的变化及化疗对其的影响[J].肿瘤防治研究,2014,41(7):766-770.
[11] 李鸿波.晚期肺癌患者凝血纤溶系统的变化及化疗对其影响[D].蚌埠:蚌埠医学院,2012.
[12] 万锦平,黄建安,刘皓,等.血清SCC-Ag、CYFRA21-1、NSE、CEA联合检测对肺癌的诊断价值[J].临床肺科杂志,2007,12(2):111-112..
(编校:王冬梅)
Study on changes of coagulation, fibrinolysis, platelet and tumor markers in patients with advanced lung cancer by chemotherapy
WANG Jian, LIAO Heng, FU Wei
(Department of Interventional Radiology Tumor, Tangshan Workers Hospital of Hebei Province,Tangshan 063000, China)
ObjectiveTo investigate effect of coagulation, fibrinolysis, platelet and tumor markers in patients with advanced lung cancer by chemotherapy.Methods21 cases of advanced lung cancer patients were selected to be the experiment group, and 20 healthy people were selected to be the control group.The experiment group were treated by chemotherapy,coagulation, fibrinolysis, platelet and tumor markers were compared before and after the treatment.ResultsCompared with experiment group before chemotherapy, PT, APTT, TT levels of the patients after chemotherapy were lower, serum FIB concentrations were higher (P<0.05); PC and FPS were lower , D-D, PAI-1 concentration level were higher (P<0.05); PLT, MPV, PDW levels were lower (P<0.05); CEA, CYFRA21-1, NSE, CA125 levels were lower (P<0.05).ConclusionChemotherapy can enhance the effect of coagulation system in patients with advanced lung cancer, inhibit the fibrinolytic system and reduce the level of tumor markers.
advanced lung cancer; coagulation and fibrinolysis system; chemotherapy; platelet; tumor markers
王健,女,本科,研究方向:肿瘤化疗,护理,E-mail:wj13739873029@163.com。
R734.2
A
1005-1678(2015)07-0116-04

