根皮素对肝癌细胞HepG-2增殖和凋亡的影响
王会,刘政,吴汉东
(辽宁医学院 食品科学与工程学院,辽宁 锦州 121001)
根皮素对肝癌细胞HepG-2增殖和凋亡的影响
王会,刘政,吴汉东
(辽宁医学院 食品科学与工程学院,辽宁 锦州 121001)
目的 以人肝癌细胞HepG-2为研究对象,研究根皮素对肝癌细胞增殖和凋亡的影响。方法 应用相差显微镜、电子显微镜检测凋亡细胞形态学变化,通过细胞毒性试验检测细胞增殖情况,应用流式细胞仪检测细胞凋亡率、细胞周期、线粒体膜电位、钙离子稳态的变化。结果 细胞呈典型的凋亡形态学变化,根皮素对HepG-2细胞有抑制增殖作用和诱导凋亡作用且呈浓度和时间依赖性,细胞周期阻滞于G1期,细胞线粒体膜电位降低,细胞内钙离子浓度增大。结论 根皮素通过影响细胞周期,降低线粒体膜电位,改变细胞内钙离子平衡来诱导肝癌细胞HepG-2凋亡。
根皮素;肝癌细胞;细胞凋亡;增殖
肝癌是发生在肝细胞或胆管细胞的世界第五大恶性肿瘤,具有诊断难,治愈难,发展快和预后差等特点。肝癌与其他恶性肿瘤相比具有较强的耐药性,因此寻找高效、低毒、靶点明确的抗肝癌药物迫在眉睫。
根皮素是一种存在于苹果、梨等水果和多种蔬菜根茎或根皮中的类黄酮物质,它具有抗菌、抗氧化、抗糖尿病、抗肿瘤及雌激素样作用等活性。根皮素能激活蜂窝蛋白激酶,对细胞无序增殖有抑制作用,可用于皮肤癌及其他肿瘤的治疗[1-2]。根皮素对体外生长的人急性淋巴母细胞白血病细胞Molt-4 和体内膀胧癌细胞Fisher具有抑制增殖作用。根皮素主要通过抑制糖的跨膜运输,阻碍能源的供应来诱导 B16 小鼠肿瘤 4A5 细胞凋亡[3],根皮素还可以嵌入到B16 肿瘤细胞DNA分子中干扰 DNA 的复制,影响蛋白激酶C (protein kinase C, PKC) PKC 的活性,从而促进细胞凋亡[4]。Park[5]等研究发现根皮素可诱导肠癌细胞凋亡7。但目前关于根皮素诱导肝癌细胞凋亡及其相关机理的详细研究还非常少。本实验以人肝癌细胞 HepG-2 为研究对象,探讨了根皮素对其增殖和凋亡的影响。
1 材料与方法
1.1 材料 人肝癌HepG-2细胞株,由协和医科大学提供;根皮素(纯度, 99.99%;批号,P7912-100MG)、二甲基亚砜(DMSO)、甲基噻唑蓝(MTT)、碘化丙啶(PI)、均购于Sigma公司;DMEM培养基和胎牛血清购于GIBCO公司;Annexin V-FITC Apoptosis Detection试剂盒购于BD公司。细胞凋亡-Hoechst染色试剂盒购于碧云天公司。
流式细胞仪(BECKMAN FC500);激光共聚焦显微镜(Nikon TE2000-E);倒置相差显微镜(Olympus IX-71)。酶标仪(THERMO FISHER),透射电子显微(JEM-123O)
1.2 细胞培养 用含10% 标准胎牛血清的DMEM培养基,于37 ℃、5% CO2及饱和湿度的培养箱中培养细胞,当培养液颜色变黄时更换培养液,当细胞达到70%~80% 融合度时细胞传代。
1.3 方法
1.3.1 药物配制及细胞处理 根皮素用DMSO溶解,再用基础培养基稀释成浓度为8 mg/mL的母液,分装,置-20 ℃ 冰箱避光保存备用。在实验中DMSO的终浓度为0.05%。取对数生长期细胞,换用含有40、80和160 mg/L根皮素的培养液培养至12、24、36、48 h。分别记为低、中、高浓度处理组。设对照组(用DMSO处理,终浓度为0.05%)。
1.3.2 细胞形态学观察 细胞悬液接种于六孔板,浓度为4.0×105个/孔,待细胞贴壁融合进入对数生长期,用低、中、高浓度处理组根皮素处理,用培养液培养至24 h,并设对照组(用DMSO处理,终浓度为0.05%)。应用倒置相差显微镜观察并拍照。
1.3.3 Hoechst 33258染色观察凋亡细胞核 将盖玻片置于培养皿内,种入细胞。待细胞进入对数用低、中、高浓度处理组处理,设置对照组(用DMSO处理,终浓度为0.05%)。固定细胞,加入Hoechst 33258染色液,去染色液,滴抗荧光淬灭封片液于载玻片上,盖盖玻片,在激光共聚焦显微镜下观察并拍照。
1.3.4 细胞毒性分析 将180 μL细胞悬液接种于96孔培养板。待细胞进入对数生长期,低、中、高浓度处理组处理,设置对照组,每组设 8个重复。培养到设定时间,然后每孔加入 MTT 20 μL(5 mg/mL, PBS溶解),4 h 后终止孵育,离心去上清,每孔加入 200 μL DMSO,混匀,于酶标仪在 490 nm 波长处检测吸光度 OD值。试验重复3次。
1.3.5 透射电镜观察凋亡细胞亚显微结构 常规方法收集细胞,用2.4% 戊二醛固定,0.15 M 磷酸缓冲液漂冲,1.2% 锇酸固定,0.12M 磷酸缓冲液漂洗,用20%、30%、60%、70%、80% 和100% 梯度的丙酮系列脱水。用环氧树脂SPURR包埋聚合,切片,醋酸双氧铀和柠檬酸铅复染。透射电子显微镜观察,拍摄。
1.3.6 Annexin V-FITC/PI双染检测细胞凋亡率 常规方法收集细胞,调整细胞浓度为5.0×105细胞/样品,样品加入100 μL缓冲液和5 μL AnnexinV-FITC及5 μL PI,摇匀。避光孵育10~15 min,流式细胞仪检测。
1.3.7 细胞周期检测 收集对照组和处理组细胞,调整细胞浓度为(1~5)×105个/样品,于4 ℃,70% 无水乙醇中孵育12 h。离心去乙醇,PBS漂洗,加入0.5 mLPI染液,4 ℃ 避光孵育20 min。流式细胞仪上机检测。
1.3.8 线粒体膜电位检测 收集对照组和处理组细胞,1.0×106个/样品,加入0.5 mL JC-1染色液,在CO2培养箱避光孵育15 min,用预热的PBS洗涤,于 0.5 mL PBS悬浮,流式细胞仪上机检测。
1.3.9 细胞内钙离子浓度的测定 收集对照组和处理组细胞,调整细胞浓度至(1~2)×106个/mL。加入Fluo-3/Am至终浓度为6~10 μM,细胞于5% CO2,37 ℃,避光孵育20~40 min,期间轻轻振荡几次,设置阴性对照(不加Fluo-3/Am)。用无钙离子PBS离心洗涤2次,然后 PBS重悬至0.5 mL,流式细胞仪上机检测。
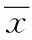
2 结果
2.1 细胞形态学观察 对照组细胞排列紧密,融合成片,胞浆饱满,呈椭圆形,边缘清晰,细胞折光度好,增殖旺盛。经根皮素处理24 h后,低浓度处理组细胞萎缩,出现空泡;中浓度处理组细胞增殖速度显著减慢,细胞形态逐渐变的模糊不清,凋亡细胞与邻近细胞脱离;高浓度处理组细胞间连接几乎消失,细胞裂解成小的碎片,细胞膜皱缩,胞体缩小,细胞膜表面凹凸不平,细胞形态发生重大变化,出现细胞坏死(见图1)。
2.2 Hoechst33258染色观察凋亡细胞核 对照组细胞核呈卵圆形或圆形,染色质均匀分布于细胞核,着色均匀。处理组细胞染色质凝聚呈分散点状,着色不均匀。随根皮素浓度的增加点状着色现象明显(见图2)。

图2 Hoechst33258 染色,根皮素处理HepG-2细胞24 h (×100)Fig.2 Hoechst33258 staining, HepG-2 cells after 24 h treatment by phloretin (×100)
2.3 细胞毒性分析 细胞毒性结果见表1,OD490值反映的是活细胞数量。在根皮素处理HepG-2细胞12、24、36、48 h后,随着根皮素浓度的增大其OD490值随之减小,间接反映活细胞数量减小,呈良好的量效和时效关系。

表1 根皮素对HepG-2细胞生长的影响Tab.1 The inhibition effect of phloretin on HepG-2 cell ±s, n=8)
*P<0.05,**P<0.01,与对照组比较, compared with control group
2.4 透射电镜观察凋亡细胞亚显微结构 对照组细胞胞质均匀,核膜结构完好,呈双层膜结构。核仁清晰可见,染色质分布均匀。高浓度处理组细胞,双层核膜膜结构遭到损伤、裂解,染色质浓缩、聚集(见图4)。

图4 电子显微镜观察根皮素处理HepG-2细胞24 h亚细胞结构(×100)Fig.4 Subcellular observation of HepG-2 cells after 24h treatment by phloretin using transmission electron microscopy(×100)
2.5 细胞凋亡率的测定 Annexin V-FITC/PI双标记法能够定量分析细胞凋亡,并可定量分析早期凋亡细胞、晚期凋亡细胞、活细胞和坏死细胞。实验结果如图5(12、36、48 h凋亡率),表2结果表明,随着根皮素处理时间的延长和浓度的增加,诱导凋亡效果越显著,呈现浓度依赖性和时间依赖性。

图5 根皮素作用HepG-2细胞凋亡率Fig.5 The apoptosis rate of HepG-2 after treatment by phloretin.

组别 12h24h36h48h对照组 4.20±0.996.22±1.397.99±1.629.49±1.78低浓度处理组6.33±1.49*9.72±1.49**19.95±1.68**25.95±1.51**中浓度处理组7.51±1.53**22.56±2.49**33.20±2.58**32.56±3.95**高浓度处理组12.62±1.76**28.42±3.58**36.21±3.70**43.02±3.72**
*P<0.05,**P<0.01,与对照组比较, compared with control group
2.6 细胞周期的检测 采用PI标记结合流式细胞术检测细胞周期的变化,结果如图6。随着根皮素浓度的增大,G1期细胞数百分比增大,S期细胞百分比下降,G2期细胞百分比下降,表明细胞经根皮素处理后增殖停滞在 G1期,DNA合成受到抑制,这种关系随着根皮素剂量的增大而愈加明显,呈现剂量依赖性。

图6 根皮素处理HepG-2细胞24 h细胞周期Fig.6 The cell cycle of HepG-2 cells after 24h treatment by phloretin

组别 细胞周期G1(%)S(%)G2(%)对照组 51.99±6.7537.78±2.8710.1±2.56低浓度处理组65.89±6.91**26.74±2.57**7.89±1.47中浓度处理组72.67±8.86**17.55±2.78**8.07±1.99高浓度处理组78.39±9.07**13.18±3.79**5.67±1.78**
*P<0.05,**P<0.01,与对照组比较, compared with control group
2.7 细胞线粒体膜电位的检测 本实验采用JC-1标记流式细胞仪检测线粒体膜电位变化,发现经根皮素作用后的HepG-2细胞的线粒体膜电位下降,对照组为(10.05±1.03)mV,在浓度处理组为(5.30±0.72)mV,中浓度处理组为(3.77±8.92)mV,高浓度处理组为(2.04±0.78)mV,各实验组分别与对照组比较差异极显著(P<0.01,见图7)。

图7 根皮素作用HepG-2细胞24 h,线粒体膜电位变化情况,**P<0.01,与对照组相比Fig.7 The mitochondrial membrane potential of HepG-2 cells after 24 h treatment by phloretin,**P<0.01, compared with control group
2.8 细胞内钙离子浓度的测定 图 8反映了根皮素素作用HepG-2细胞24 h后Ca2+的浓度。对照组为(2.11±0.72)mmol/L,低浓度处理组为(3.79±0.75)mmol/L,中浓度处理组为(11.36±0.67)mmol/L,高浓度处理组为(20.98±0.76)mmol/L。随根皮素浓度增大 Ca2+浓度呈现增大现象,处理组 Ca2+浓度较对照有明显增多(P<0.01)。可见 Ca2+的浓度与根皮素浓度成正比。

图8 根皮素作用HepG-2细胞24 h Ca2+浓度变化,**P<0.01,与对照组相比Fig.8 The concentrations of intracellular calcium of HepG-2 cells after 24 h treatment by phloretin**P<0.01, compared with control group
3 讨论
肿瘤的发生和发展是一个基因调控的复杂过程,是细胞增殖失控和凋亡受阻的最终结果。随着人们对凋亡机理的研究,人们认识到促进肿瘤细胞凋亡是治疗肿瘤的有效途径之一。
根皮素是一种类黄酮类物质, 是一种具有临床应用潜能的治疗肿瘤的天然化合物, 根皮素可抑制肿瘤细胞增殖, 诱导肿瘤细胞凋亡[6]。根皮素可通过干扰Ⅱ型葡萄糖转运蛋白来促进肝癌细胞凋亡[7]。根皮素能够以线粒体途径诱导 BEL-7402 细胞凋亡,且呈现浓度依赖性;根皮素能干预肝癌细胞粘附、运动及侵袭能力,从而抑制肿瘤细胞转移[8-9]。由于根皮素结构中的 4 个羟基能够抑制细胞中糖的跨膜转运,阻断能量运输,因而具有诱导癌细胞凋亡的作用。
肿瘤是一种细胞周期失控性疾病,细胞无限增殖,导致细胞恶性转化,最终形成肿瘤[10]。研究认为,细胞周期进程受到阻碍会诱导细胞凋亡,细胞周期的调节可以影响细胞分裂增殖又能影响细胞凋亡,许多凋亡诱导因素在影响细胞周期进程的同时也影响凋亡机制。所以对细胞周期的检测是研究细胞凋亡的重要指标之一,通过干扰细胞周期进程来诱导凋亡也作为抗肿瘤研究的一个新思路。根皮素分子结构中具有 4 个羟基,与葡萄糖结构相似,与葡萄糖运输形成非竞争性抑制,抑制能量来源,促使细胞发生凋亡。根皮素为芳香环结构可插入到 DNA双螺旋分子中,从而阻止 DNA 合成,影响细胞周期的分布,细胞发生凋亡。
通过检测根皮素作用的细胞的周期的分布情况,发现经根皮素作用的细胞发生G1期阻滞,导致G2期细胞减少,造成进入M期的细胞数量减少,无法分裂,使增殖受阻。随着根皮素浓度的增加,G1期细胞增加,S期细胞减少。随根皮素浓度增加,160 mg/L的根皮素诱导细胞大量凋亡,而造成 G2期细胞减少。推测根皮素通过调控细胞周期的进程进而发挥促凋亡作用,这为以后开展根皮素诱导肝癌细胞凋亡机理的研究提供了重要实验依据。
线粒体与细胞凋亡过程中许多重要事件密切相关[11],发挥着重要的调控作用,线粒体膜电位下降,线粒体膜通透性转运孔开放, 膜通透性增加,使线粒体内的细胞色素C,凋亡诱导因子 AIF 等进入胞浆,启动凋亡程序[12]。根皮素是一种解偶联试剂,可以抑制线粒体的氧化磷酸化作用[13],ATP合成受阻,能量缺乏,促使细胞凋亡。本实验采用 JC-1标记结合流式细胞仪检测线粒体膜电位变化,发现经根皮素作用后的HepG-2细胞的线粒体膜电位降低。线粒体膜电位降低,导致膜通透性增强,从而使细胞色素C 从线粒体内流入细胞质,细胞色素C 与信号接头分子Apaf-1 (apoptotic protease activating factor-1) 结合,激活Caspase-9,活化 Caspase-3,启动 Caspase 的级联反应,引起细胞凋亡。推测根皮素诱导 HepG-2凋亡与细胞凋亡线粒体途径有关。
在正常细胞中Ca2+主要与蛋白质结合封存在内质网和线粒体中,游离的 Ca2+很少,只是在收到外界刺激时才被释放出来充当信号分子。几乎所有细胞的反应,从收缩、胞吐到基因表达、细胞凋亡都被细胞质内局部或全部游离 Ca2+浓度的变化控制。有研究表明游离 Ca2+在细胞内的过度积累可以直接导致细胞凋亡的发生[14]。当根皮素诱导 HepG-2 细胞凋亡时,细胞质内游离钙离子浓度升高,Ca2+稳态发生变化,表明适当浓度的根皮素有较好的诱导 HepG-2 细胞凋亡的效果。结合线粒体膜电位降低的结果推测与内质网上钙离子的释放有关,但其具体的机制有待进一步的研究。
根皮素是通过抑制细胞 DNA 合成,降低线粒体膜和干扰钙离子稳态来诱导 HepG-2 细胞凋亡的。根皮素诱导肝癌细胞凋亡及其机制有待进一步研究。
[1] 谭飔,周志钦.根皮苷研究进展[J].食品与发酵工业,2013,39(8): 182-186.
[2] Setala Kai ME.Composition and method for rational treatment of cancer[P].USA: 4555806, 1986-01-21.
[3] Kobori M, I Washita k, Shinmoto H, et al. Phloretin-induced apoptosis in B16 melanoma 4A5 and HL60 human leukemia cells.[J]. Biosci Biotechnol Bioehem, 1999, 63(4):719-725.
[4] Kobori M, Shinmoto H, Tsushida T, et al. Phloretin-induced apoptosis in B16 melanoma 4A5 celll by inhibition of glucose transmembrane transport [J]. Cancer Lett, 1997,119(2):207-212.
[5] Park SY, Kim EJ, Shin HK, et al. In-duction of apoptosis in HT-29 human colon cancer cells by phloretin [J]. J Med Food, 2007,10(4):581-586.
[6] Zhang HT, Feng ZL, Wu J, et al.Sodium butyrate-induced death-associated protein kinase expression promote Ra ji cell morphological change and apoptosis by reducing FAK protein levels.Acta.Pharmacol.Sin, 2007, 28: 1783-1790.
[7] Wu C H, Ho YS, Tsai CY, et al.In vitro and in vivo study of phloretininduced apoptosis in human l iver cancer cells involving inhibition of type II glucose transporter[J].Int J Cancer, 2009, 124(9): 2210-2219.
[8] 罗辉,汪亚君,陈杰.根皮素诱导肝癌 BEL-7402 细胞凋亡[J].南方医科大学学报,2008,28(7): 1249-1251.
[9] 罗辉,汪亚君,陈 杰.根皮素抑制肝癌细胞恶性表型的研究[J].中药材,2008,31(7): 1019-1021.
[10] Frantz D J.Hughes B G,Nelson D R.Cell cycle arrest and differential gene expression in HT-29 cel1s exposed to an aqueous garlic wxtract[J].Nutr Cancer,2000,38(2):255-264.
[11] Bouchier HL, Lartigue L, Newmeyer D.Mitochondria: pharmacological manipulation of cell death[J].J Clin Invest,2005,115: 2640-2647.
[12] Amstrong JS.Mitochondrial membrane permeabilization: the sine qua non for cell death.Bioessays, 2006, 28: 253-260.
[13] Jonge PD, Wieringa T, Van Putten JP.Phloretin- an uncoupler and an inhibitor of mitochondrial oxidative phosphorylation[J].Biochim Biophys Acta, 1983, 722(1): 219-225.
[14] Jiang S, Chow SC, Nicotera P, Orrenius S.Intracellular Ca2+signals activate apoptosis in thymocytes: Studies using the Ca2+- ATPase inhibitor thapsigargin[J].Exp Cell Res,1994, 212: 84-92.
(编校:谭玲)
Effects of proliferation and apoptosis of phloretin on the hepatoma carcinoma cells HepG-2
WANG Hui,LIU Zheng,WU Han-dong
(College of Food Science and Engineering, Liaoning Medical University, Jinzhou 121001, China)
ObjectiveTo investigate proliferative and apoptotic effects of phloretin on hepatoma carcinoma cells, hepatoma carcinoma cells HepG-2 was used as research materials.MethodsThis research observed morphological alterations using phase contrast microscopy and electron microscopy, cell proliferation were detected by MTT assay, and using flow cytometry detected apoptotic rates, cell cycle progression, mitochondrial trans-membrane potential and intracellular calcium homeostasis.ResultsApoptotic cells appeared morphological alterations.Phloretin exerted a inhibitory the proliferation of HepG-2 cell line, and induced its apoptosis in a dosage and duration dependent manner.Cell cycle was arrested at G1 phase, mitochondrial trans-membrane potential dropped, intracellular free Ca2+increased.ConclusionPhloretin can induce apoptosis of HepG-2 via arresting cell cycle progression, reducing mitochondrial trans-membrane potential and disturbing intracellular calcium homeostasis.
phloretin; human hepatoma cells; apoptosis; proliferation
王会,男,硕士,讲师,研究方向:细胞凋亡,E-mail: yxlwhx077@163.com。
R735.7
A
1005-1678(2015)07-0039-05

