西格列汀对2型糖尿病大鼠肾组织中NO/iNOS水平的影响
王栋栋,魏彤,何素梅,张冠英,尹弟,魏群利, 2
(1.徐州医学院 江苏省新药研究与临床药学重点实验室,江苏 徐州 221004;2.徐州医学院 临床药理教研室,江苏 徐州 221004)
西格列汀对2型糖尿病大鼠肾组织中NO/iNOS水平的影响
王栋栋1,魏彤1,何素梅1,张冠英1,尹弟1,魏群利1, 2
(1.徐州医学院 江苏省新药研究与临床药学重点实验室,江苏 徐州 221004;2.徐州医学院 临床药理教研室,江苏 徐州 221004)
目的 探讨西格列汀(sitagliptin,SIT)对2型糖尿病大鼠肾组织中一氧化氮(nitric oxide,NO)含量、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)表达的影响。方法 高脂饲养加小剂量链脲佐菌素诱导建立大鼠糖尿病肾病(diabetes nephropathy,DN)模型,成模后随机分为模型组(DN组)和西格列汀组(SIT组),同时设立正常对照组(NC组)。连续灌胃12周后,每组各剩6只大鼠,Griess比色法检测各组肾组织中NO含量;RT-PCR法检测肾组织iNOS mRNA的表达;免疫组化及Western blot法检测肾组织iNOS蛋白的含量。结果 与NC组相比,DN组的iNOS表达增强,NO水平升高;与DN组相比,SIT组的iNOS表达降低,NO水平下降。结论 SIT可降低糖尿病肾病早期肾组织iNOS表达及NO含量,这可能是其延缓或阻止2型糖尿病肾病进展的机制之一。
西格列汀;2型糖尿病肾病;诱导型一氧化氮合酶;一氧化氮
糖尿病(diabetes mellitus,DM)是常见的内分泌-代谢疾病,流行病学研究显示,我国成人糖尿病患病率已上升至11.6%[1],其中糖尿病肾病(diabetes nephropathy,DN)为DM最常见的并发症[2-5]。近年来研究表明,诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)表达的增强、一氧化氮(nitric oxide,NO)释放的增加是早期DN发病机制之一[6-8]。
西格列汀(sitagliptin,SIT)是一种新的治疗2型糖尿病药物,能显著改善早期糖尿病肾病的肾脏损害[9],但作用机制目前尚不清楚。因此,本实验拟通过高脂饲养加小剂量链脲佐菌素诱导的2型糖尿病大鼠模型,探索SIT对DN的作用机制。
1 材料与方法
1.1 实验动物 健康雄性SD大鼠30只, SPF级,体质量(180±20)g,徐州医学院实验动物中心提供,许可证号:SYXK(苏)2010-0011。
1.2 药品与仪器 西格列汀(默沙东,批号:Y0993);链脲佐菌素(Sigma公司,批号:wxbb2432v);一氧化氮试剂盒(碧云天生物技术研究所);iNOS及β-actin引物(生工生物工程(上海)股份有限公司);兔抗iNOS多克隆抗体(美国Abcam公司,批号:GR126616-1);兔抗GAPDH多克隆抗体(美国Abcam公司,批号:GR100112-3);荧光二抗(Odyssey Sa公司,批号:C40721-02);超敏兔两步法检测试剂盒(北京中杉金桥,批号:K155208A);DAB显色试剂盒(北京中杉金桥,批号:K1553317E);One Touch 血糖仪(美国强生医疗器材有限公司);BX43F型正置荧光显微镜(日本Olympus公司);GL2200Pro型凝胶成像系统(美国Carestream公司);红外成像系统(美国Odyssey Sa公司)。
1.3 造模与给药 30只雄性SD大鼠随机分为对照组(n=10)和高脂组(n=20)。对照组给予普通饲料喂养,高脂组给予高脂饮食(36.3%脂肪、45%碳水化合物、18.7%蛋白质)。饮食干预4周后,禁食12 h,高脂组大鼠腹腔注射小剂量链脲佐菌素(streptozocin,ST,30 mg/kg)[10-12],浓度为1%,给药体积为0.9~1.2mL,对照组大鼠注射等体积的枸橼酸缓冲液。一周后,空腹血糖(fasting blood glucose,FBG)<7.8 mmol/L的大鼠再次腹腔注射30 mg/kg STZ。每周检测一次大鼠FBG,4周后,将两次FBG≥7.8 mmol/L或一次FBG ≥11.1 mmol/L的判为2型糖尿病大鼠[13],共成模17只。将造模成功大鼠分为糖尿病肾病组(DN组,n=9)及西格列汀干预组(SIT组,n= 8),西格列汀组每天给予10 mg/kg[14]的SIT灌胃,浓度为4mg/mL,给药体积为0.875~1.125mL,糖尿病肾病组及对照组(NC组,n= 9)均给予等体积生理盐水灌胃,连续灌胃12周后各组均剩6只,处死后取肾组织备测。
1.4 方法
1.4.1 Griess法检测肾组织中NO水平:具体操作步骤按试剂盒说明书进行。
1.4.2 RT-PCR法检测肾组织iNOS mRNA的表达:按Trizol试剂说明书方法提取肾组织总RNA,取1 μg进行RT-PCR反应。所用 RT-PCR扩增引物设计如下:iNOS正向引物序列为:5’-GGCAAGATGCACATTACC -3’,反向引物序列为:5’-TTGACATCCCTTCCTGGA-3’,产物长度为249 bp;β-actin正向引物序列为:5’-TCAGGTCATCACTATCGGCAAT-3’, 反向引物序列为:5’-AAAGAAAGGGTGTAAAACGCA-3’, 产物长度为432 bp。PCR产物用1.5%琼脂糖凝胶电泳分析,用GL2200Pro型凝胶成像系统对每一标本的PCR产物扩增的特异性片段进行灰度扫描,用iNOS的灰度值与β-actin的比值表示目的基因iNOS的相对表达量。
1.4.3 免疫组化法检测肾组织iNOS蛋白的表达:肾组织石蜡包块连续切片(厚4 μm),免疫组织化学法检测iNOS蛋白的表达,具体操作按照试剂盒说明书进行。抗体按1:200的比例稀释,200倍光学显微镜下观察,iNOS蛋白阳性区出现棕黄色颗粒。
1.4.4 Western blot法检测肾组织iNOS蛋白的含量:取100 mg肾组织加入1 mL裂解液充分匀浆混匀,冰上放置10 min,4 ℃,12000 r/min离心5 min,上清转移至EP管,BCA法测定蛋白浓度。配制5%的浓缩胶及10% 的分离胶电泳分离,转膜,封闭液封闭1 h,一抗(1:200)4 ℃ 过夜,洗膜,荧光二抗37 ℃ 孵育2 h,洗膜,红外成像系统拍照,Image J 软件分析条带灰度值,以iNOS的灰度值与β-actin的比值表示iNOS的相对表达量。
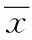
2 结果
2.1 肾组织NO的水平 NC组NO的水平为(55.29±1.47) μmol/L;DN组NO的水平为(68.71±5.19) μmol/L;SIT组NO的水平为(58.53±1.67) μmol/L。与NC组相比,DN组大鼠肾组NO的水平升高(P<0.05);与DN组相比,SIT组大鼠NO的水平有所降低(P<0.05),说明SIT有降低NO水平的作用,见图1。

图1 SIT对糖尿病大鼠肾组织NO水平的影响(n=6)*P<0.05,与 NC 组比较; #P<0.05,与DN 组比较Fig.1 Effects of SIT on the level of NO in renal tissues of diabetic rats(n=6)*P<0.05, compared with NC group;#P<0.05,compared with DN group
2.2 肾组织iNOS mRNA的表达 各组iNOS mRNA的相对灰度值分别为NC组:0.06±0.01,DN组:0.15±0.02,SIT组:0.13±0.01。与NC组相比,DN组大鼠肾组织iNOS mRNA表达升高(P<0.01);与DN组相比,SIT组大鼠iNOS mRNA表达降低(P<0.05),说明SIT有抑制iNOS mRNA表达的作用,见图2。

图2 SIT对糖尿病大鼠肾组织iNOS mRNA表达的影响(n=6)**P<0.01,与 NC 组比较; #P<0.05,与DN 组比较Fig.2 Effects of SIT on the expression of iNOS mRNA in renal tissues of diabetic rats(n=6)**P<0.01,compared with NC group;#P<0.05,compared with DN group
2.3 肾组织iNOS蛋白的表达 免疫组化结果所示,NC组大鼠肾组织iNOS低表达,阳性颗粒散在,染色较浅;DN组iNOS高表达,棕黄色信号强,融合成片;而SIT组iNOS表达又有降低,见图3;Western blot结果显示,各组iNOS蛋白相对灰度值,NC组:0.04±0.01,DN组:0.15±0.03,SIT组:0.09±0.04。与NC组相比,DN组大鼠肾组织iNOS蛋白含量升高(P<0.01);与DN组相比,SIT组大鼠肾组织iNOS蛋白含量降低(P<0.05);说明SIT能抑制糖尿病大鼠肾组织iNOS蛋白的表达。

图3 免疫组化法检测SIT对糖尿病大鼠肾组织iNOS蛋白表达的影响(×200)Fig.3 Effect of SIT on the expression of iNOS in renal tissues of diabetic rats by immunohistochemical method(×200)

图4 Western blot法检测SIT对糖尿病大鼠肾组织iNOS蛋白表达的影响(n=6)**P<0.01,与 NC 组比较; #P<0.05,与DN 组比较Fig.4 Effect of SIT on the expression of iNOS in renal tissues of diabetic rats by western blot(n=6)**P<0.01, compared with NC group;#P<0.05,compared with ND group
3 讨论
糖尿病早期的肾小球高灌注、高滤过等血流动力学异常是导致DN的重要原因。其中,NO水平的升高是糖尿病血流动力学异常的一个重要因素[15],主要是因为NO对肾脏入球小动脉的扩张作用远大于出球小动脉,直接参与了DN早期肾小球高灌注、高滤过的形成[16]。
NO是一个具有广泛生理活性的小分子,具有强烈的扩血管作用,可由一氧化氮合酶(NOS)催化L-精氨酸与氧分子经多步氧化还原生成。NOS主要有两类,一类是构成型一氧化氮合酶(constitutive NOS,cNOS),包括内皮型一氧化氮合酶(endothelial nitric oxide synthases,eNOS)和神经元型一氧化氮合酶(neuronal NOS,nNOS),是许多正常组织中基本存在的一种酶;另一类是诱导型一氧化氮合酶(inducible NOS,iNOS),只在细胞受到刺激如微生物内外毒素、炎症介质(肿瘤坏死因子、白介素)等的伤害后才显著表达[17]。研究发现[18-20],在糖尿病早期,肾脏iNOS的表达明显增强,NO生成增加。
在本实验中,糖尿病大鼠肾病早期肾组织iNOS的表达增强、NO生成增加,与前期本课题组陈肖[6]在细胞水平的发现一致。由于NO水平的升高直接参与了DN早期肾小球高灌注、高滤过的形成,是早期糖尿病肾病的危险因素之一,所以减少NO的水平对防治早期糖尿病肾病的进展意义重大;给予西格列汀干预的大鼠,肾组织中iNOS表达显著下调、NO的水平下降。然而,西格列汀是通过何种信号通路来下调iNOS表达的,目前还尚不清楚,本课题组将在接下来的研究中进一步探讨。
综上所述,SIT可降低肾组织iNOS表达及NO含量从而减轻肾脏损伤,这可能是其延缓或阻止2型糖尿病肾病进展的机制之一。
[1] Xu Y, Wang L, He J, et al.Prevalence and Control of Diabetes in Chinese Adults[J].JAMA, 2013, 310 (9) : 948-959.
[2] Fox CS, Larson MG, Leip EP, et al.Glycemic status and development of kidney disease: the Framingham Heart Study[J].Diabetes Care, 2005, 28 (10) : 2436-2440.
[3] Reutens AT, Atkins RC.Epidemiology of diabetic nephropathy[J].Contrib Nephrol, 2011, 170: 1-7.
[4] Collins AJ, Foley RN, Herzog C, et al.US Renal Data System 2010 Annual Data Report[J].Am J Kidney Dis, 2011, 57: A8, e1-526.
[5] Atkins RC, Zimmet P.World Kidney Day 2010: diabetic kidney disease--act now or pay later[J].Am J Kidney Dis, 2010, 55(2): 205-208.
[6] 陈肖, 王栋栋, 魏彤, 等.黄芪总皂苷对高糖诱导的大鼠肾小球系膜细胞增殖及iNOS/ NO表达的影响[J].中国生化药物杂志, 2015, 35 (1) : 49-51.
[7] Komers R, Anderson S.Paradoxes of nitric oxide in the diabetic kidney[J].Am J Physiol Renal Physiol, 2003, 284 (6) : 1121-1137.
[8] Thomson SC, Deng A, Komine N, et al.Early diabetes as a model for testing the regulation of juxtaglomerular NOS I [J].Am J Physiol Renal Physiol, 2004, 287 (4) : 732-738.
[9] 胡军, 杨少娟, 高啸, 等.西格列汀对早期糖尿病肾病患者的影响[J].临床内科杂志, 2014,31 (7) : 474-476.
[10] Sheela N, Jose MA, Sathyamurthy D, et al.Effect of silymarin on streptozotocin-nicotinamide-induced type 2 diabetic nephropathy in rats[J].Iran J Kidney Dis, 2013, 7(2): 117-123.
[11] Hou J, Zheng D, Zhong G, et al.Mangiferin mitigates diabetic cardiomyopathy in streptozotocin-diabetic rats[J].Can J Physiol Pharmacol, 2013, 91(9): 759-763.
[12] Epp RA, Susser SE, Morissette MP, et al.Exercise training prevents the development of cardiac dysfunction in the low-dose streptozotocin diabetic rats fed a high-fat diet[J].Can J Physiol Pharmacol, 2013, 91(1): 80-89.
[13] Zhang M, Lv XY, Li J, et al.The characterization of high-fat diet and multiple low-dose streptozotocin induced type 2 diabetes rat model[J].Exp Diabetes Res, 2008: 704045.
[14] Mega C, de Lemos ET, Vala H, et al.Diabetic nephropathy amelioration by a low-dose sitagliptin in an animal model of type 2 diabetes (Zucker diabetic fatty rat)[J].Exp Diabetes Res, 2011: 162092.
[15] Marsden PA, Brenner BM.Nitric oxide and endothelins:novel autocrine/paracrine regulator of the circulation[J].Semin Nephrol, 1991, 11 (2) : 169-185.
[16] Ozkor MA, Quyyumi AA.Tetrahydrobiopterin[J].Curr Hypertens Rep,2008, 10 (1) : 58-64.
[17] Levine DZ.Hyperfiltration, nitric oxide and diabetic nephropathy[J].Curr Hypertens Rep, 2006, 8 (2) : 153-157.
[18] Qi Z, Lin S.Increasing renal inducible nitric oxide synthase expression in earlydiabetic rats[J].Clin J Endocrinol Metab,1998,14 (1) : 41-44.
[19] Guo G, Zha C, Shen W.The relation between nitric oxide and atherosclerosis[J].Adv Cardiovasc Dis, 2001, 22 (3) : 178-180.
[20] 王秋红, 张景坤, 刘淑霞, 等.葛根素对糖尿病肾病大鼠肾组织中一氧化氮和诱导型一氧化氮合酶水平的影响[J].中国病理生理杂志, 2009, 25 (1) : 188-190.
(编校:谭玲)
Effect of sitagliptin on the expression of NO/iNOS in type 2 diabetic nephropathy
WANG Dong-dong1, WEI Tong1, HE Su-mei1, ZHANG Guan-ying1, YIN Di1, WEI Qun-li1, 2
(1. Jiangsu Key Laboratory of New Drug Research and Clinical Pharmacy, Xuzhou Medical College, Xuzhou 221004, China; 2.Department of Clinical Pharmacology, Xuzhou Medical College, Xuzhou 221004, China)
ObjectiveTo investigate effect of sitagliptin (SIT) on the expression of inducible nitric oxide synthase (iNOS) and nitric oxide (NO) in type 2 diabetic nephropathy.Methods30 rats were randomly divided into normal group (NC group), diabetic nephropathy group (DN group) and sitagliptin treatment group (SIT group).The type 2 diabetes mellitus (T2DM) rats were induced by a high fat diet (HFD) plus repeated low dose streptozocin (STZ) injections.At the end of the 12thweek in treatment,there were 6 rats in each group, the NO level was determined by Griess method.mRNA levels of iNOS RT-PCR was detect ed by.The expression of iNOS protein was detected by western blot and immunohistochemical method.ResultsCompared with the NC group, the expression of iNOS and NO of DN group increased significantly. However, compared with DN group, the expression of iNOS and NO of SIT group decreased significantly.ConclusionSIT can decrease the expression of iNOS and NO, which implies SIT may protect the type 2 diabetic kidney.
sitagliptin; type 2 diabetic kidney; inducible nitric oxide synthase; nitric oxide
国家级大学生创新训练项目(201410313024);江苏省高等学校大学生创新创业训练计划(201410313024Z);徐州医学院药学院研究生科研创新计划项目(2014YKYCX013)
王栋栋,男,硕士,研究方向:内分泌药理学及临床药学,E-mail:m13852029591@163.com;魏群利,通讯作者,男,博士,教授,硕士生导师,主任医师,研究方向:内分泌药理学及临床药学,E-mail:weiqunli@126.com。
R962
A
1005-1678(2015)07-00010-04

