糖皮质激素通过线粒体途径诱导成骨细胞凋亡
赵硕,李成
(辽宁医学院附属第一医院 质量控制办公室,辽宁 锦州 121000)
糖皮质激素通过线粒体途径诱导成骨细胞凋亡
赵硕,李成Δ
(辽宁医学院附属第一医院 质量控制办公室,辽宁 锦州 121000)
目的 探索糖皮质激素诱导成骨细胞凋亡的内在分子机制,为临床防治激素性股骨头坏死提供实验依据。方法 将MC3T3-E1细胞分为control group及3个实验组,实验组分别采用不同浓度地塞米松(1、10、100 μmol/L)干预24 h后,TUNEL法检测细胞凋亡率,JC-1染色后流式细胞仪检测线粒体跨膜电位,胞质线粒体蛋白分离提取后Western blot检测线粒体Bax、Bcl-2及胞质内Cyt-C、凋亡诱导因子(apoptosis inducing factor,AIF)表达。结果 随Dex干预浓度的增加,成骨细胞凋亡率显著性升高(F(3,28)=159.0,P=0.000),JC-1阳性细胞率显著性升高(F(3,28)=499.5,P=0.000),线粒体内Bax(F(3,28)=17.4,P=0.000)、胞质内Cyt-C(F(3,28)=22.4,P=0.000)与AIF(F(3,28)=42.61,P=0.000)表达均显著性上调。各实验组以上指标与control group相比差异有统计学意(P<0.05)。但各组线粒体内Bcl-2表达无显著性差异(F(3,28)=0.62,P=0.607)。结论 地塞米松通过上调线粒体内Bax表达,促使线粒体敏感性转化孔(mitochondrial permeability transition pore,MPTP)过度开放,经线粒体途径诱导成骨细胞凋亡。
地塞米松;成骨细胞;凋亡
目前,糖皮质激素的使用已成为非创伤性股骨头坏死的首要病因[1],但其发病机制仍不清楚。近年来有学者研究发现,在激素性股骨头坏死标本内存在着大量的成骨细胞及骨细胞凋亡,而在其他因素导致的股骨头坏死标本中却未发现这一现象[2]。其后动物实验也证实大剂量糖皮质激素可引起成骨细胞及骨细胞活性改变,凋亡是激素性骨坏死的首要变化[3-4]。因此有学者提出,GC诱导的成骨细胞及骨细胞凋亡与激素性股骨头坏死的发病机制密切相关,认为细胞凋亡是激素性股骨头坏死发生、发展的细胞学基础[5-6]。这一理论的提出为激素性股骨头坏死的病因学研究开辟了新的方向,但其凋亡信号转导通路目前尚未明确。
目前已知细胞凋亡的信号转导通路至少有3条:线粒体通路、内质网通路和死亡受体通路,其中线粒体通路最为经典[7]。本研究通过对不同浓度地塞米松(dexamethasone,Dex)干预后成骨细胞凋亡率、线粒体跨膜电位及线粒体相关凋亡蛋白在细胞内表达与定位的研究,探索激素诱导成骨细胞凋亡的分子机制,为临床防治激素性股骨头坏死提供实验依据。
1 材料与方法
1.1 材料
1.1.1 细胞株:MC3T3-E1成骨细胞株购自ATCC (ATCC CRL-2596,USA)。
1.1.2 试剂:DMEM培养基和胎牛血清购自Gibco,Dex和PBS购自Sigma,TUNEL试剂盒购自普洛麦格, JC-1试剂盒购自碧云天,胞质和线粒体蛋白提取试剂盒购自上海生工生物工程有限公司,I抗兔抗鼠Bcl-2、Bax、AIF、Cyt-C单抗购自武汉博士德,II抗辣根过氧化酶标记的羊抗兔IgG购自北京中杉。
1.1.3 仪器:正置光学显微镜(CX31,OLYMPUS公司),流式细胞仪(BD FACSVantage SE,美国BD公司),CO2培养箱(HERAcell 150i,Thermo公司),台式高速离心机(TGL-10C,上海安亭科学仪器厂),恒压恒流电泳仪(HC360,北京市六一仪器厂),SDS-PAGE垂直电泳槽(MP-8000,北京凯元信瑞生物科技有限公司),扫描仪(Bio-5000,MICROTEK ),分光光度计(UV2550,日本SHIMODZU),冷冻离心机(CT15RE,日本HITACHI),漩涡振荡器(VORTEX3000,德国WIGGENS)。
1.2 实验分组 将对数生长期的MC3T3-E1细胞充分混匀、分散,调整细胞浓度为1×106个/mL,按0.5 mL/孔接种于24孔板。设置control group及3个实验组,每组8孔,实验组分别添加不同浓度Dex(1、10、100 μmol/L)0.5 mL于37 ℃培养箱中培养24 h。
1.3 TUNEL法检测细胞凋亡 将细胞接种到预先放置有处理过的盖玻片的培养皿中,待细胞接近长成单层后取出盖玻片,PBS洗2次,4%多聚甲醛固定20 min。PBS漂洗3次,3%H2O2室温(15 ℃~25 ℃)封闭10 min;滴加100 μL TdT 酶反应液,37 ℃避光反应60 min,PBS漂洗后DAB溶液显色,苏木素常规染液复染,光镜观察。
1.4 JC-1检测线粒体跨膜电位 细胞加药处理后,常规消化,用PBS洗1次后,加入JC-1工作液(300 nmol/L),37 ℃孵育30 min后,JC-1缓冲液洗涤3次,立即上流式细胞仪检测,分析JC-1阳性率。
1.5 线粒体、胞质内蛋白分离提取 冷PBS洗涤细胞,细胞悬液中加入1 mL胞质提取Buffer,冰上均质,涡旋震荡15 s,放置冰上15 min,离心,保存沉淀;取上清转移至新冷离心管,4 ℃,12000 r/min离心30 min,上清移入新管,为胞质蛋白,-80 ℃冷冻保存;将之前沉淀加入0.1mL胞质提取Buffer,涡旋震荡30 s,13000 r/min离心10 min,弃上清;在沉淀中加入0.1 mL的线粒体溶解Buffer,冰上放置30 min,涡旋振荡30 s;4 ℃ 13000 r/min离心10 min,收集上清,为线粒体蛋白,-80°C冷冻保存。
1.6 Western blot BCA法检测蛋白浓度,取30 μg上样,聚丙烯酰胺凝胶电泳分离、转膜,5%脱脂牛奶+牛血清白蛋白4 ℃冰箱封闭过夜,加一抗(稀释比例1:2000,)匀速摇床孵育3 h后漂洗,然后加入PBS稀释的辣根过氧化物标记的二抗(稀释比例1:20000 ),室温反应1 h后漂洗,化学发光底物显色,成像。通过计算与内参蛋白(GAPDH)比值确定目的蛋白相对表达量。
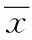
2 结果
2.1 TUNEL法检测成骨细胞凋亡率 结果显示,control group细胞核蓝染,少见凋亡细胞,而在Dex 1、10、100 μmol/L组中可见大量细胞核被染成棕褐色的凋亡细胞,且随Dex干预浓度的增加成骨细胞凋亡率显著性升高[Dex 1 μmol/L(14.2±1.8)%、10 μmol/L(22.8±2.7)%、Dex 100 μmol/L(29.5±3.8)%],在Dex 100 μmol/L时达到峰值(F(3,28)=159.0,P=0.000)。各实验组与control group[(3.7±0.5)%]相比差异有统计学意义(P<0.05),见图1。

图1 TUNEL法检测细胞凋亡率 (n=8,×400)*P<0.05,**P<0.01,与control group比较Fig.1 Detect the apoptosis rate by the TUNEL way(n=8,×400)*P<0.05,**P<0.01,compared with control group
2.2 JC-1染色后检测线粒体跨膜电位 结果显示,随Dex干预浓度的增加JC-1阳性细胞率显著性升高[1 μmol/L(12.5±1.1)%、10 μmol/L(18.7±1.2)%、100 μmol/L(27.2±1.7)%],线粒体跨膜电位降低,在100 μmol/L时达到峰值(F(3,28)=499.5,P=0.000)。各实验组与control group[(4.5±0.7)%]相比差异有统计学意义(P<0.05),见图2。

图2 JC-1染色检测线粒体跨膜电位结果(n=8)*P<0.05,**P<0.01,与control group比较Fig.2 Results of mitochondrial transmembrane electric potential after JC-1 staining(n=8)*P<0.05,**P<0.01,compared with control group
2.3 Western blot检测线粒体内Bax、Bcl-2表达 线粒体蛋白分离提取后行Western blot检测,结果显示随Dex干预浓度的增加线粒体内Bax表达显著性上调[1 μmol/L(0.28±0.05)、10 μmol/L(0.37±0.08)、100 μmol/L(0.43±0.11)],在100 μmol/L时达到峰值(F(3,28)=17.4,P=0.000)。各实验组与control group[(0.18±0.04)]相比差异有统计学意(P<0.05)。各组线粒体内Bcl-2表达无显著性差异[control group (0.48±0.09)、1 μmol/L(0.51±0.12)、10 μmol/L(0.44±0.11)、100 μmol/L(0.46±0.11)] (F(3,28)=0.62,P=0.607)。

图3 Westen blot检测线粒体内Bax、Bcl-2表达情况(n=8)*P<0.05,**P<0.01,与control group比较Fig.3 Expression of Bax and Bcl-2 in the mitochondria by Western blot(n=8)*P<0.05,**P<0.01,compared with control group
2.4 Western blot检测胞质内Cyt-C、AIF表达 胞质蛋白分离提取后行Western blot检测,结果显示随Dex干预浓度的增加胞质内Cyt-C[control group (0.16±0.03)、1 μmol/L(0.34±0.08)、10 μmol/L(0.45±0.13)、100 μmol/L(0.58±0.15)] (F(3,28)=22.4,P=0.000)、AIF[control group (0.15±0.03)、1 μmol/L(0.36±0.09)、10 μmol/L(0.58±0.16)、100 μmol/L(0.78±0.15)] (F(3,28)=42.61,P=0.000)表达均显著性上调,在100 μmol/L时达到峰值。各实验组与control group比较差异有统计学意(P<0.05)。

图4 Western blot检测胞质内Cyt-C、AIF表达情况(n=8)*P<0.05,**P<0.01,与control group比较Fig.4 Expression of Cyt-C,AIF in the cytoplasm by Western blot(n=8)*P<0.05,**P<0.01,compared with control group
3 讨论
以往研究表明,大剂量糖皮质激素可以诱导成骨细胞凋亡,且随着剂量增加细胞凋亡率逐渐升高[3],这一论断在本研究中得到了验证,但具体的凋亡信号转导通路目前仍不明确。因此本研究通过检测各组细胞线粒体跨膜电位(mitochondrial membrane potential,△Ψm)及线粒体相关凋亡蛋白的表达,进一步探讨激素诱发成骨细胞凋亡的内在分子机制。
线粒体膜通透性转运孔(mitochondrial permeabimity transitionproe,MPTP) 是定位于线粒体内、外膜之间由多种蛋白组成的非选择性复合通道,是线粒体内外信息的交流中枢,其开放状态决定着线粒体的功能发挥,在生理情况下的周期性开放对维持ΔΨm及线粒体内稳态有重要作用。在各种凋亡信号刺激下MPTP不可逆的过度开放,将导致ΔΨm下降甚至消失,呼吸链解偶联,线粒体基质渗透压增高,促凋亡活性物质释放入胞质,从而启动细胞凋亡程序[8]。通过检测ΔΨm可直观地反映MPTP的开放状态。本研究发现,随着Dex干预浓度的增加,JC-1阳性细胞率显著性升高,组间比较差异有统计学意义(P<0.05),这一结果说明Dex干预浓度的增加促进了MPTP过度开放,使△Ψm降低,Dex可以通过线粒体途径诱导成骨细胞凋亡。
由于以往研究表明,MPTP过度开放是通过Bcl-2家族抗凋亡蛋白与促凋亡蛋白相互作用实现的[9-11],因此选择Bcl-2家族中具有代表性的2个蛋白Bax、Bcl-2,通过对其在细胞内的表达与定位研究进一步探讨Dex对 MPTP的调控机制。Bax与Bcl-2是一对研究较明确、作用完全相反的线粒体相关凋亡蛋白,2者比值决定细胞对凋亡信号的反应。Bax正常定位于胞质内,在凋亡信号的刺激下可由细胞质易位到线粒体外膜,构成跨线粒体外膜的孔增加膜通透性,导致ΔΨm降低和Cyt-C及AIF的外流[12-13]。Bcl-2在正常细胞内定位于线粒体外膜,具有稳定线粒体膜的功能,可以封闭Bax形成孔道的活性,不断地将易位至线粒体的Bax重新移回细胞质内,从而阻止线粒体外膜透化[14]。Cyt-C与AIF均锚定于线粒体内膜,当MPTP过度开放时其由线粒体释放进入细胞质,可通过caspase依赖/非依赖途径诱导细胞凋亡[15-16]。
本研究中发现,随Dex干预浓度的增加,线粒体内Bax及胞质内Cyt-C、AIF表达均显著性上调(P<0.05),而线粒体内BCL-2无明显变化,这一结果提示Dex是通过促使Bax由胞质易位至线粒体,使线粒体内Bcl-2/Bax比值降低,导致线粒体膜透化、MPTP过度开放,从而促进了Cyt-C、AIF等凋亡活性物质外流进而诱导凋亡。这可能是Dex诱导成骨细胞凋亡的机制之一。
[1] Schacke H,Docke WD,Asadullah K.Mechanisms involved in the side effects of glucocorticoids [J].Pharmacol Ther,2002,96(1):23-43.
[2] Weinstein RS,Nicholagas RW,Manolagas SC.Apoptosis of osteonecrosis in glucocorticoid- induced osteonecrosis of the hip[J].J Clinical Endocrinology &Metabolism.2000(85):2907-2912.
[3] Ding S,Peng H,Fang HS,et al.Pulsed electromagnetic fields stimulation prevents steroid-induced osteonecrosis in rats[J].BMC Musculoskelet Disord,2011(12):215.
[4] Sato AY,Tu X,McAndrews KA,et al.Prevention of glucocorticoid induced-apoptisis of osteoblasts and osteocytes by protecting against endoplasmic reticulum(ER)stress invitro and vivo in female mice[J].Bone,2015(73):60-68.
[5] Yun SI,Yoon HY,Jeong SY,et al.Glucocorticoid induces apoptosis of osteoblast cells through the activation of glycogen synthase kinase 3B[J].J Bone Miner Metab,2009,27(2):140-148.
[6] Youm YS,Lee SY,Lee SH,et al.Apoptosis in the osteonecrosis of the femoral head[J].Clin Orthop Surg,2010,2(4):250-255.
[7] Norberg E,Orrenius S,Zhivotovsky B.Mitochondrial regulation of cell death:processing of apoptosis-inducing factor ( AIF)[J].Biochem Biophys Res Commun,2010,396(1):95-100.
[8] Qiu Y,Yu T,Wang W,et al.Curcumin-induced melanoma cell death is associated with mitochondrial permeability transition pore (MPTP)opening[J].Biochem Biophys Res Commun,2014,228(1):15-21.
[9] Ola MS,Nawaz M,Ahsan H.Role of Bcl-2 family proteins and caspases in the regulation of apoptosis[J].Mol Cell Biochem,2011,351(1-2):41-58.
[10] Gu X,Yao Y.Plasminogen K5 activates mitochondrial apoptosis pathway in endothelial cells by regulating Bak and Bcl-xl subcellular distribution[J].Apoptosis,2011,16( 8):846-855.
[11] Karch J,Kwong JQ ,Burr AR,et al .Bax and Bak function as the outer membrane component of the mitochondrial permeability pore in regulating necrotic cell death in mice[J].ELife,2013(2):e00772.
[12] Jia G,Wang Q,Wang R,et al.Tubeimoside-1 induces glioma apoptosis through regulation of Bax/Bcl-2 and the ROS/Cytochrome C/Caspase-3 pathway[J].Onco Tarqits Ther,2015(8):303-311.
[13] Cho SY,Lee JH,Ju MK,et al.Cystamine induces AIF-mediated apoptosis through glutathione depletion[J] .Biochim Biophys Acta,2015,1854(3):619-631.
[14] Edlich F,Banerjee S,Suzuki M.et al.Bcl-xL retrotranslocates Bax from the mitochondria into the cytoso[J].Cell,2011,145(1):104-116.
[15] Matsumura M,Tsuchida M,Lsoyama N,et al.FTY720 mediates cytochrome c release from mitochondria during rat thymocyte apoptosis[J].Transpl Immunol,2010,23(4):174-179.
[16] Eloy L,Jarrousse AS,Teyssot ML,et al.Anticancer activity of silver-N- heterocyclic carbene complexes:caspase-independent induction of apoptosis via mitochondrial apoptosis-inducing factor (AIF)[J].Chem Med Chem,2012,7(5):805-815.
(编校:王俨俨)
Glucocorticoid induced apoptosis in osteoblast via a mitochondria-mediated pathway
ZHAO Shuo,LI ChengΔ
(Quality Control Office,The Frist Hospital of Liaoning Medical Colleage, Jinzhou 121000, China)
ObjectiveTo explore the molecular mechanism of osteoblast apoptosis mediated by glucocorticoid, provide experimental basis for clinical prevention and treatment of hormonal necrosis of femoral-head.MethodsThe MC3T3-E1 cells were divided into control group and three treatment group treated with different concentrations of dexamethasone (1, 10, 100 μmol/L) for 24 hours.The apoptosis rate detected by TUNEL, the mitochondrial transmembrane electric potential after JC-1 staining by flow cytometry, the expression of Bax, Bcl-2 in mitochondrion and Cyt-C, apoptosis inducing factor (AIF) in cytoplasm by Western blot.ResultsWith the increasing of Dex concentration, the rate of osteoblast apoptosis was significantly increased(F(3,28)=159.0,P=0.000), the positive cell rate of JC-1 stainning was significantly increased(F(3,28)=499.5,P=0.000), the expression of Bax(F(3,28)=17.4,P=0.000)in mitochondrion and Cyt-C(F(3,28)=22.4,P=0.000), AIF(F(3,28)=42.61,P=0.000)in cytoplasm were significantly increased.There were statistically significant difference of above indexes between control group and each experimental group(P<0.05).But there were no significant differences of Bcl-2 in mitochondrion among five groups(F(3,28)=0.62,P=0.607).ConclusionDexamethasone increases expression of Bax in mitochondrion, prompts mitochondrial permeability transition pore (MPTP) to be over-openning, induces apoptosis in osteoblast via a mitochondria- mediated pathway.
dexamethasone; osteoblasts; apoptosis
辽宁省自然科学基金(2013022061)
赵硕,女,硕士,主管护师,研究方向:骨坏死的临床与基础研究,E-mail:zhaoshuo1982@126.com;李成,通讯作者,男,医学博士,副主任医师,研究方向:骨坏死的临床与基础研究,E-mail:lichen19780101@163.com。
R681.1
A
1005-1678(2015)07-0035-04

