槲皮素对宫颈癌裸鼠模型肿瘤生长及其对乙酰肝素酶表达的关系研究
魏玮,刘婷,丁波,曹树稳
(1.江西省宜春职业技术学院 医学院,江西 宜春 336000;2.江西省宜春职业技术学院附属医院药学教研室,江西 宜春 336000;3.南昌大学 生命科学学院,江西 南昌 330000)
槲皮素对宫颈癌裸鼠模型肿瘤生长及其对乙酰肝素酶表达的关系研究
魏玮1Δ,刘婷1,丁波2,曹树稳3
(1.江西省宜春职业技术学院 医学院,江西 宜春 336000;2.江西省宜春职业技术学院附属医院药学教研室,江西 宜春 336000;3.南昌大学 生命科学学院,江西 南昌 330000)
目的 研究槲皮素对宫颈癌生长的作用,及其对乙酰肝素酶表达的关系,初步探讨槲皮素抑制宫颈癌作用的可能机制。方法 建立宫颈癌裸鼠模型,将植瘤成功的30只裸鼠进行如下随机分组:25 mg/kg槲皮素组、50 mg/kg槲皮素组、100 mg/kg槲皮素组和PI-88阳性对照组及空白对照组;观察各组透射电镜下血管内皮细胞超微结构的变化;以Western blot蛋白免疫印记技术检测癌瘤中乙酰肝素酶蛋白质水平改变,将空白组做为灰度参照,计算出各组间相对灰度值,进行统计学分析。结果 50 mg/kg、100 mg/kg槲皮素组及PI-88组较空白组中宫颈癌生长体积小(P<0.05);50 mg/kg组可见肿瘤组织中血管内皮细胞和线粒体肿胀等改变,100 mg/kg组可见膜性结构的消失及胞质边集等改变,PI-88组可见管腔闭锁,液泡状滑面内质网和死亡的细胞;50 mg/kg组和100 mg/kg组宫颈癌植瘤瘤体组织中乙酰肝素酶表达较空白对照组减少(P<0.05),PI-88组较50 mg/kg组和100 mg/kg组乙酰肝素酶表达减少(P<0.01),而25 mg/kg组较空白对照组差异无统计学意义。结论 50、100 mg/kg槲皮素可抑制宫颈癌细胞生长,其可导致宫颈癌植瘤瘤体内血管内皮细胞细胞超微结构的改变。槲皮素对宫颈癌的抑制作用可能与降低乙酰肝素酶蛋白表达有关。
槲皮素;乙酰肝素酶;宫颈癌
宫颈癌(cervical cancer)是最常见的妇科恶性肿瘤之一,严重威胁着妇女的健康,每年约有51万例新发病例,每2分钟就有1例宫颈癌发生[1]。更加值得注意的是,宫颈癌死亡率高,其主要原因是肿瘤的高生长性、高复发性、高转移性[2]。因此,如何抑制肿瘤生长、复发和转移,降低死亡率,延长患者的无病生存期,提高其生活质量是当下需要解决的关键问题[3]。然而,目前肿瘤的治疗药物其不良反应较大,疗效有限,研制低毒性、高疗效的抗癌活性成分已成为国内外学者研究癌症治疗的热点。硫酸化寡聚多糖(PI-88)为近年研究的热点肿瘤抑制剂之一,在体外小鼠试验中发现该肿瘤抑制剂具有抑制乙酰肝素酶表达的作用[4]。本研究分析槲皮素对宫颈癌生长的作用及其对乙酰肝素酶表达的关系,初步探讨槲皮素抑制宫颈癌作用的可能机制。
1 材料与方法
1.1 实验材料
1.1.1 细胞系:HeLa细胞系(上海信裕生物科技有限公司)。
1.1.2 实验动物:30只健康 BALB/c/nu 雌性裸鼠,6~8周龄,体质量18~20 g(北京维通利华实验动物技术有限公司,合格证号:SCXK京2012 -0001);饲养于SPF 级屏障系统的洁净层流架内,室温在 25 ℃,相对湿度40% ~60%。
1.1.3 主要药品与试剂:槲皮素(Sigma公司,货号CAS6151-25-3);1RPMI-1640培养基(美国Invitrogen公司);胎牛血清(杭州四季青生物工程材料有限公司);胰蛋白酶(美国Invitrogen公司);青链霉素(美国Invitrogen公司);HPA抗体(美国Santa Cruz公司);Actin抗体(美国Santa Cruz公司);PI-8(澳大利亚Progen公司);无水乙醇,国产分析纯;NC膜(美国Millipore公司);预染蛋白,Marker(美国Fermentas公司);辣根过氧化物酶标记的羊抗兔二抗(美国Pierce公司);Co-tail抑制剂(美国Roche公司);PBS干粉(武汉博士徳公司)。
1.1.4 实验仪器:倒置显微镜(香港先达分析仪器有限公司,型号:XD50R);电子天平(郑州万博仪器设备有限公司,型号:HZX-JA100);凝胶成像分析系统(美国Bio-Rad公司);725N紫外可见分光光度计(上海精密仪器设备厂);Elix纯水系统(美国Millipore公司);Platiunm 500超低温冰箱,(意大利MASSA MARTANA公司); 1200EX透射电子显微镜(日本电子株式会社)。
1.2 实验方法
1.2.1 细胞培养:宫颈癌HeLa细胞生长于含有10%小牛血清及100 μg/mL的青链霉素的RPMI-1640培养液中,置于37 ℃、5%CO2、95%饱和湿度条件下的恒温密闭培养箱中常规培养。每天仔细观察所培养的细胞,观测是否有污染或发生细胞变性等,一经发现立即丢弃。当培养液颜色由红色转为黄色时或细胞密度较大时,更换培养液。一般2~3天更换一次。
1.2.2 不同槲皮素浓度的配制方法:槲皮素(Sigma 公司,货号 CAS6151- 25- 3),加入0. 3 g的槲皮素至离心管,加入DMSO至10cc,振动至溶解,浓度为 0.1 mol/L(贮备原液),分装各1 mL至ependorf避光小管中,于-20 ℃冰箱保存。
1.2.3 构建裸鼠模型:将30只6~8周,体重量约18~20 g的BALB/c雌性裸鼠随机分成5组,分别为空白对照组、25 mg/kg槲皮素组、50 mg/kg槲皮素组、100 mg/kg槲皮素组及PI-88阳性对照组。在每只裸鼠的右后肢背部皮下注入1×106/mL HeLa细胞,6 d后,可见每只裸鼠肿瘤细胞注射部位都长出米粒大小的肿块,第7天起,分别对5组裸鼠注射100 μL 90%玉米油+10%的乙醇、25 mg/kg槲皮素、50 mg/kg槲皮素、100 mg/kg槲皮素及20 mg/kg的PI-88,共注射15 d。
1.2.4 测定肿瘤生长:给药第6天起,每3天用游标卡尺测量瘤块的的长径和短径,直至第15天,并计算瘤块的体积。体积公式为V =π/ 6LW2(L为长径,W为短径)。
1.2.5 肿瘤标本处理:透射电镜将取下来的肿块浸没在冷2.5%戊二醛中固定,再以1%饿酸固定(pH 7.2),梯度乙醇脱水,Epon812包埋后切片,选取银灰色的超薄切片,用醋酸双氧铀-柠檬酸铅双染色后在透射电子显微镜(10万倍)下观察并照相。
1.2.6 Western blot检测:①清洗玻璃板然后用去离子双蒸水冲洗3次后,放入烘箱中烤干;②配制12%分离胶;③去除无水乙醇;④配制5%浓缩胶;⑤注入浓缩胶后,应立即插入梳子;⑥取制备好的蛋白样本,根据所需蛋白总质量上样;⑦SDS- PAGE 电泳:在电泳槽内加入1×电泳缓冲液,先使用恒定电压70 V,进行Western blot检测。
凝胶图象分析:将Actin蛋白表达水平作为内参照,将各组与Actin进行比较,保证各组蛋白加样量相等。用凝胶图象处理系统对胶片进行成像,分析各组别样本灰度值和相应Actin蛋白灰度。以各样本灰度值与Actin蛋白灰度值求比后,与对照组灰度值进行比较,求得相对灰度值,进行统计分析。

2 结果
2.1 槲皮素抑制肿瘤生长 给药后第6、9、12、15天,25 mg/kg槲皮素组与空白对照组相比,肿瘤体积差异无统计学意义。而50、100 mg/kg槲皮素组及PI-88阳性对照组的肿瘤体积显著减小(P<0.01)。而从第9 天开始到第12、15天,50、100 mg/kg槲皮素组及PI-88组与25 mg/kg 槲皮素组进行比较,肿瘤体积明显减少(P<0.05);结果提示50、100 mg/kg槲皮素可以抑制宫颈癌植瘤瘤体的生长。在给药后的第9、12、15天期间,与PI-88阳性对照组比较,50 mg/kg槲皮素组数据有统计学意义 (P<0.05)。值得注意的是,100 mg/kg组与PI-88比较,差异无统计学意义,提示PI-88组与100 mg/kg槲皮素组对宫颈癌生长的可能存在类似抑制效果。随着槲皮素作用时间的增加,50、100 mg/kg槲皮素抑制宫颈癌组织的抑制作用更为明显。见表1。

表1 各组裸鼠肿瘤体积大小测定
*P<0.05,与空白对照组相比,compared with blank control group;#P<0.05,与PI-88 组比较,compared with PI-88 positive control group;ΔP<0.05,与25 mg/kg槲皮素组比较,compared with 25 mg/kg quercetin group

图1 各组裸鼠肿瘤生长曲线(n=6)Fig.1 Nude mice tumor growth curve(n=6)
2.2 槲皮素导致血管内皮细胞超微结构的变化 结果显示,槲皮素可导致裸鼠宫颈癌植瘤瘤体血管内皮细胞超微结构的变化,这种变化与槲皮素的剂量呈相关性(见图1)。25 mg/kg 槲皮素组中血管内皮细胞无显著变化。但在50 mg/kg 槲皮素组中,可以观察到血管内皮细胞和线粒体的肿胀,核糖体、滑面内质网、一些膜性结构的消失、变形的红细胞和细胞间连接的分解。在100 mg/kg 槲皮素组中,可以发现膜结构、细胞器的消失和细胞质的边集。而在PI-88组中,在瘤体组织中可观察到血管管腔发生闭锁,空泡样滑面内质网及其周边的死亡细胞,见图2。由图2中可知,50 mg/kg 槲皮素可引起内皮细胞肿胀,而100 mg/kg 槲皮素可导致血管内皮细胞的退化,同时PI-88可以导致管腔闭锁。
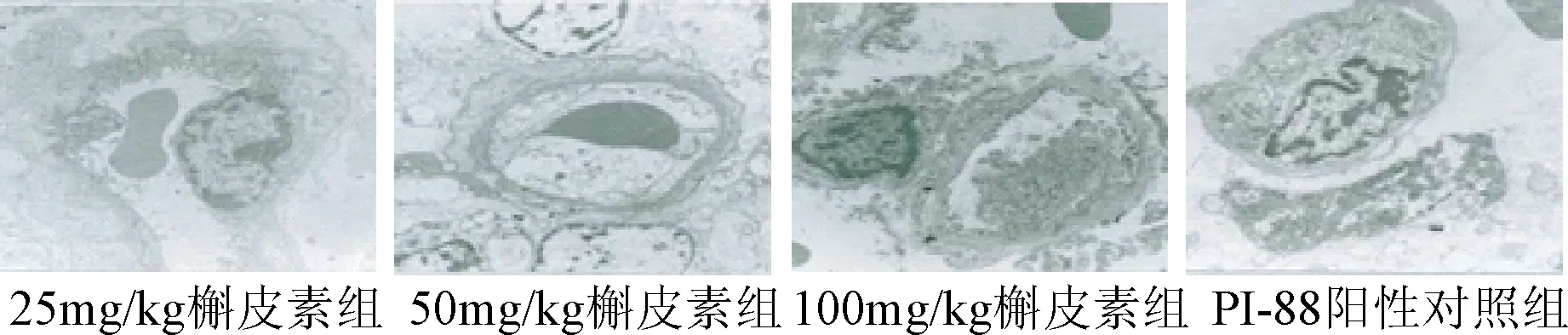
图2 电镜下血管内皮细胞超微结构的变化(×10万)Fig.2 Changes of the ultrastructure of vascular endothelia cells under electron microscope(×10万)
2.3 槲皮素导致宫颈癌中乙酰肝素酶蛋白表达下降 乙酰肝素酶多克隆抗体有2种亚型,活性亚型(50 kDa)和非活性亚型(65 kDa)。用Western blot 检测宫颈癌裸鼠瘤体组织中乙酰肝素酶蛋白的表达,宫颈癌肿瘤组织中活性亚型和非活性亚型的乙酰肝素酶均有表达,且HeLa细胞系中非活性亚型表达量较活性亚型表达量高。见图3、表2。
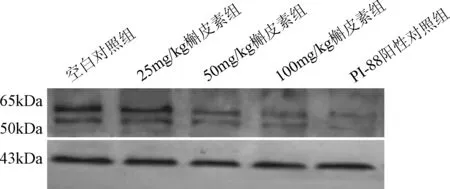
图3 Western blot检测各组移植瘤乙酰肝素酶蛋白的表达Fig.3 Expression of transplantation tumor of heparanase by Western blot
对条带进行灰度分析并绘制相对灰度柱状图,见表2。由表2可知,发现在非活性亚型中:与空白对照组相比,25 mg/kg 槲皮素组的表达量无显著性差异;而50、100 mg/kg槲皮素组、PI-88阳性对照组的表达量明显减少(P<0.01); 与PI-88 阳性对照组相比,25、50、100 mg/kg槲皮素组的表达量明显减少(P<0.05)。 在活性亚型中:25 mg/kg组分别与空白对照组、50 mg/kg组比较,均无显著性差异;将25 mg/kg组分别与100 mg/kg组、PI-88组比较,发现差异有显著性(P<0.01);将50 mg/kg组、100 mg/kg 组与PI-88组进行组间比较,发现差异亦具有统计学意义(P<0.05)。 这些结果表明50、100 mg/kg槲皮素可以抑制宫颈癌裸鼠植瘤瘤体中乙酰肝素酶蛋白的表达。

表2 各组乙酰肝素酶蛋白表达比较Tab.2 Comparison of expression of heparanase protein of each group(±s,n=6)
*P<0.05,与空白对照组相比,compared with blank control group;#P<0.05,与PI-88 组比较,compared with PI-88 positive control group;ΔP<0.05,与25 mg/kg槲皮素组比较,compared with 25 mg/kg quercetin group
3 讨论
槲皮素(quercetin)是自然界分布最广泛的天然黄酮类物质,其能通过抑制肿瘤细胞增殖、诱导凋亡、调节细胞周期等发挥抗肿瘤作用已被一系列实验研究所证实[5]。Parish CR等[6]的进一步研究也发现:槲皮素能抑制HeLa细胞的粘附、迁移和侵袭,其抑制作用与槲皮素作用剂量呈正相关。
本研究结果显示,50、100 mg/kg 槲皮素组及 PI-88阳性对照组与空白对照组相比较,发现肿瘤体积显著缩小(P<0.01)。同时,50、100 mg/kg槲皮素组及PI-88 组与25 mg/kg槲皮素组进行比较,肿瘤体积明显减小(P<0.05)。25 mg/kg 槲皮素组与空白对照组相比,差异无统计学意义。结果提示50、100 mg/kg 槲皮素可以抑制宫颈癌肿瘤组织的生长。这与杨洋等[7]前期在细胞水平的研究存在相似性:槲皮素对宫颈癌细胞存在明显抑制作用,且随着槲皮素剂量的增加对宫颈癌细胞的抑制作用增强。
同时,本研究还显示,给药后第6、9、12、15天,空白对照组与25 mg/kg槲皮素组相比,均无统计学意义,这表明25 mg/kg浓度槲皮素对肿瘤组织的抑制作用甚微,而25 mg/kg浓度槲皮素组在电镜下也未显现形态学变化,这2者是相吻合的。而从给药后第9天开始,50、100 mg/kg槲皮素组及PI-88组与25 mg/kg 槲皮素组及空白对照组进行比较,差异具有统计学意义,50 mg/kg槲皮素与PI-88阳性对照组比较,差异具有统计学意义,提示PI-88阳性对照组比50 mg/kg槲皮素作用强,100 mg/kg槲皮素组与PI-88阳性对照组比较,组间差异未表现出统计学意义,提示 100 mg/kg 槲皮素组与PI-88阳性对照组对肿瘤的抑制作用相似,并且随着作用时间的延长,100 mg/kg槲皮素对宫颈癌生长的抑制作用更为明显。PI-88是硫酸化磷酸甘露低聚糖混合物之一,由于其与乙酰肝素酶底物结构极为类似。通过竞争性抑制的机制,PI-88可以与乙酰肝素酶相结合,降低乙酰肝素酶的活性,从而抑制肿瘤的发展[8]。而本研究中100 mg/kg槲皮素组与PI-88阳性对照组对肿瘤的抑制作用效果相似,为阐明槲皮素对宫颈癌生长抑制作用的机制提供了可能的解释途径。槲皮素对肿瘤组织生长的抑制作用中可能涉及到乙酰肝素酶表达量的调控,甚至有可能与PI-88有类似的对乙酰肝素酶的竞争性抑制作用,这有待进一步研究。
PI-88是硫酸化磷酸甘露低聚糖混合物之一,是目前较为公认的具有抑制乙酰肝素酶活性作用的合成物。由于其与乙酰肝素酶底物结构极为类似,它能够与乙酰肝素酶的反应底物相竞争,减少乙酰肝素酶与其正常底物接触的机会,消耗组织内部乙酰肝素酶表达量,使得乙酰肝素酶的活性下降或失活,从而达到抑制肿瘤发展的作用[9]。从研究结果可知,在给药第 9 天开始到给药第 15天结束期间,100 mg/kg 槲皮素组与 PI-88 阳性对照组比较,差异无统计学意义,这表明100 mg/kg槲皮素与PI-88在总体上对肿瘤体积的抑制作用相似。介于 PI-88对乙酰肝素酶活性的竞争性抑制作用,本研究假设槲皮素对肿瘤组织生长的抑制作用中也可能涉及到对乙酰肝素酶表达量的影响,故此对乙酰肝素酶的蛋白表达进行了进一步检测。然而,槲皮素对乙酰肝素酶的抑制作用中是否与PI-88对乙酰肝素酶的竞争性抑制作用相类似,本研究中尚未涉及,这有待进一步研究。
为了研究槲皮素注射后肿瘤组织血管内皮细胞超微结构是否发生变化,本研究使用透射电镜对裸鼠植瘤瘤体组织血管内皮细胞进行观察。结果显示,50 mg/kg 槲皮素组中瘤体血管内皮细胞及线粒体肿胀,核糖体和内质网的消失;而在100 mg/kg槲皮素组中瘤体血管内皮细胞胞浆边集,细胞器消失,最后在PI-88组可见管腔闭锁及死亡的细胞。这些超微结构的变化与细胞凋亡表现类似,这表明槲皮素抑制肿瘤组织生长的可能原因与介导血管内皮细胞发生凋亡,抑制血管内皮细胞的生成有关。而前期黄丽琼等[10]的研究也表明,槲皮素对宫颈癌细胞的凋亡有促进作用,但其中的机制有待进一步研究。
细胞外基质(extracellular matrixc,ECM)和基底膜(basement membrane,BM)的侵袭破坏以及新生血管的形成是肿瘤细胞扩散和转移的重要步骤,而硫酸乙酰肝素蛋白多糖(heparan sulfate proteoglycan,HSPG)是 ECM 的主要组成部分。乙酰肝素酶(heparanase,HPA)是迄今为止在哺乳动物中发现的唯一一种裂解HSPG 中乙酰肝素酶硫酸链(heparanase sulfate chains,HS)的糖苷酸内切酶。不同种类哺乳动物的正常细胞与肿瘤细胞 HPA 的高度同源性证实所有的哺乳动物只表达一种基因克隆的 HPA,这使HPA 作为治疗的靶向目标成为可能[11]。HPA不仅能调控多种细胞生长因子和细胞因子活性,还可破坏ECM的完整性,诱导肿瘤血管生成,从而在肿瘤细胞的生长和转移进程中发挥重要作用。研究显示[12],宫颈癌组织中HPA 蛋白表达水平较正常宫颈组织及宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)中HPA 蛋白表达水平高,并且随着宫颈癌临床期别的增高,HPA 蛋白表达水平也逐渐增高;在淋巴结转移组中HPA 蛋白的表达显著高于无淋巴结转移组。另有研究者提出[13],乙酰肝素酶在宫颈癌中的表达可能促进了癌细胞的生长、侵袭以及血管生成,抑制该酶的活性可能具有治疗宫颈癌的作用。鉴于乙酰肝素酶在肿瘤生长中起着重要的促进作用,本研究检测了宫颈癌肿瘤组织中乙酰肝素酶蛋白的表达。结果显示活性亚型(50 kDa)和非活性亚型(65 kDa)在肿瘤组织中均有表达,而非活性亚型表达水平较活性亚型表达水平高。这表明乙酰肝素酶蛋白与槲皮素抑制宫颈癌肿瘤细胞的生长有关。而本研究中未阐明槲皮素是直接亦或间接影响到乙酰肝素酶的表达。
综上所述,本研究发现50、100 mg/kg槲皮素可以抑制宫颈癌组织的生长、影响血管内皮细胞超微结构,这种作用可能与降低乙酰肝素酶蛋白水平有关。这为槲皮素成为抑制宫颈癌的药物提供了理论依据。然而,本研究仅仅说明槲皮素抑制宫颈癌与乙酰肝素酶有相关性,但其中所涉及到的确切通路仍需要进一步研究。
[1] Bazhenov AG, Guseinov KD, Khadzhimba AV, et al. Results of treatment for recurrent cancer of the uterine cervix[J]. Vopr Onkol,2009,55(3):319-326.
[2] Hirpara KV, Aggarwal P, Mukherjee AJ, et al. Quercetin and its derivatives: synthesis, pharmacological uses with special emphasis on anti-tumor properties and prodrug with enhanced bio-availability[J]. Anticancer Agents Med Chem,2009,9(2):138-161.
[3] Bach A, Bender-Sigel J, Schrenk D, et al. The antioxidant quercetin inhibits cellular proliferation via HIF-1-dependent induction of p21WAF[J]. Antioxid Redox Signal, 2009, 9(2):138-161.
[4] 朱辉,何明,陈新,等. PI-88对TE-13细胞及裸鼠移植瘤中乙酰肝素酶表达的影响[J]. 天津医药,2015,43(7):745-748.
[5] Shinyo Y, Kodama J, Hasengaowa,et al. Loss of cell-surface heparan sulfate expression in both cervical intraepithelial neoplasm and invasive cervical cancer[J].Gynecol Oncol,2005,96(3):776-783.
[6] Parish CR, Freeman C, Brown KJ, et al. Identification of sulfated oligosaccharide-based inhibitors of tumor growth and metastasis using novel in vitro assays for angiogenesis and heparanase activity[J]. Cancer Res,1999,59(14):3433-3441.
[7] 杨洋,张蔚,黄丽琼,等. 槲皮素联合顺铂对宫颈癌HeLa细胞增殖及凋亡的影响[J]. 武汉大学学报(医学版),2009,30(3): 354-357.
[8] 张峰莉,张蔚. 槲皮素以及槲皮素联合顺铂对子宫颈癌细胞粘附?转移和侵袭的影响[J]. 中华妇产科杂志,2009,43(8):619-621.
[9] Zhang W, Zhang FL. Effect of quercetin on breeding and apoptosis of cervical cancer,HeLa cell and on growth of transplanted tumor in Nude mice[J]. WUJNS,2007,12(3):569-576.
[10] 黄丽琼,张蔚. 槲皮素对子宫颈癌HeLa 细胞的作用及其机制[J]. 中华妇产科杂志,2009,44(6):436-439.
[11] 朱辉,何明,陈新,等. PI-88对TE-13细胞及裸鼠移植瘤中乙酰肝素酶表达的影响[J]. 天津医药,2015,43(7):745-748.
[12] 李燕杰,李淑莲. 乙酰肝素酶的分子特性及其在生理病理过程中的作用[J]. 河南大学学报(医学版),2008,27(3):14-19.
[13] 牛菊敏. 乙酰肝素酶与宫颈癌侵袭转移的实验研究[D].沈阳:中国医科大学,2007.
(编校:王冬梅)
Study on relationship of quercetin on cervical carcinoma in nude mice model of tumor growth and the expression of heparanase
WEI Wei1Δ, LIU Ting1, DING Bo2, CAO Shu-wen3
(1. Medical School, Yichun Vocational and Technical College of Jiangxi Province, Yichun 336000, China; 2. Department of Pharmacy, Affiliated Hospital of Yichun Jiangxi Vocational and Technical College of Jiangxi Province, Yichun 336000, China; 3. College of Life Science, Nanchang University, Nanchang 330000, China)
ObjectiveTo explore effect of quercetin on growth of cervical cancer,and its relationship to expression heparanase, and to investigate the possible mechanism of the inhibition effect of quercetin on cervical cancer.MethodsHeLa cells were injected into nude mouse to establish the model of cervical cancer. 30 nude mice with palpable tumors were randomly assigned to five groups: 25,50,100 mg/kg quercetin groups,PI-88 positive group and blank control group. Transmission electron microscope was used to observe the ultrastructural changes of the vascular endothelial cells in each group. The expression of heparanase protein was detected by Western blot. Used blank control group for grey reference, relative grey value of each group was calculated for the further statistical analysis.Results50,100 mg/kg quercetin groups and group of PI - 88 made the volume of tumor tissues smaller. In 50 mg/kg quercetin group, swelling of VEC and mitochondria in tumor tissues was observed. In 100 mg/kg quercetin group, the disappearance of membraneaceous structures was found. In PI-88 positive group, the atresia of lumen, vacuole-shaped smooth endoplasmic reticulum and a dead cell were observed. 50 and 100 mg/kg quercetin groups decreased the heparanase protein levels significantly(P<0.05). Furthermore, PI-88 positive group could decrease the heparanase protein levels significantly(P<0.05), compared to 50 and 100 mg/kg quercetin groups. However, the difference between the 25 mg/kg quercetin group and blank control group showed no statistical significance.ConclusionThe growth of cervical cancer could be inhibited by 50,100 mg/kg quercetin. Meanwhile, the ultrastructural changes of tumor endothelial cells could be induced by 50,100 mg/kg quercetin. These changes may relate with the decrease of heparanase protein level.
quercetin; heparanase;cervical cancer
魏玮,通信作者,男,硕士,讲师,药师,研究方向:药学,E-mail:ww27w@sina.com。
R737.33
A
1005-1678(2015)11-0026-05

