黄芪多糖抑制糖原合成酶激酶3β活性与核转位及其调控糖稳态的作用研究
徐俊,张思敏Δ,薛军,张万里,郭建荣
(1.武汉市儿童医院 重症医学科,湖北 武汉 430016;2.华中科技大学同济医学院附属协和医院 肿瘤中心,湖北 武汉 430023)
黄芪多糖抑制糖原合成酶激酶3β活性与核转位及其调控糖稳态的作用研究
徐俊1,张思敏1Δ,薛军2,张万里2,郭建荣2
(1.武汉市儿童医院 重症医学科,湖北 武汉 430016;2.华中科技大学同济医学院附属协和医院 肿瘤中心,湖北 武汉 430023)
目的 观察黄芪多糖(astragalus polysaccharide,APS)对糖稳态的调节作用,研究糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK3β)活性及其亚细胞定位(核转位)情况。方法 体外培养HepG2人肝癌细胞,用不同浓度高糖(30、40 mM)诱导肝细胞内质网应激模型,选择最佳工作糖浓度,用不同浓度的APS(50、100、200、400 μg/mL)处理肝细胞以选择最大有效浓度。按照不同处理方法将细胞分为:阴性对照组(C)、阳性对照组(Tm)、30 mM高糖诱导组(G30)、45 mM高糖诱导组(G45)、阴性对照+APS处理组 (CA)、阳性对照+APS处理组(TA)与高糖应激+APS处理组(GA),共7组。采用MTT法检测不同浓度APS对HepG2细胞增殖的影响,实时定量PCR反应检测HepG2细胞内XBPl mRNA的剪切水平与转录水平,免疫印迹技术检测组胞浆和胞核内GSK3β磷酸化水平。结果 选择30 mM高糖作为工作糖浓度,APS最大有效浓度200 μg/mL,对细胞进行干预处理。GA组细胞内质网应激细胞XBP1的转录和剪切水平均显著低于G30组(P<0.05),但TA组与Tm组XBP1的转录和剪切水平差异无统计学意义。与G30组比较,GA组胞浆和胞核内GSK3β磷酸化水平均显著增加(P<0.05),但TA组与Tm组组胞浆和胞核内GSK3β无显著性变化。结论 APS能显著改善肝脏脂肪变性,其机理与APS减少肝脏GSK3β的活性特别是核定位并减轻肝脏内质网应激有关。
黄芪多糖;糖原合成酶激酶3β;内质网应激;HepG2细胞;糖稳态
黄芪是目前临床常用的中药材,新近的研究表明黄芪中的提取物黄芪多糖(astragalus polysaccharide,APS)具有降糖及抗癌等作用[1],但目前APS对肝癌的抑制作用尚无相关研究且具体作用机制研究也较少[2-4]。本研究对体外HepG2人肝癌细胞给予不同处理方式,研究APS 对于糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK3β)活性和亚细胞定位的影响,并进一步探讨了GSK3 的活性和核转位增强与高糖诱导的内质网应激共同存在的可能性,及不同浓度APS对高糖的调控及其作用机制,现报道如下。
1 材料与方法
1.1 试剂与仪器 黄芪(北京同仁堂饮片责任有限公司,产品批号皖Y20050032)自制黄芪多糖,制备方法参照赵鲁杭的提取方法[5]中水煎提取工艺的改良法与SephadexG-150柱层相配合提取,多糖含量测定参考文献[6]的方法,细胞培养前使用0.22 μm无菌滤器过滤。
HepG2人肝癌细胞购自中国科学院典型培养物细胞库,葡萄糖、DMSO、衣霉素(tunicamycin)(美国Sigma),普通高糖、低糖和液体无糖DMEM培养基、胎牛血清(美国Invitrogen-GIBCO),PCR引物(上海生工生物工程技术服务公司合成)。
1.2 方法
1.2.1 HepG2人肝癌细胞培养:取HepG2人肝癌细胞接种于24孔板内DMEM完全培养基),培养基为含3%标准胎牛血清(FBS)的DMEM培养基,每孔1 mL,培养条件为37 ℃、5%CO2培养箱。待细胞长满后继续培养48 h,进行后续试验。
1.2.2 建立高糖诱导的肝细胞内质网应激模型:将对数期生长期的细胞接种到含3%标准胎牛血清(FBS)的DMEM培养基中:30 mM高浓度葡萄糖[G30,30 mM高糖+]及45 mM高浓度葡萄糖[G45,45 mM 高糖+含3% FBS的DMEM培养基)],同时设置阴性对照组[C,25 mM标准高糖+含3% FBS的 DMEM 培养基],各组置37 ℃、5%CO2条件下分别培养5 h及阳性对照组衣霉素[Tm,10 μg/mL tunicamycin+含3% FBS的 DMEM培养基]置37 ℃、5%CO2条件下4 h处理细胞16 h,每组设置6个复孔。通过检测内质网中X 盒结合蛋白l(X-box binding protein 1,XBP1)表达量评价高糖诱导内质网应激模型。
1.2.3 APS对内质网应激的肝细胞模型的影响:选取30 mM高糖诱导肝细胞内质网应激模型作为研究对象,分别加入不同浓度的APS(50、100、200与400 μg/mL),将细胞按5000~10000个/孔接种到96孔板中,每组设置6个复孔,置于37 ℃ 5%CO2条件下常规培养24 h后,弃上清。MTT法检测APS对细胞增殖的影响:加入5 mg/mL MTT(用pH7.4PBS配制)20 μL/孔,再置37 ℃ 5%C02条件下4 h,弃去上清液,加入DMSO 200 μL/孔,混匀30 min后,在酶联检测仪(美国Bio Tek公司,型号ELx808)上570 nm波长处测吸光度值,计算各处理因素对肝细胞生长的影响,寻找对细胞不造成损伤的情况下APS的最佳浓度。
1.2.4 肝细胞核酸的提取及实时定量PCR反应:采用Trizol法提取肝细胞RNA,引物设计,按照一步法RT-PCR反应试剂盒要求稍作改动进行操作。RT-PCR反应体系为50 μL。具体组成如下:AWV/Tfi 5x反应缓冲液10 μL;引物(上游及下游)5 μL;25 mM MgS042 μL,dNTP混合物(每种dNTP 10 mM)1 μL,Tfi DNA 聚合酶(5 U/μL)1 μL;RNA样品10 μL;AWY 反转录酶(5 U/μL)1μL;无核酸酶水12 μL。RT-PCR实验步骤:将反应体系混匀→48 ℃反转录45 min→94 ℃灭活AWV活性后,引物变性2 min→循环开始(94 ℃变性30 s、退火1 min、68 ℃延伸2 min)40个循环,>68 ℃最终延伸7 min→4 ℃保存。200 μg/mLAPS对30 mM高糖处理后HepG2细胞内XBPlmRNA剪切水平(PstⅠ消化法)与XBPlmRNA转录水平的影响。
1.2.5 肝细胞核浆蛋白的提取及免疫印迹技术:细胞用PBS换液,在冰上加裂解液裂解,离心取蛋白沉淀,Lowry法测蛋白浓度。取20 μg蛋白于10%SDS-PAGE分离后,转移至硝酸纤维素膜。然后5%脱脂奶粉封闭硝酸纤维素膜lh,洗膜后加入兔抗人GSK3β一抗(购自Santa Cruze公司)(1:1000),4 ℃反应过夜,次日洗膜后,加入1:2500辣根过氧化物酶标记的二抗,室温孵育1 h,加入ECL显色剂,X片显影用QualityOne图象分析软件(Bio-Rad公司),根据光密度定量分析。200 μg/mLAPS对30 mM高糖处理后HepG2细胞胞浆及细胞核内GSK3的磷酸化表达检测,选择β-actin为内对照。
1.3 实验分组与处理
① 阴性对照组(C):3%标准胎牛血清(FBS)的标准高糖 (25 mM) DMEM 培养基作用5 h作为内质网应激阴性对照细胞;②阳性对照组(Tm): 使用衣霉素(tunicamycin,10 μg/mL)处理细胞16 h作为内质网应激阳性对照细胞;③30 mM 高糖诱导组(G30):3% FBS的30 mM 高糖DMEM培养液,作用5 h;④45 mM高糖诱导组(G45):3% FBS的45 mM 高糖 DMEM培养液,作用5 h;⑤阴性对照+APS 处理组 (CA):含200 μg/mLAPS 3%FBS的标准高糖 (25 mM)DMEM 培养基作用24 h;⑥阳性对照+APS 处理组(TA):含200 μg/mLAPS 3%FBS的标准高糖 (25 mM)DMEM 培养基预处理24 h,更换培养基并加入tunicamycin(10 μg/mL)继续处理细胞16 h;⑦高糖应激+APS处理组(GA):含200 μg/mLAPS 3%FBS 的高糖 (30mM)DMEM培养基预处理24 h,换高糖培养基继续处理细胞5 h。
1.4 统计学方法 采用SPSS 17.0统计学软件进行实验数据分析,正态计量资料组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 高糖处理建立HepG2 内质网应激细胞模型
2.1.1 不同浓度高糖对HepG2细胞内XBPlmRNA的剪切水平与转录水平的影响:与阴性对照组(C)比较,30 mM和45 mM高糖处理细胞5 h,XBP1的转录和剪切水平显著升高(P<0.05),尤其30 mM 高糖诱导组(G30)XBP1的转录和剪切水平显著升高(P<0.05),其作用与衣霉素处理组接近(见图1、图2)。后续试验选择30 mM高糖作为工作糖浓度进一步研究APS的作用。

图1 不同浓度高糖对HepG2细胞内XBPlmRNA的剪切水平的影响(PstⅠ消化法,n=6)*P<0.05,与C组比较;#P<0.05,与G45组比较Fig.1 Effect of different concentrations of high glucose on shear levels of XBPlmRNA in HepG2 cells (Pst I digestion,n=6)*P<0.05,compared with group C;#P<0.05,compared with group G45

图2 不同浓度高糖对HepG2细胞内XBPlmRNA转录水平的影响(n=6)*P<0.05,与C组比较;#P<0.05,与G45组比较Fig.2 Effect of different concentrations of high glucose on transcription levels of XBPlmRNA in HepG2 cells(n=6)*P<0.05,compared with group C;#P<0.05,compared with group G45
2.1.2 不同浓度高糖对HepG2胞浆及细胞核内GSK3β的活性和核定位的影响:与阴性对照组(C)比较,30 mM高糖诱导组(G30)和45 mM高糖诱导组(G45),胞浆内GSK3β的磷酸化表达增强及核内定位增强 (P<0.05),尤其G30组GSK3β的磷酸化表达及核内定位增强最明显(P<0.05),其作用与衣霉素处理组接近(见图3)。

图3 不同浓度高糖对HepG2细胞胞浆及细胞核内GSK3β的磷酸化表达影响(n=6)*P<0.05,与C组比较;#P<0.05,与G45组比较Fig.3 Effect of different concentrations of high glucose on GSK3β phosphorylation expression in cytoplasm and nucleus of HepG2 cells(n=6)*P<0.05,compared with group C;#P<0.05,compared with group G45
2.2 不同浓度APS对HepG2细胞增殖的影响 MTT实验结果提示,APS 在50~200 μg/mL范围内无明显细胞毒性和促进细胞增殖作用,而400 μg/mL 的APS轻度抑制细胞生长。因此后续试验选择最大有效浓度200 μg/mL对细胞进行干预处理。见图4。
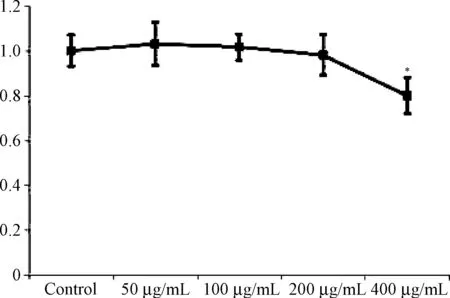
图4 不同浓度APS对HepG2细胞增殖的影响(MTT法,n=6)*P<0.05,与对照组相比Fig.4 Effect of different concentrations of APS on the proliferation of HepG2 cells (MTT,n=6)*P<0.05,compared with group C
2.3 200 μg/mL APS对高糖处理HepG2 细胞内质网应激反应的影响
2.3.1 200 μg/mL APS对HepG2细胞内XBPlmRNA剪切水平与转录水平的影响:与C组相比,CA组细胞内质网应激反应标志物XBP1的转录和剪切水平无显著变化。GA组细胞内质网应激细胞XBP1的转录和剪切水平显著低于30 mM高糖诱导组(G30)(P<0.05),但TA组与Tm组XBP1的转录和剪切水平差异无统计学意义,即APS对Tm 组的内质网应激无显著影响(见图5、6)。

图5 200 μg/mL APS对30 mM高糖处理后HepG2细胞内XBPlmRNA的剪切水平的影响(n=6)*P<0.05,与C组比较;△P<0.05,与GA组比较Fig.5 Effect of 200 μg/mL APS on shear levels of XBPlmRNA in HepG2 cells after high glucose treatment of 30mM(n=6)*P<0.05,compared with group C;△P<0.05,compared with group GA

图6 200 μg/mL APS对30 mM高糖处理后HepG2细胞内XBPlmRNA的转录水平的影响(n=6)*P<0.05,与C组比较;△P<0.05,与GA组比较Fig.6 Effect of 200 μg/mL APS on transcription levels of XBPlmRNA in HepG2 cells after high glucose treatment of 30mM(n=6)*P<0.05,compared with group C;△P<0.05,compared with group GA
2.3.2 200 μg/mL APS对高糖处理HepG2细胞胞浆及核内GSK3β 表达的影响:与G30组比较,GA组胞浆和胞核内GSK3β9 位丝氨酸磷酸化水平显著增加(P<0.05),从而抑制GSK3β活性。但与Tm组比较,TA组胞浆和胞核内GSK3β无显著性变化,见图7。

图7 200 μg/mL APS对30 mM浓度高糖处理后HepG2细胞胞浆及核内GSK3β 表达的影响(n=3)*P<0.05,与C组比较;△P<0.05,与GA组比较Fig.7 Effect of 200 μg/mL APS on GSK3β phosphorylation expression of in cytoplasm and nucleus of HepG2 cells after high glucose treatment of 30 mM(n=3)*P<0.05,compared with group C;#P<0.05,compared with group GA
3 讨论
黄芪在我国的药用迄今已有2000多年的历史,传统中医理论认为其具有增强机体免疫功能、保肝、利尿、抗衰老、抗应激、降压和较广泛的抗菌作用[6],但表实邪盛,气滞湿阻,食积停滞,痈疽初起或溃后热毒尚盛等实证,阴虚阳亢者均须禁服。随着现代医药科技的发展及体外实验研究,黄芪中的药用成分包括黄芪多糖及黄芪皂苷等对肿瘤具有抑制作用,在临床应用中联合化疗药物等治疗肿瘤可显著提高疗效并改善患者预后,但其具体作用机制尚无明确报道[7-8]。臧文华等[9]构建人肝癌裸鼠原位移植瘤模型,同时给予黄芪-莪术配伍以及联合顺铂处理,发现黄芪-莪术配伍对人肝癌裸鼠原位移植瘤的生长有抑制作用,且抑制作用与剂量有一定的正相关性,其机制可能与对HIF-1α、VEGF表达的抑制有关,与顺铂合用表现为协同增效和相加作用。陈卓等[10]研究发现黄芪多糖可显著提高非小细胞肺癌患者放疗后T细胞亚群,认为黄芪多糖通过提高机体免疫力而增强非小细胞肺癌三维适形放射治疗疗效。基于这些证据,目前临床工作中黄芪包括APS在内的提取物治疗恶性肿瘤的应用越来越广泛,故纯化其中抗肿瘤成分并阐明具体抗肿瘤机制对黄芪多糖的进一步应用具有重要意义。
为了明确高糖是否作为独立的危险因素引起肝脏内质网应激,本研究使用不同浓度高糖诱导细胞发生内质网应激反应。结果发现,30 mM高糖可作为体外工作浓度诱导HepG2细胞出现明显内质网应激,其作用程度与衣霉素相似。在使用APS预处理细胞24 h后,肝细胞内质网应激反应明显减轻,APS治疗组肝细胞XBP1的转录和剪切减少(均P<0.05)。
本研究结果显示,与G组比较,GA组胞浆和胞核内GSK3β磷酸化水平显著增加(P<0.05)。推测GSK3β的活性和核定位改变是为了适应体内代谢需要的改变,特别是当内质网对体内未折叠蛋白的处理不足时,GSK3β作为下游信号激酶参与调节细胞调亡、下调蛋白的合成以满足能量代谢的需要。但是GSK3β活化的同时抑制胰岛素信号转导,加重糖代谢紊乱的发生,这可能是GSK3β所介导的体内一种代偿到失代偿的过程。关于内质网应激时GSK3β活性和核转位增强的具体机理还有待于进一步研究。基于本研究的发现,推测APS抑制肝癌细胞增殖可能与其抑制GSK3β蛋白质表达而降低其活性有关,这对阐明APS抑制肿瘤的作用机制具有重要价值。胰岛素抵抗时肝脏GSK3β活性和核转位增强伴随肝脏内质网应激反应增强。而高糖作为独立的诱导因素在体外不仅可引起肝细胞发生内质网应激反应,同时本实验也证实GSK3β 活性和核转位随内质网应激反应的活化而增强。
综上所述,肝细胞内质网应激反应促进高糖情况下肝脏GSK3β的活性及核转位。经过APS处理后,内质网应激的减轻也伴随着GSK3β 活性和核转位的抑制。本研究结果表明:APS 抑制GSK3β 的活性及核转位在糖稳态的调节中意义重大,而其活性和核转位的调节与内质网应激的激活有关,2者在作用上的交叉和协同是引起高糖毒性的关键。
[1] 张丽敏,贺永贵,伊红丽,等.黄芪甲苷药理作用研究进展[J].河北联合大学学报(医学版),2014,16(2):160-162.
[2] 张敬芳,吴勇,欧阳静萍,等.黄芪多糖降糖作用及其对蛋白激酶B和葡萄糖转运蛋白4的影响[J].中华内分泌代谢杂志,2008,24(5):546-547.
[3] 刘毅,李志樑,江腾春,等.黄芪多糖对2型糖尿病患者外周血内皮祖细胞数量和功能的影响[J].中国医药导报,2014,11(34):8-10,14,封3.
[4] 邓毅,尹龙萍,赵爱华,等.黄芪多糖铬络合物的合成及其降血糖活性的初步研究[J].食品科学,2007,28(6):317-320.
[5] 赵鲁杭.黄芪多糖的制备及其对巨噬细胞和树突状细胞免疫功能的影响[D].浙江大学,2011.
[6] 史静超,王永辉,樊思聪,等.HPLC-ELSD法测定黄芪中黄芪皂苷Ⅲ、黄芪皂苷Ⅳ的含量[J].世界中西医结合杂志,2014(7):720-722.
[7] Guo L,Bai SP,Zhao L,et al.Astragalus polysaccharide injection integrated with vinorelbine and cisplatin for patients with advanced non-small cell lung cancer: effects on quality of life and survival[J].Medical oncology,2012,29(3):1656-1662.
[8] 朱建楠,朱艳.黄芪用于阻断宫颈癌前病变机制的研究[J].中国全科医学,2014(13):1562-1564.
[9] 臧文华,唐德才,尹刚,等.黄芪-莪术配伍及联合顺铂对人肝癌裸鼠原位移植瘤生长的抑制作用[J].中国实验方剂学杂志,2014,20(5):131-136.
(编校:王俨俨)
Antagonism of astragalus polysaccharide on activity and nuclear translocation of glycogen synthase kinase 3β involved in regulation of glucose homeostasis
XU Jun1, ZHANG Si-min1Δ, XUE Jun2, ZHANG Wan-li2, GUO Jian-rong2
(1.Department of Severe Medicine, The Children’s Hospital of Wuhan City, Wuhan 430016, China; 2.Cancer Center, Union Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430023, China)
ObjectiveTo observe the effect of astragalus polysaccharides (APS) on glucose homeostasis regulation and focus on glycogen synthase kinase 3 beta (GSK3 beta) activity and subcellular localization (nuclear translocation).MethodsHepG2 human hepatoma cells were cultured in vitro and treated with high glucose of different concentrations (30, 40 mM) to induce hepatocyte endoplasmic reticulum stress model, then acquire optimum operating concentration.The HepG2 cells were treated with APS of different concentrations (50, 100, 200, 400 μg/mL) to select the most effective concentration.The HepG2 cells were divided into seven groups with different treatment: negative control group (C), positive control group (Tm), 30 mM high glucose-induced group (G30), 45 mM high glucose-induced group (G45), negative control+APS group (CA), positive control+APS group (TA) and high glucose-induced+APS group (GA).Effect of APS at different concentrations on proliferation activity of HepG2 cells were detected by MTT assay, transcription and shear levels of XBPlmRNA in HepG2 cells by quantitative real-time PCR, and phosphorylation levels of GSK3β in cytoplasm and nucleus by immunoblotting techniques.ResultsThe optimum operating glucose concentration was 30 mM.The most effective APS concentration was 200 μg/mL.The transcription and shear levels of XBPlmRNA in HepG2 cells of GA group were lower than those of G30group (P<0.05), respectively, but there were no significant differences between TA and Tm group.The phosphorylation levels of GSK3β in cytoplasm and nucleus of GA group were higher than those of G group(P<0.05), respectively, but there were no significant differences between TA and Tm group.ConclusionAPS could improve hepatic steatosis, and its mechanism might be that APS inhibits the activity and nuclear localization of GSK3β, then alleviate endoplasmic reticulum stress.
astragalus polysaccharide; glycogen synthase kinase 3β; endoplasmic reticulum stress; HepG2 cells;glucose homeostasis
湖北省自然科学基金面上项目(2012FFB02423)
徐俊,男,本科,副主任医师,研究方向:儿童重症疾病诊断与治疗,E-mail:xj18571518088@163.com;张思敏,通讯作者,男,本科,住院医师,研究方向:儿科重症疾病诊断与治疗,E-mail:1468578028@qq.com。
Q591.4
A
1005-1678(2015)06-0035-05

