UV-Fenton法预处理某制药厂废水的实验研究
陈 琳,张争民
(1.宿州职业技术学院,安徽 宿州 234101;2.中国人民解放军装甲兵学院门诊部,安徽 蚌埠 233000)
我国是药品生产和消费大国,医药行业也是污染较重的行业之一,制药废水年排放量可达2 000~3 000万吨[1].制药废水是一种相对较难处理的工业有机废水,按照生产工艺的不同,一般分为生物合成制药废水、化学合成制药废水、植物提取类药物的制药废水和发酵化学合成制药废水4类.制药废水所含有的污染物主要包括硝基类化合物、苯类有机物以及一些有机溶剂等[2].
现阶段,对高浓度有机废水的处理有化学、物化生化等多种方法,其中生化处理因其成本较低,处理效果好而被广泛采用[3-4].但是制药废水往往B/C值较低、成分复杂且存在一些生物毒性物质,可生化性能较差,处理效果并不理想.因此,如何选择一种合适的预处理手段成为制药废水处理需要解决的问题.研究表明,利用高级氧化技术预处理高浓度难降解有机废水,可以提高其可生化性,降低生物处理难度[5].其中Fenton 氧化法处理高浓度有机废水,能够有效降解废水中有机物,具有显著的脱色效果,且Fenton氧化处理构筑物简单、易操作,因此在实践中应用较多[6].但Fenton氧化处理废水往往需要消耗大量的酸、氧化剂、铁盐等,提高反应成本且增加二次污染的风险.因此,本次实验以某制药厂有机废水为研究对象,在利用Fenton反应处理制药废水的基础上,进一步分析Fenton反应的改良方法(UV-Fenton反应)对该制药废水的处理效果,并进行对比.
1 实验材料及方法
1.1 实验材料
实验所用水样采自某药业有限公司废水处理站的综合废水,废水外观呈浅棕色,具有强烈的刺激性气味,是一种稳定的胶体分散体系,静置后难以澄清.样品取回后取部分水样测定基本理化性质,结果如表1所示.其余水样用于模拟实验.

表1 实验用水理化性质
1.2 实验装置
实验所用反应器为图1所示有机玻璃杯,反应器内径12 cm,高15 cm,在距反应器底7 cm处设置取样口,以直径1 cm的有机玻璃管做导管进行取样,以30 w低压汞灯作为实验用紫外光光源.
1.3 实验方法
(1)H2O2理论投加量.
理论上,废水的CODCr值与所需氧化剂的量相当,Fenton 反应中的氧化剂是H2O2,反应最终分解为H2O和O2,1 mol 的H2O2可以提供0.5 mol 的氧,因此,根据公式(1)求得每升废水需投加H2O2的浓度为0.318 mol/L.

式中:V为H2O2投加量,M为物质的量.
(2)Fenton氧化实验.
取500 mL 水样置于1 L 烧杯中,用1 mol/L H2SO4溶液或1 mol/L NaOH 溶液调节水样,至实验所需pH值,置于搅拌器上,快速加入定量的FeSO4·7H2O和H2O2溶液并开始计时,以120 r/min快速搅拌2 min,之后以50 r/min慢速搅拌反应,反应结束后以1 mol/LNaOH溶液调节水样至pH 8.0,继续慢速搅拌10 min后静置测定上清液CODcr及BOD5.确定FeSO4·7H2O和H2O2的最佳配比.
(3)UV-Fenton氧化实验.
取1 L 水样置于图1所示反应器中,用1 mol/L H2SO4溶液或1 mol/L NaOH 溶液调节水样,至实验所需pH 值.快速加入定量的FeSO4·7H2O和H2O2溶液,打开紫外光光源,以120 r/min快速搅拌2 min,之后以50 r/min慢速搅拌反应至规定时间,反应结束后以1 mol/L NaOH 溶液调节水样至pH 8.0,继续慢速搅拌10 min后静置测定上清液CODcr及BOD5.
图1 实验装置
1.4 样品测试
CODCr测试采用重铬酸钾法(GB/T 11914-1989),BOD5测试采用稀释与接种法(HJ 505-2009),pH测定采用玻璃电极法(GB/T 6920-1986).
2 结果与分析
2.1 Fenton氧化处理制药废水实验结果
研究表明,Fenton反应主要受试剂投加量、反应初始pH、反应温度和反应时间等的影响[7].由于工程实际应用中主要考虑试剂投加量和反应时间的因素,因此,研究考察FeSO4·7H2O投加量、H2O2投加量、初始pH及反应时间对制药废水CODCr去除的影响.
2.1.1 FeSO4·7H2O投加量对制药废水处理的影响
在Fenton反应中,FeSO4·7H2O起到一种催化剂的作用,但其投加量对CODCr去除具有重要的影响.研究确定实验条件为:H2O2投加量为0.318 mol/L,反应时间3 h,反应温度25 ℃,初始pH4.3(原水pH),不同FeSO4·7H2O投加量下制药废水CODCr去除率的变化规律如图2所示.
从 FeSO4·7H2O 投加量对 CODCr去除效果的影响可以看出,实验初期,CODCr去除率与FeSO4·7H2O 投加量呈正相关.但是,随着FeSO4·7H2O投加量的不断增加,CODCr去除率的变化率降低,当FeSO4·7H2O投加量为0.036 mol/L时,CODCr的去除率达到最大,为40.3%,继续增大投加量,CODCr的去除率下降.主要由于Fe2+在Fenton反应中仅仅起到催化的作用,在H2O2投加量不变的条件下,单纯增加Fe2+的量仅能在一定程度上提高反应效率,当超过二者的适当比例,Fe2+对反应的影响减弱,CODCr的去除率开始受氧化剂H2O2浓度的影响.从实验结果可以看出,持续增大FeSO4·7H2O投加量,CODCr去除率反而减小,可能由于过量的铁盐导致后期混凝絮体形成速率减慢,沉降效果变差,出水CODCr增加[8].
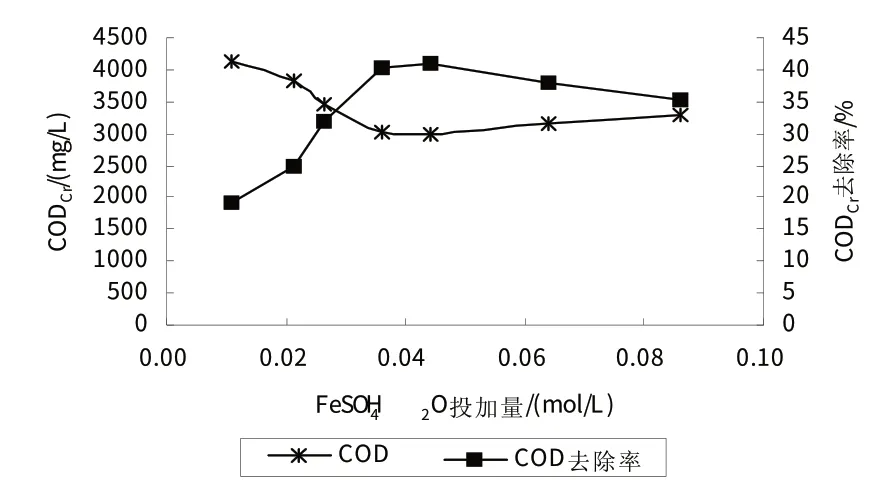
图2 FeSO4·7H2O投加量对CODCr去除效果的影响
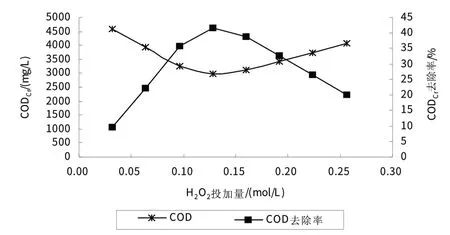
图3 H2O2投加量对CODCr去除效果的影响
2.1.2 H2O2投加量对制药废水处理的影响
根据FeSO4·7H2O投加量实验结果,选定FeSO4·7H2O投加量为0.036 mol/L,其余实验条件不变.
如图3所示,从H2O2投加量对CODCr去除效果的影响可以看出,在确定FeSO4·7H2O 投加量为0.036 mol/L 的条件下,H2O2投加量为0.128 mol/L 时处理效果最好,CODCr去除率可达41.7%,之后,出水CODCr去除率逐渐降低,主要是由于H2O2在强氧化剂存在的条件下,可以被还原,在测试中表现为CODCr的增加,当H2O2投加量超过一定范围之后,反应体系中剩余H2O2过多,使得水中CODCr增加,去除率降低.
2.1.3 实验初始pH对制药废水处理的影响
实验条件及初始pH的设定如表4所示.
理论上,酸性条件对H2O2的分解有一定的促进作用,从而为反应体系提供更多的·OH,促进水中CODCr的去除.从图4所示实验初始pH对制药废水的处理效果可以看出,随着初始pH的降低,水中CODCr的去除率逐渐升高,最高去除率达45.5%.之后继续降低pH,对CODCr值的影响不明显,甚至升高.其原因可能由于酸性环境抑制Fe3+的还原,从而对反应起到一定的抑制作用;再者,在pH过低的环境中,Fe2+易发生水合形成[Fe(H2O)]2+,[Fe(H2O)]2+与体系中H2O2反应生成·OH的速度相对Fe2+较低,影响反应出水水质[9].

图4 实验初始pH对CODCr去除效果的影响
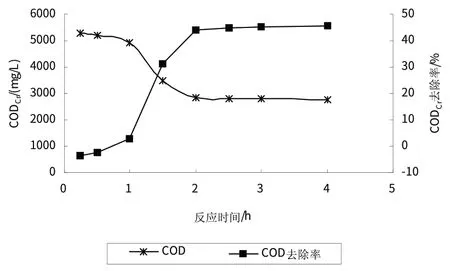
图5 Fenton反应时间对CODCr去除效果的影响
2.1.4 反应时间对制药废水处理的影响
为了研究反应时间对制药废水处理的影响,研究共设计了7 个时间梯度,分别为0.25 h、0.5 h、1 h、1.5 h、2 h、2.5 h、3 h、4 h,其余实验条件如表5所示.
从图5可以看出,随着反应时间的变化,溶液CODCr呈先增加后减小的趋势.反应前0.5 h内,溶液中CODCr上升,1 h后开始迅速下降,到2 h后趋于稳定.反应初期,CODCr的上升主要由于·OH将污水中部分大分子难降解有机物转化为易于重铬酸钾氧化的小分子有机物,使出水测得的值CODCr值大于进水.之后,随着反应的持续进行,Fenton试剂对污水中有机物氧化分解,出水CODCr值迅速降低.
通过考察不同条件下的处理结果,确定Fenton氧化对制药废水处理的最佳条件为:FeSO4·7H2O投加0.036 mol/L,H2O2投加0.128 mol/L,初始pH 4.3,反应时间为2 h.
2.2 UV-Fenton法处理制药废水实验结果
2.2.1 UV处理时间的影响
在Fenton反应的最佳条件下,设置UV处理时间分别为1 min、3 min、5 min、7 min、10 min、12 min,研究UV处理时间对出水CODCr的影响,结果如图6所示.可以看出,当UV处理时间小于7 min时,随着UV处理时间的增加,CODCr去除率迅速提高.主要由于在UV-Fenton体系中,Fe3+可以在紫外线的照射下经光敏反应形成·OH和Fe2+,此外,H2O2中的O-O键在紫外光的照射下也可能发生断裂,形成·OH,系统中UV和Fe2+的协同作用,促进反应体系中·OH的产生速率,提高处理效率[10-11].
当UV处理时间大于7 min时,受体系中H2O2含量和紫外光强的影响,继续增加UV处理时间对CODCr去除率的提高影响不大,且时间的增加会增加处理成本,因此确定实验条件下UV 处理的最佳时间为7 min.
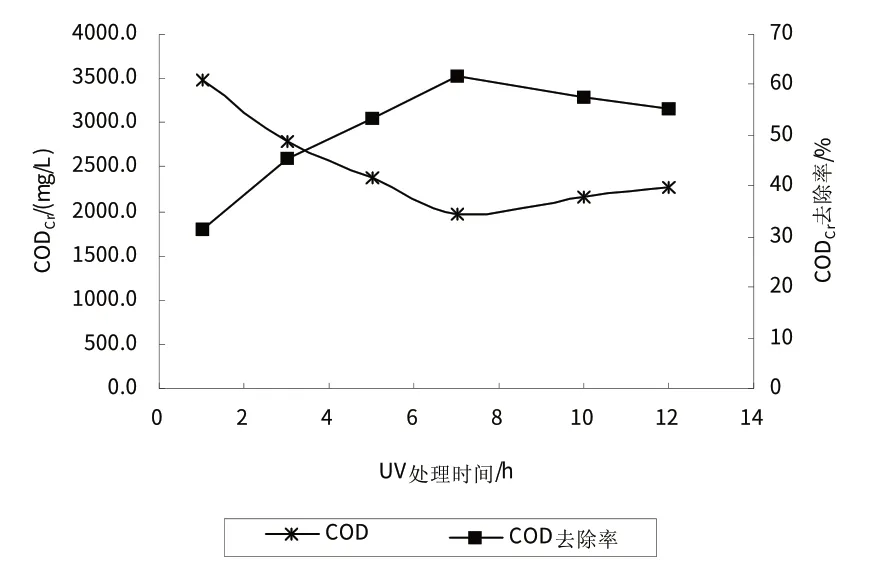
图6 UV处理时间对CODCr去除效果的影响
2.2.2 UV处理对Fenton反应时间的影响
在最佳处理条件下研究不同反应时间出水水质的变化,从图7可以看出利用UV-Fenton反应处理制药废水,与Fenton 反应处理制药废水相同,溶液CODCr随着反应时间呈先增加后减小的趋势,但反应75 min后,废水CODCr趋于稳定,CODCr去除率达60.3%.主要由于UV促进反应体系中·OH的产生速率和产生量,提高CODCr的去除效率,因此,与单独使用Fenton反应处理制药废水相比,反应时间缩短.
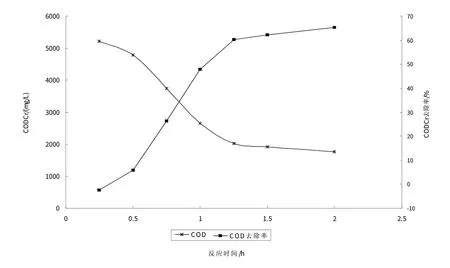
图7 UV处理对Fenton反应时间的影响
2.2.3 UV处理对Fenton试剂使用量的影响
由于UV促进Fenton反应中·OH的产生,因此,在同样的处理效果下,一定程度上可以减少Fenton试剂的使用量,从而降低处理成本.实验在不改变FeSO4·7H2O和H2O2比例的条件下减少Fenton试剂的使用量,处理结果如图8所示.由图8可以看出,当 FeSO4·7H2O和H2O2的使用量分别为 0.029 mol/L和0.102 mol/L 时,CODCr去除率为63.5%,达到最佳,之后继续增加Fenton 试剂的使用量对出水水质影响并不明显.

图8 UV处理对试剂使用量的影响
因此,利用UV-Fenton反应可以有效地处理某药业有限公司综合废水,最佳处理条件:UV处理时间为7 min,FeSO4·7H2O投加0.029 mol/L,H2O2投加0.102 mol/L,初始pH4.3,反应时间为75 min.
2.3 Fenton反应及UV-Fenton反应对制药废水处理效果分析
如表2所示,对比Fenton反应及UV-Fenton反应在最佳条件下对制药废水的处理效果可以看出,UVFenton反应处理制药废水出水水质优于单独使用Fenton反应的处理效果:前者CODCr去除率为63.5%,比Fenton法高出约20%;UV-Fenton反应出水B/C为0.39,介于0.3~0.45之间,可以进行生化处理[12].

表2 Fenton反应及UV-Fenton反应对制药废水处理效果
Fenton 反应主要是通过Fenton 体系中Fe2+在酸性条件下促进H2O2生成·OH,自身被氧化成Fe3+,利用·OH的强氧化性对水中有机物进行氧化分解,之后Fe3+在H2O2存在的条件下被还原成Fe2+[13].而在UVFenton体系中,反应形成的Fe3+可以在紫外线的照射下形成·OH和Fe2+,从而加快·OH的产生量和形成速率[11].因此,紫外光的照射有效提高有机废水中高分子有机物转化和小分子有机物分解的速率,从而促进Fenton反应的进行,减少Fenton试剂的使用量,降低工艺运行成本.
3 结论
以某制药有限公司综合排放废水为对象,分别采用Fenton和UV-Fenton法对制药废水进行处理.研究表明,Fenton 反应处理制药废水的最佳条件为:FeSO4·7H2O 投加0.036 mol/L,H2O2投加0.128 mol/L,初始pH4.3,反应时间为2 h,CODCr去除率为43.9%.UV-Fenton 反应处理制药废水,最佳处理条件为:UV处理时间为7 min,FeSO4·7H2O 投加0.029 mol/L,H2O2投加0.102 mol/L,初始pH4.3,反应时间为75 min,CODCr去除率为63.5%,优于Fenton 法.与Fenton 反应相比UV-Fenton 反应缩短反应时间,减少试剂投加量,有效地降低工艺运行成本,且污水B/C提高至0.39,更利于制药废水的后续生化处理.
[1]黄昱,李小明,杨麒.高级氧化技术在抗生素废水处理中的应用[J].工业水处理,2006,26(8):12-20.
[2]陆新元,毛应淮.排污收费概论[M].北京:中国环境科学出版社,2004.
[3]梁凯.生物处理技术在高浓度有机废水处理中的研究进展[J].工业水处理,2011(10):1-5.
[4]敬璇,李正山.高浓度有机废水处理技术研究进展[J].成都大学学报(自然科学版),2012(1):85-89.
[5]曹国民,盛梅,刘勇弟.高级氧化—生化组合工艺处理难降解有机废水的研究进展[J].化工环保,2010(1):1-7.
[6]马兴冠,温静,陈晨,等.高级氧化技术处理制药废水研究进展[J].水处理技术,2011(11):5-9.
[7]张国卿,王罗春,徐高田,等.Fenton试剂在处理难降解有机废水中的应用[J].工业安全与环保,2004(3):17-19.
[8]吴芳芳,胡家朋.采用UV-Fenton法的垃圾渗滤液处理[J].重庆理工大学学报(自然科学),2014(11):73-76.
[9]吴彦瑜.Fenton氧化和MAP化学沉淀工艺深度处理垃圾渗滤液[D].广州:华南理工大学,2011.
[10]彭延治,徐明芳,曾常军,等.UV-TiO2-Fenton 光催化降解敌百虫农药废水的研究[J].工业水处理,2006,26(6):33-36.
[11]FAUST B C,HOIGNE J.Photolysis of Fe(Ⅲ)-Hydroxy complexes as sources of oh radicals in clouds,fog and rain[J].Atmospheric Environment Part A-General Topics,1990,24(1):79- 89.
[12]上海环境保护局.废水生化处理[M].上海:同济大学出版社,1999.
[13]FRITZ H,JOSEPH W.The catalytic decomposition of hydrogen peroxide by iron salts[J].Proc R Soc,1934,134:332-351.

