L-α-甘油磷脂酰胆碱的制备研究进展
朱超,夏建才,朱丽
(云南开放大学化学工程学院,云南昆明 650500)
L-α-甘油磷脂酰胆碱的制备研究进展
朱超,夏建才,朱丽
(云南开放大学化学工程学院,云南昆明 650500)
L-α-甘油磷脂酰胆碱(L-α-glycerol phosphatidylcholine,L-α-GPC)是具有良好生物活性的小分子物质,在人和动物体内大量存在,参与中间代谢,发挥着至关重要的生理作用,是磷脂改性研究的一个重要组成部分。介绍并对比了L-α-GPC的各种制备方法,全合成法具有产物分离容易、纯度高的优势,但存在原料昂贵、药学性质不同等缺点;半合成法具有原料廉价易得、收率高的特点,成为当前研究的主流。
磷脂;L-α-甘油磷脂酰胆碱;制备
L-α-甘油磷脂酰胆碱(L-α-glycerol phosphatidylcholine,L-α-GPC)是具有良好生物活性的小分子物质,在人和动物细胞膜、脑部、血浆、肝脏等器官中大量存在,参与中间代谢,在人的神经、记忆、生殖等生理功能上发挥着重要作用,同时它还是一个重要的化学合成中间体[1-4]。其分子由一个非极性头(甘油)和一个极性头(磷脂酰胆碱)组成,因而具有两性特性,此外,分子内存在季胺碱正电荷和磷酸负电荷,为一个分子内盐,其结构式见图1。
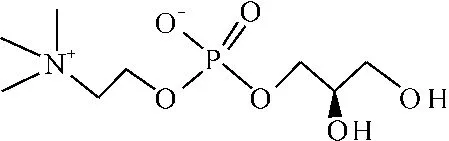
图1 L-α-GPC的结构式Fig.1 Structural formula of L-α-GPC
高纯度的L-α-GPC在常温常压下稳定,为具有黏性的无色透明液体,但久置在空气中易被氧化而颜色变深,国产的部分L-α-GPC因含有色素、非极性杂质而呈黄色,其储存条件一般为-20℃密封保存。低纯度的L-α-GPC药理作用弱,还可能产生毒素,我国的药用L-α-GPC主要靠进口,价格十分昂贵,1 g纯度大于95%的L-α-GPC的价格接近1 000美元[5]。所以,改进生产工艺以提高L-α-GPC的纯度和收率具有十分重要的意义。
1 全合成法制备L-α-GPC
L-α-GPC的全合成主要是以较纯的对映异构体,如(S)-2,2-二甲基-1,3-二氧-4-甲醇、(L)-甘油-3-磷酸、D-亚异丙基甘油等[6]为起始原料,经过几步缩合反应而得到。
Puricelli[7]用亚异丙基甘油与2-氯-2-氧-1,3,2-环氧磷戊烷为原料,经取代、缩合、水解、阳离子树脂提纯、乙醇重结晶得到L-α-GPC。得到的产物因起始原料的旋光性的不同而具有不同的旋光性。但是,2-氯-2-氧-1,3,2-环氧磷戊烷不稳定,其制备工艺复杂,环境污染大,难以应用于工业规模生产中。反应路线见图2。

图2 以亚异丙基甘油为起始原料的L-α-GPC制备方法Fig.2 Preparation method of L-α-GPC using isopropylideneglycerol as startingmaterial
随后,Puricelli[7]又以D-亚异丙基甘油对甲苯磺酸酯为起始原料,与磷酸胆碱四甲基铵盐反应,一步制备L-α-GPC。优点是中间体稳定易分离,且收率高达75%。缺点是起始原料成本较高。反应路线见图3。
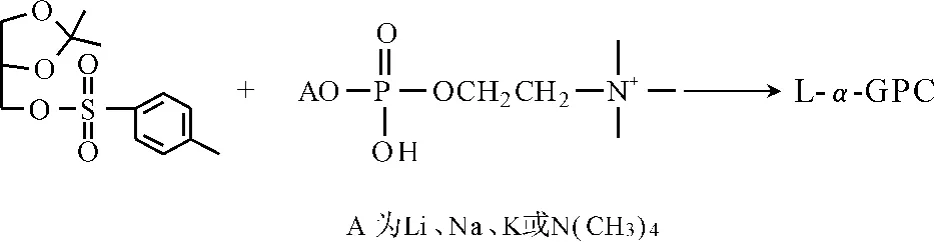
图3 以D-亚异丙基甘油对甲苯磺酸酯为原料的L-α-GPC制备方法Fig.3 Preparation method of L-α-GPC using D-isopropylideneglycidyl tosylate as startingmaterial
Song等[8]运用shapless环氧开环原理,以磷酸胆碱水合盐为起始原料,经酸解、缩合得到甘油磷酸胆碱盐晶体,再经离子交换树脂除去氯离子,得到L-α-GPC。该方法工艺简洁,起始原料便宜,交换树脂用量少,但原料不稳定,不易保存,且总收率低于50%。反应路线见图4。

图4 Song等的L-α-GPC制备方法Fig.4 Preparation m ethod of L-α-GPC by Song,et al.
Lee等[9]先用苄基对缩水甘油进行保护,经开环、酰化、氢化得到1,2-二乙酰甘油,再与三甲胺反应,最后水解得到L-α-GPC,收率58%,此反应路线长、收率不高,同时也存在三甲胺不易储存等问题。
陈新等[10]针对缩水甘油稳定性不高、难以纯化的缺陷,提出先将缩水甘油制备成稳定、易分离的缩水甘油对甲苯磺酸酯,再与磷酸胆碱四乙基铵盐反应,再纯化得到L-α-GPC,收率75.6%。反应路线见图5。

图5 陈新等的L-α-GPC制备方法Fig.5 Preparation method of L-α-GPC by Chen Xin,et al.
全合成法具有产物分离容易、纯度高的优势,但是存在反应起始原料需要纯对映异构体,价格昂贵,产物与天然产物的药理性质存在一定的差异,而且一些反应中间体制备、储存困难等缺点,所以应用上仍然受到很大限制。
2 半合成法制备L-α-GPC
半合成法制备L-α-GPC的方法是:先从自然界中提纯得到磷脂化合物,再对其进行脱酰反应制得。磷脂化合物的结构式见图6,当R3为磷脂酰胆碱(PC)时,如果只脱掉1位、2位脂肪酸,3位磷脂键保留,就可得到目标产物L-α-GPC。

图6 磷脂化合物的结构式Fig.6 Structural formula of phospholipids com pounds
2.1 磷脂酰胆碱(PC)的提纯
虽然磷脂广泛存在于自然界中,但从动物中提取磷脂的成本较高,且纯度较低;从植物中提取磷脂兼具纯度和成本的优势,而大豆磷脂是大豆油精炼时的副产品,且磷脂含量高,是研究得最多也是最为重要的磷脂来源。天然的大豆磷脂是混合物,除含有磷脂酰胆碱(PC)外,还含有磷脂酰乙醇胺(PE)、磷酯酰肌醇(PI)、磷脂酸(PA)、磷脂酰丝氨酸(PS)等磷脂组分。PC含量一般仅为20%~40%[11],且纯的PC价格十分昂贵,所以一般以磷脂的混合物作为原料。由于混合物中其它类型的磷脂也可以进行脱酰反应得到对应的单甘油磷脂酰化合物(分别为GPE、GPI、GPA、GPS),所以,为了减小反应后的分离压力,在进行脱酰反应前需要进行提纯。目前,国内外纯化PC的方法主要有:溶剂萃取法、柱层析法、超临界流体萃取法、膜分离法等[12]。
溶剂萃取法是提纯卵磷脂的常用方法,具有生产工艺简单、流程短、便于连续操作等优点。单一溶剂(如乙醇)的萃取效果不如混合溶剂,但混合溶剂回收较困难。经初步萃取的粗品可以利用金属离子处理,产品的PC含量在85%以上,但容易被金属离子污染。吸附柱层析法和离子交换柱层析法可以得到高纯度的PC,但是处理量小,洗涤溶剂用量大,蒸发溶剂能耗大,难以实现工业化。国外在超临界流体萃取法提纯磷脂方面做了大量工作[13]。此外,提纯磷脂的非常规方法还有酶催化精制法、酶预水解法、高压脉冲电场法等,都还处于研究的初始阶段。
2.2 磷脂酰胆碱的脱酰反应
磷脂的脱酰反应,主要是磷脂化合物在水溶液或低碳醇作为溶剂的体系中,在催化剂的存在下发生酯交换反应(图7)。酯交换催化剂主要有生物酶、碱性催化剂、酸性催化剂3类。以磷脂酰胆碱为原料合成L-α-GPC,需要合适的催化剂使1、2位发生反应,而3位磷脂键保留。

图7 磷脂脱酰酯交换反应制备L-α-GPCFig.7 Preparation of L-α-GPC by deacylation transesterification reaction equation of phospholipid compound
在生物体代谢过程中,存在多种可以水解甘油磷脂酯键的磷脂酶类。磷脂酶A1和A2可分别使甘油磷脂的第1位和第2位酯键断裂;磷脂酶B能脱去溶血磷脂的脂肪酸;磷脂酶C、D可使3位磷酸酯键水解。Uziel等从干燥的青霉菌丝中提取得到溶血卵磷脂酶B,可以选择性地使纯的溶血磷脂脱去一个脂肪酸得到L-α-GPC,收率能达到45%~60%,但是此酶对脂肪酸的饱和度的选择性存在差异,而且要求溶血磷脂必须是单酰化取代L-α-GPC,即必须是溶血磷脂,反应路线见图8。总之,一般情况下,生物酶对于底物的要求具有专一性,且要大量得到则需要靠细菌的大量繁殖分泌,所以,寻找能分泌催化特定酯基脱落的酶是主要任务。
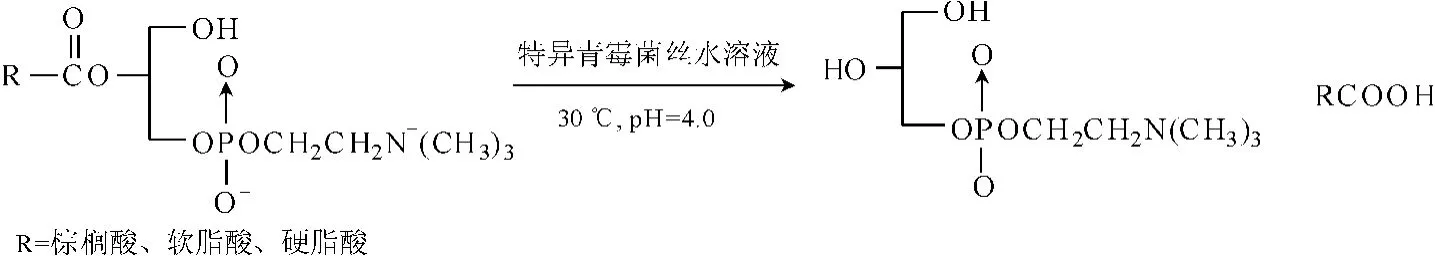
图8 青霉菌丝催化溶血磷脂脱酰反应Fig.8 Deacylation reaction of lysophosphatide catalyzed by m ycelia of Penicillium
酸性催化剂如硫酸和苯磺酸,催化效率低,且会产生大量废酸,已基本淘汰,偶尔用作高酸值的原料。常用的碱性催化剂有KOH、NaOH、甲醇钠、Na2CO3等,具有反应条件温和、催化效率高等特点,是工业上最常用的催化剂。Evans等[14]用甲醇钠水解低浓度(大约2 g·L-1)的卵磷脂溶液后得到粗GPC,再经提纯处理,得到纯的L-α-GPC,收率达96.8%。Robles等[15]采用甲醇锂醇解从粉末蛋黄中萃取的磷脂也得到了L-α-GPC。但使用甲醇钠作为催化剂的反应也存在问题:在酰氧基断裂的同时,会造成部分P-O键的断裂,得到一些对人体有害的副产物。Okui提出用碱土金属进行水解反应,但是产物掺杂大量的副产物。Brockerhoff等将水解催化剂换为季铵碱(四丁基氢氧化铵),水解过程与Chadha[16]的结果一致,但是四丁基氢氧化铵价格昂贵,得到的产物不是游离的L-α-GPC,而是四丁基氢氧化铵盐的复合物,需要再进行结晶操作,不易大规模生产和重现性不高都使其应用受到制约。
由此可见,当使用碱性催化剂催化脱酰反应时,需要控制好碱性的强弱。碱性过强,则易使磷脂的磷脂键水解;而碱性偏弱,既浪费原料,又需要更长的反应时间。另外,金属离子的去除需要消耗大量的酸、碱、树脂。
近年来,有学者开始使用固体碱催化剂,得到了较一般碱性催化剂更好的结果。de Ferra等[17]以甲醇为溶剂,采用强碱性离子交换树脂作为催化剂,与PC进行酯交换反应,同时利用碱性树脂本身的吸附性,初步分离,制备得到L-α-GPC。该法快速、工艺简单,收率和晶形都比较好。
2.3 反应产物的提纯
虽然磷脂经过提纯后,PC含量显著提升,但是原料中仍含有一定量的PE、PI、PS、PA,它们水解后则分别得到GPE、GPI、GPS、GPA。除此之外,反应混合物还含有脂肪酸甲酯、中性脂类等。脂肪酸甲酯和中性脂类可以用石油醚等非极性溶剂萃取除去,但是L-α-GPC、GPE、GPI、GPS等物质极性相近,且大都带有弱碱性,所以它们的分离提纯是需要解决的主要问题。
最初提纯L-α-GPC的方法主要是采用形成金属复合物的方法。美国专利介绍了一种用过量的AgCl处理反应液使副产物沉淀,再用H2S和BaCO3除去过量的银离子,但是银离子不能完全除尽。Hanahan等、Tattrie等通过形成氯化镉复合物的方法提纯L-α-GPC,再用大量树脂去除镉离子。由于得到的产物不是游离的L-α-GPC,需要使用离子交换树脂去除氯化镉,导致纯化非常复杂,收率较低,而最主要的问题是:即使微量的镉离子存在,毒性仍然相当大,不能用于工业生产。Tronconi等[18]报道了一种从磷脂脱酰混合物中分离L-α-GPC和GPE的方法,即向混合物中加入ZnCl2,形成(GPC+GPE)ZnCl2混合沉淀,再用吡啶置换出ZnCl2,得到纯的GPC和GPE混合物,再通过强碱离子树脂分离得到GPC、GPE,其工艺流程见图9。但是此工艺存在操作步骤多、选择性不强、产率不够高等缺点。

图9 Tronconi等的工艺路线Fig.9 Process route by Tronconi,et al.
为了得到不含金属离子的游离L-α-GPC,人们用树脂对反应混合物进行分离,取得了很好的效果。Tronconi等[18]先用碱金属将脱酰反应混合物中的GPS沉淀出来,再用阳离子树脂、强碱性离子树脂分离得到L-α-GPC与GPE。此方法树脂用量少,收率和纯度都相对较高。de Ferra等[17]研究了强碱性离子交换树脂作为催化剂处理粗磷脂的醇提取液,以甲醇为溶剂进行酯交换反应,得到L-α-GPC、GPE、GPI。利用碱性树脂本身的吸附性,使用不同的洗涤液将不同的产物洗涤下来,达到了分离的效果。反应、分离同时在一个容器进行,具有工艺简单、迅速、收率和纯度都比较高的特点。
3 结语
全合成法得到的L-α-GPC纯度比较高,收率高,但原料比较昂贵,而且可能有剧毒,不易储存,合成工艺路线长;半合成法具有原料廉价易得、收率高的优点。制备高纯度具有医用价值的L-α-GPC将是研究的主要方向,其中采用离子交换树脂作为催化剂和分离介质具有高效、快速等优点,应加大研究开发的力度。
[1]GOLDFARB D S.Method using lifespan-altering compounds for altering the lifespan of eukaryotic organisms,and screening for such compounds:US,2009163545[P].2008-12-22.
[2]FARESE S.Dietary supplemental composition effective for enhancing cognitive performance,elevating mood and reducing oxidative stress: US,2010056484[P].2008-08-26.
[3]MITCHELL M W.Biomarkers for prostate cancer and methods using the same:WO,2008036691[P].2007-09-18.
[4]YAMAMOTO T,HORII I,YOSHIDA T.Integrated NMR-based metabonomic investigation of earlymetabolic effectsofethylene glycolmonomethyl ether(EGME)onmale reproductive organs in rats[J].Journal of Toxicological Sciences,2007,32(5):515-528.
[5]左青,胡建新.我国食品级磷脂市场及其存在问题[J].中国油脂,2012,37(11):69-71.
[6]NGUYEN HOANG P,NGUYEN THANH T,CHABRIER P.New method for preparing alpha-and beta-glycerylphosphorylcholines and their homologs and analogs[J].Bulletin de la Societe Chimique de France,1975,(9-10,Pt2):2326-2328.
[7]PURICELLIL.Process for preparing alpha-glycerophosphorylch-oline: EP,486100[P].1991-11-09.
[8]SONG Y S,SONG E S,KANG D S,et al.A process for preparation of L-alpha-glycerophosphorylcholine via condensation reaction of phosphocholine chloride with R-(+)-glycidol:WO,2007145476[P].2007-06-14.
[9]LEE H J,PARK JM,LEE B H.Method for preparing glyceryl phosphorylcholine:KR,2009039132[P].2007-10-17.
[10]陈新,梅以成,梁鹏.一种L-α-甘油磷酸胆碱的合成方法:中国,101544667[P].2008-03-27.
[11]李招群,欧阳晓露,万屏南.大豆磷脂的研究进展[J].江西化工,2009,(1):14-16.
[12]吴丽芹,邵荣,云志.大豆卵磷脂的提纯与磷脂酰胆碱含量的分析[J].化学世界,2009,50(5):276-279.
[13]DUNFORD N T,TENEKKU F.Extraction of phospholipids fro-m canola with supercritical carbon dioxide and ethanol[J].Journal of the American Oil Chemists'Society,1995,72(9):1009-1015.
[14]EVANSC T,MCCAGUE R,TYRRELL N D.Preparation of phospholipid-intermediate glycerophosphocholine by a crystallization process: WO,9315088[P].1992-12-31.
[15]ROBLESEC,ROELSG F.Preparation of deacylated phosphoglycerides[J].Chemistry and Physics of Lipids,1971,6(1):31-38.
[16]CHADHA JS.Preparation of crystalline L-alpha-glycerophosphorylcholine-cadmium chloride adduct from commercial egg lecithin[J].Chemistry and Physics of Lipids,1970,4(1):104-108.
[17]de FERRA L,BONIFACIO F,CIFARELLIG,etal.A process for the preparation of glycerophospholipids:EP,575717[P].1993-04-08.
[18]TRONCONIG,COCCOLIC.Chromatographic process for separating themain components of a mixture of raw deacylated phospholipids: WO,9115494[P].1991-03-28.
Research Progress on Preparation of L-α-Glycerol Phosphatidylcholine
ZHU Chao,XIA Jian-cai,ZHU Li
(School of Chemical Engineering,Yunnan Open University,Kunming 650500,China)
L-α-Glycerol phosphatidylcholine(L-α-GPC)is smallmolecule with good biological activity and abounds in human and animal body,which plays critical physiological role in themetabolism.Ithas become an important research direction ofmodification of phospholipids.Various preparationmethods of L-α-GPC were introduced and compared.Total syntheticmethod had the advantages of high purity and easy in separation,but the raw materials were expensive,and pharmaceutical propertieswere different.Semi-synthetic method had the advantages of high yield and thematerialswere cheap and readily available,which became themainstream of the present study.
phospholipids;L-α-glycerol phosphatidylcholine;preparation
TQ 645.9
A
1672-5425(2015)07-0005-04
10.3969/j.issn.1672-5425.2015.07.002
云南省教育厅科学研究基金一般项目(2013Y182)
2015-03-02
朱超(1986-),男,重庆人,博士,讲师,研究方向:磷脂的提纯、分离、检测,E-mail:mikejoid@163.com。

