小鼠AChR(m97-116)肽段-CD205融合单链抗体的表达及活性检测
孙超 袁媛 郑鹏飞 高星 赵元琳 李乐 常婷 李柱一
小鼠AChR(m97-116)肽段-CD205融合单链抗体的表达及活性检测
孙超 袁媛 郑鹏飞 高星 赵元琳 李乐 常婷 李柱一
目的 构建小鼠AChR(m97-116)肽段-CD205融合单链抗体原核表达载体,表达融合单链抗体(m97-116-scFv205),检测其对未成熟树突状细胞(iDC)的亲和力,为通过iDC诱导AChR特异性免疫耐受提供实验基础。方法 分离培养小鼠原代骨髓祖细胞,经粒细胞-巨噬细胞集落刺激因子(GM-CSF)10 ng/mL和白细胞介素4(IL-4)10 ng /mL刺激培养,经脂多糖(LPS)1 ng/mL诱导24 h后,高倍显微镜及扫描电镜观察细胞形态;流式细胞术(FCM)检测细胞表面相关分子表达,对iDC表型进行鉴定;构建原核表达载体m97-116-scFv205- pET22b(+),0.1 mmol/mL异丙基硫代半乳糖苷(IPTG)18℃诱导表达18 h,镍(Ni)柱纯化,SDS-PAGE和Western blot检测融合单链抗体m97-116-scFv205表达及纯化;FCM检测其与iDC的亲和力。结果 形态学观察提示培养细胞为DC,FCM结果显示培养细胞符合iDC表型;SDS-PAGE和Western blot在上清中检测到m97-116-scFv205可溶性表达;亲和力检测显示m97-116-scFv205与iDC具有较高亲和力。结论 成功构建并表达m97-116-scFv205融合单链抗体,该抗体与iDC具有较高的亲和力,为下一步靶向iDC诱导AChR特异性免疫耐受治疗重症肌无力奠定了良好的实验基础。
重症肌无力;未成熟树突状细胞;融合单链抗体;CD205
树突状细胞(dendriticcells,DCs)是体内最强的抗原递呈细胞(antigen-presentingcells,APC),其最大的特点就是表型和功能的灵活性。未成熟DC(immaturedendriticcells,iDC)具有很强的抗原捕获和处理能力,因其表面低表达MHCⅡ类分子和共刺激信号,不能提供T细胞活化的第二信号,从而导致特异性T细胞无反应性、凋亡或者产生调节T细胞(regulatoryTcell,Treg),诱导免疫耐受。目前,基于iDC诱导免疫耐受已用于各类自身免疫性疾病的预防和治疗[1]。重症肌无力(myastheniagravis,MG)是典型的主要由乙酰胆碱受体抗体(AChRAb)介导、T细胞依赖、补体参与的神经肌接头(neuromuscularjunction,NMJ)处自身免疫性疾病[2],AChR自我耐受的打破是MG发病的关键所在。位于NMJ突触后膜的AChR是其致病的重要自身抗原,大多数AChRAb都直接作用于AChRα1亚基胞外域而发挥作用。研究表明AChRα1亚基胞外域97-116肽段(97-116)共存于大鼠、小鼠和人,且较电鳗97-116更好地诱导实验性自身免疫性重症肌无力(EAMG)[3]。本研究拟将m97-116与iDC表面特异性受体-CD205单链抗体在基因水平上耦联,并表达融合单链抗体(m97-116-scFv205),观察其与iDC的亲和力,以期通过iDC诱导AChR特异性免疫耐受,从而为治疗MG奠定实验基础。
1 材料和方法
1.1 材料C57雌性小鼠2只,鼠龄6周,购自第四军医大学实验动物中心。RPIM-1640培养液、胎牛血清、小鼠红细胞裂解液购自杭州四季青。PE-CD80、PE-CD86、PE-CD40、FITC-CD11C、FITC-CD11B、PE-MHCⅡ等流式抗体购自美国BD公司。APCanti-mouseCD205购自美国BioLegend公司。GM-CSF、IL-4为美国Peprotech公司。脂多糖(LPS)购自美国Sigma公司。FITC-antihisTag为英国ABDsecrotec公司,HisTagHRP购自康为世纪公司。NiFASTFLOW购自美国GE公司,流式细胞(FCM)仪由美国BD公司提供。
1.2 方法
1.2.1 小鼠骨髓来源DC的培养:小鼠脱颈处死,70%酒精浸泡5min,无菌分离股骨和胫骨,RPMI-1640冲洗髓腔,以1500r/min(离心半径8cm)离心5min,3mL红细胞裂解液重悬,裂解3min。再以1500r/min(离心半径8cm) 离心5min。1640重悬,细胞计数,取2×106/mL铺6孔板同时添加GM-CSF(10ng/mL)和IL-4(10ng/mL)。隔天半量换液及补充GM-CSF,IL-4各至10ng/mL。待培养第6天细胞分为两组,一组加入LPS至1ng/mL(LPS刺激组),另一组不加(非LPS刺激组)。
1.2.2DC鉴定:两组细胞培养到第7天,轻轻摇晃六孔板,取悬浮的细胞,细胞计数,用细胞培养液调整至1×106/mL,PBS洗两遍,各加入1μLFITC-CD11C,FITC-CD11B;2μLPE-CD80,PE-CD86,PE-CD40,PE-MHCⅡ,4℃,避光孵育 30min。同上PBS再洗一遍,最后用200μLPBS及2.5%(体积分数)戊二醛固定液20μL重悬,FCM分析。在骨髓前体细胞的培养过程中,每天在高倍显微镜下动态地观察细胞分化生长变化情况。第7天细胞爬片,过夜后用2.5%(体积分数)戊二醛固定,在扫描电镜下观察分析单个细胞形态。
1.2.3 融合单链抗体的构建和表达:根据NCBI的序列CD205VL(GenBank:AEP95113.1) 和CD205VH(GenBank:AEP95114.1)在pET22b上设计融合单链抗体m97-116-scFv205表达载体,由Generay公司合成,见图1。酶切鉴定m97-116-scFv205表达载体,转化BL21(DE3),挑单克隆至12mL2×YT培养液,过夜培养。第2天以1∶100加入1L的2×YT培养液,37℃,以200r/min(离心半径为8cm)摇菌,待其600nm处吸光度〔D(λ)〕约为0.6时,加入终浓度为0.1mmol/LIPTG和0.4mmol/L蔗糖,18℃,200r/min(离心半径为8cm),18h摇菌。提取周质蛋白[4]:4℃,5000r/min(离心半径为10cm),离心10min收集大肠杆菌,用200mmol/LTris,1mmol/LEDTApH7.0重悬沉淀,冰上静止45min,间断振荡。然后12 000 r/min (离心半径为10 cm),4℃离心30 min,收集上清,用50 mmol/L Tris,1 mol/L NaCl pH 7.0透析,2 mL Ni离子装柱,以3倍柱体积50 mmol/L Tris,1 mol/L NaCl pH 7.0平衡Ni柱,透析后的上清过柱,再以20倍柱体积50 mmol/L Tris,1 mol/L NaCl 20 mmol/L咪唑 pH 7.0及50 mmol/L Tris,1 mol/L,NaCl 20 mmol/L咪唑pH 7.0过Ni柱,最后以50 mmol/L Tris,1 mol/L NaCl 500 mmol/L咪唑 pH 7.0 洗脱。洗脱后的液体用PBS透析,取一部分加入2×Loading buffer,煮沸10 min,SDS-PAGE和 Western blot检测。

pelB:信号肽;VL:轻链可变区;VH:重链可变区;CL-p:部分轻链可变区及15个氨基酸linker;G:甘氨酸;S:色氨酸;His6:6个组氨酸his标签
图1 m97-116-scFv205- pET22b(+)原核表达载体结构
1.2.4 融合单链抗体亲和力检测:取培养7 d的iDC,调整细胞计数至2×106,PBS洗2遍后用200 μL PBS重悬,分别加入融合单链抗体m97-116-scFv205(5 μL/mL)和APC anti-mouse CD205 10 μL,4℃孵育30 min,PBS洗2遍,200 μL重悬,融合单链抗体再加入FITC标记的抗his标签的抗体(FITC-anti his Tag)10 μL,4℃孵育 30 min,PBS洗2遍,最后200 μL重悬,上机进行流式检测。
2 结果
2.1 DC形态学观察 见图2、3。在高倍显微镜下观察细胞,从第2天开始出现集团的细胞簇,悬浮的细胞逐渐增多,细胞体积大且形态不规则, 出现许多短的毛刺状突起;在扫描电镜下观察,培养第7天的细胞形态不规则,表面粗糙层叠状皱褶,呈明显锯齿样突起,短而多似树杈状。

图2 显微镜下观察小鼠骨髓DC细胞培养第2天时的形态学改变(比例尺50 μm)
图3 扫描电子显微镜下观察小鼠骨髓DC细胞培养第7天单个细胞形态(比例尺30 μm)
2.2 DC表型分析 FCM结果显示经GM-CSF和IL-4刺激后CD11C+DC可以达到80%左右,经LPS刺激组的DC表面活性标志分子表达较非LPS刺激组明显增多,提示非LPS刺激组为iDC(表1)。

表 1 FCM检测小鼠骨髓DC表面分子表达 (%)
注:FCM:流式细胞术;LPS:脂多糖
2.3 融合单链抗体载体构建及蛋白表达 m97-116-scFv205- pET22b(+)载体经NcoI和NotI酶切,780 bp处有目的条带,提示原核表达载体构建成功(图4)。0.1mmol/L IPTG,18℃,18 h诱导融合单链抗体m97-116-scFv205表达,蔗糖渗透抽提法裂解细胞周质,Ni柱纯化融合单链抗体,SDS-PAGE显示纯化富集后上清中有符合目的蛋白分子量大小的条带(图5),经ant -His Tag Western blot检测证实为目的蛋白(图6)。
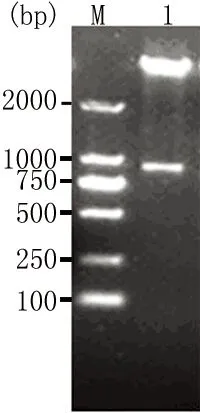
M:Marker 1:m97-116-scFv205 /NcoI+NotI
图4 重组质粒的酶切鉴定结果
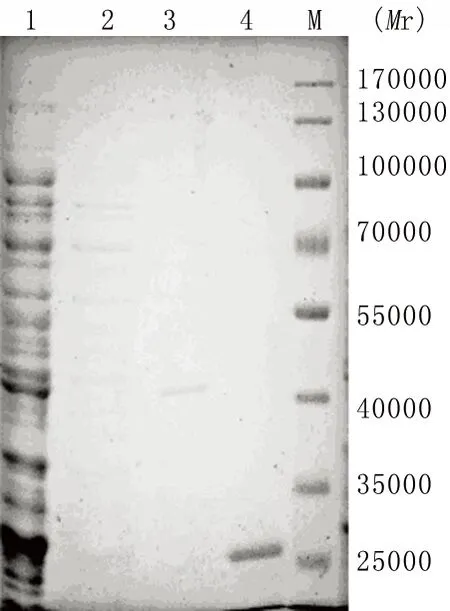
1:菌液;2:上样液;3:洗涤液;4:洗脱液;M:Marker
图5 SDS-PAGE分析融合单链抗体的表达

1:菌液;2:上样液;3:洗涤液;4:洗脱液
图6 Western blot分析融合单链抗体的表达
2.4 融合单链抗体亲和力检测 APC anti-mouse CD205,m97-116-scFv205分别同iDC共孵育后,用FITC-anti his Tag 检测融合单链抗体上的his标签,从而间接证实融合单链抗体对iDC的亲和力。APC anti-mouse CD205为CD205的完全抗体,流式检测显示完全抗体亲和力为49.9%,m97-116-scFv205亲和力为41.1%(图7),提示融合单链抗体与iDC具有较高亲和力。

图7 FCM检测anti-mouse CD205及m97-116-scFv205与iDC的亲和力
3 讨论
尽管皮质类固醇激素、静脉注射丙球(IVIg)及免疫抑制剂的应用可显著缓解MG的症状,然而,由于该类药物是非特异性免疫抑制剂,不可避免地会出现一些副作用,如机会性感染及肿瘤发生。因此,MG的治疗仍面临着巨大挑战。AChR 自我耐受的打破是MG发病的关键,调控AChR特异性T细胞免疫应答,重建AChR自我耐受,有可能为 MG的治疗提供新思路。
DC是迄今发现功能最强的专职抗原递呈细胞,近年来的研究表明DC在诱导和维持机体免疫耐受中发挥着重要作用,尤其是iDC,因其低表达MHCⅡ类分子和共刺激信号,不能提供T细胞活化的第二信号,从而导致特异性T细胞无反应性、凋亡或者产生调节T细胞,在移植免疫耐受诱导、自身免疫性疾病治疗方面,展现出其独特的应用价值[5-6]。本研究结果显示未经LPS诱导的细胞低表达MHCⅡ类分子、CD40、CD86和CD80,证实其未成熟表型。
单链抗体(single chain antibody fragment,scFv),是由抗体重链可变区和轻链可变区通过15~20个氨基酸的短肽(linker)连接而成。scFv能较好地保留其对抗原的亲和活性,并具有分子量小、穿透力强和抗原性弱等特点,但是具有亲和力低等缺点。本实验中通过SDS-PAGE和Western blot证实融合单链抗体m97-116-scFv205表达及纯化成功。FCM显示相比完整抗体CD205,融合单链抗体m97-116-scFv205与iDC仍具有很高亲和力。
通过iDC诱导免疫耐受对EAMG的预防和治疗具有重要价值。实验证明体外负载AChR抗原或其免疫优势肽段α146-162的髓系iDC,可诱导EAMG免疫耐受,阻止EAMG的发生;并显著降低EAMG小鼠的疾病评分、抑制AChR特异性淋巴细胞增殖和IFN-γ、IL-6的分泌,对EAMG显示出良好的治疗作用。实验证明体外将iDC和AChR抗原共孵育后皮下注射后,可以抑制AChR特异性淋巴细胞增殖和IFN-γ、IL-6的分泌,并显著降低EAMG大鼠的疾病评分,阻止EAMG的发生[7]。研究者还通过一些细胞因子阻止DC的成熟,用于EAMG的治疗。Yarilin等[8]取新鲜健康的Lewis鼠的脾脏DC并与TGF-β1体外孵育48 h,于EAMG的第5天 皮下注射, 结果发现EAMG的临床症状明显减轻,分泌抗乙酰胆碱抗体的细胞数量明显减少。Duan等[9]分离EAMG Lewis 鼠的脾脏DC,并将DC与IL-10共孵育72 h,皮下注射给EAMG造模5 d的大鼠,可减轻EAMG的临床症状,降低抗乙酰胆碱抗体的细胞数量及协同刺激分子CD80和CD86的表达。以上研究结果表明iDC在治疗重症肌无力等自体免疫性疾病有巨大的研究前景。然而,这些实验均涉及到DC的分离和培养,不仅耗时费力,而且代价昂贵;DC一旦进入体内也可能会受到各种细胞因子和免疫细胞等体内环境的影响而干扰功能,在一定程度上限制了继续的研究应用和临床开发。因此,理想的治疗方法应该是靶向体内的iDC,从而引起其免疫耐受的作用。
本实验利用DC特异性受体CD205,将CD205 scFv与MG自身抗原(97-116)多肽融合表达,期望iDC将自身抗原递呈给AChR特异性T细胞,诱导抗原特异性免疫耐受,该融合单链抗体的制备为重症肌无力特异性治疗奠定了良好的实验基础。
[1]Lanzavecchia A, Sallusto F. Ralph M. Steinman 1943-2011[J]. Cell, 2011,147(6):1216-1217.
[2]Avidan N, Le Panse R, Berrih-Aknin S, Miller A. Genetic basis of myasthenia gravis - A comprehensive review[J]. J Autoimmun, 2014, 52:146-153.
[3]Baggi F, Annoni A, Ubiali F, et al. Breakdown of tolerance to a self-peptide of acetylcholine receptor alpha-subunit induces experimental myasthenia gravis in rats[J]. J Immunol, 2004,172(4):2697-2703.
[4]Wang WW, Das D, Suresh MR. A versatile bifunctional dendritic cell targeting vaccine vector[J]. Mol Pharm, 2009,6(1):158-172.
[5]Bonifaz L, Bonnyay D, Mahnke K, et al. Efficient targeting of protein antigen to the dendritic cell receptor DEC-205 in the steady state leads to antigen presentation on major histocompatibility complex class I products and peripheral CD8+T cell tolerance[J]. J Exp Med, 2002,196(12):1627-1638.
[6]Shrimpton RE, Butler M, Morel AS, et al. CD205 (DEC-205): a recognition receptor for apoptotic and necrotic self[J]. Mol Immunol, 2009,46(6):1229-1239.
[7]Xiao BG, Duan RS, Link H, et al. Induction of peripheral tolerance to experimental autoimmune myasthenia gravis by acetylcholine receptor-pulsed dendritic cells[J]. Cell Immunol, 2003,223(1):63-69.
[8]Yarilin D, Duan R, Huang YM, et al. Dendritic cells exposed in vitro to TGF-beta1 ameliorate experimental autoimmune myasthenia gravis[J]. Clin Exp Immunol, 2002,127(2):214-219.
[9]Duan RS, Adikari SB, Huang YM, et al. Protective potential of experimental autoimmune myasthenia gravis in Lewis rats by IL-10-modified dendritic cells[J]. Neurobiol Dis, 2004,16(2):461-467.
(本文编辑:时秋宽)
Determining the expression and affinity of mice acetylcholine receptor peptide 97-116 and CD205 fusion single chain antibody fragment
SUNChao,YUANYuan,ZHENPengfei,GAOXing,ZHAOYuanlin,LILe,CHANGTing*,LIZhuyi*.
*Department of Neurology, Tangdu Hospital, The Fourth Military Medicine University, Xi’ an Shaanxi 710038, China
CHANGTing,Email:changting1981@163.com;LIZhuyi,Email:lizhuyi@fmmu.edu.cn
ObjectiveToconstructprokaryoticexpressionvectorofmiceacetylcholinereceptorpeptide(m97-116)andCD205fusionsinglechainantibodyfragment(m97-116-scFv205),andtoanalyzetheaffinityofthefusionproteintoimmaturedendriticcell(iDC).MethodsBonemarrowcellswereharvestedfromthefemurandtibiaeofC57BL/6miceandwashedinRPMI1640followinglysisofredbloodcell.Remainingcellswereculturedincompletemedium(RPMI1640supplementedwith5%FCS,)with10ng/mLGM-CSFand10ng/mLIL-4.ThecellswerestimulatedwithLPS(1ng/mL)orwithoutLPSfor24hours.Themorphologyofthecellswasobservedbythemicroscopeandscanningelectronmicroscopy.Flowcytometry(FCM)wasusedtoanalyzetheexpressionoflineageandspecificmarker.Thefragmentm97-116-scFv205wasclonedintoprokaryoticexpressionvectorpET22b(+)andtheproteinexpressionwasinducedby0.1mmol/LIPTGat18℃for18h,andthenpurifiedbyNicolumnviaHisTag.ProteinproductionandpurificationstepswereanalyzedbySDS-PAGEandWesternblot.Theaffinityofm97-116-scFv205withiDCwastestedbyFCMviaFITC-antiHisTag.ResultsThemorphologicalandphenotypicalanalysisshowedthatculturedcellsweretypicaliDC.Theexpressionofm97-116-scFv205wasdemonstratedbySDS-PAGEandWesternblot.Them97-116-scFv205showedhighaffinitywithiDC.ConclusionsTheprokaryoticexpressionvectorofm97-116-scFv205wassuccessfullyconstructedandthem97-116-scFv205canspecificallybindtoiDC,providingbasisforfurtherstudiesinducingAChRspecificimmunologictolerancethroughtargetediDC.
myastheniagravis;immaturedendriticcell;fusionsinglechainantibodyfragment;CD205
10.3969/j.issn.1006-2963.2015.01.002
国家自然科学基金资助项目(81102217)
710038 陕西省西安市第四军医大学唐都医院神经内科(孙超、常婷、李柱一);710032 第四军医大学病理学教研室(袁媛、高星、赵元琳、李乐);710032 第四军医大学西京医院心脏内科(郑鹏飞)
常婷,Email:changting1981@163.com;李柱一,Email:lizhuyi@fmmu.edu.cn
R746.1
A
1006-2963 (2015)01-0004-05
2014-09-17)

