紫杉醇脂质体对乳腺癌细胞SK-BR-3的放疗增敏作用及其机制
姚 烜,赵 玲,李索妮,史婷婷,姚 煜
(1.西安交通大学医学部附属西安市中心医院普外科,陕西西安 710003;
2.郑州市中心医院肿瘤科,河南郑州 450000;3.陕西省肿瘤医院肿瘤内科,陕西西安 710061;4.西安交通大学医学部第一附属医院肿瘤内科,陕西西安 710061)
紫杉醇脂质体对乳腺癌细胞SK-BR-3的放疗增敏作用及其机制
姚 烜1,赵 玲2,李索妮3,史婷婷4,姚 煜4
(1.西安交通大学医学部附属西安市中心医院普外科,陕西西安 710003;
2.郑州市中心医院肿瘤科,河南郑州 450000;3.陕西省肿瘤医院肿瘤内科,陕西西安 710061;4.西安交通大学医学部第一附属医院肿瘤内科,陕西西安 710061)
目的 探索紫杉醇脂质体(力扑素)对乳腺癌细胞株SK-BR-3是否具有放疗增敏作用及其放疗增敏机制。方法 利用MTT法检测放疗组、单药紫杉醇脂质体(以下简称单药组)及紫杉醇脂质体联合放疗(以下简称联合组)在不同时间对乳腺癌细胞SK-BR-3的生长抑制作用。利用流式细胞仪检测放疗组、单药组及联合组对细胞周期及凋亡的影响。利用Western blot检测凋亡相关蛋白Caspase-3、Bcl-2及Bax在不同处理组中的表达,探索紫杉醇脂质体放疗增敏作用的机制。结果 MTT结果显示放疗组、单药组及联合组均具有细胞生长抑制作用,与细胞对照组相比差异具有统计学意义(P<0.05),而且联合组较单药及放疗组具有更显著的细胞生长抑制作用,差异具有统计学意义(P<0.05);细胞凋亡结果显示放疗组、单药组及联合组凋亡细胞均明显增加,与对照组相比差异具有统计学意义(P<0.05),并且联合组在细胞周期中均出现了明显的凋亡峰;Western blot结果显示,促凋亡蛋白Caspase-3和Bax的表达在放疗组、单药组和联合组中均升高,与对照组相比差异具有统计学意义(P<0.05),并且联合组升高较放疗组及单药组更为显著,差异具有统计学意义(P<0.05),而抗凋亡蛋白Bcl-2的表达在放疗组、单药组及联合组均减低,与对照组相比差异具有统计学意义(P<0.05),而联合组较放疗组及单药组降低更明显,差异具有统计学意义(P<0.05)。结论 紫杉醇脂质体具有明显的放疗增敏作用,并且可能通过调控凋亡相关蛋白的表达引起细胞凋亡来发挥其放疗增敏作用。
乳腺癌;放疗增敏作用;紫杉醇脂质体;凋亡;细胞周期;Caspase;Bcl-2;Bax
乳腺癌是女性最常见、发病率最高的恶性肿瘤之一。据统计,2012年全球乳腺癌新增病例170万例,死亡约52.1万例[1]。我国乳腺癌的发病率也在不断上升,新发病例每年递增3%~4%,与不同地区的经济发展程度相关,在许多发达城市,乳腺癌已跃居成为女性发病率第一位的恶性肿瘤[2]。目前,化疗联合放疗在乳腺癌的综合治疗中占据重要地位,但有些肿瘤对放疗的敏感性较差,寻找有效且低毒的放疗增敏药物显得尤为重要。
紫杉醇-脂质体是用磷脂双分子层将紫杉醇包裹起来,从而形成一个闭合的囊泡,将磷脂酰胆碱、胆固醇、紫杉醇按照一定的比列制成,有研究证明,其比原始紫杉醇具有更强的细胞毒性和较高的稳定性,从而提高抗肿瘤的疗效、减少不良反应的发生[3]。目前是临床乳腺癌患者治疗用药中的新宠。但众所周知,原始紫杉醇具有一定的放疗增敏作用,所以本课题致力于研究新药紫杉醇脂质体在增加药物有效性,减小药物不良反应的同时能否同样发挥放疗增敏作用,并初步探索其放疗增敏作用的机制。
1 材料与方法
1.1 实验材料人乳腺癌细胞株SK-BR-3(以下简称SK-BR-3细胞)购自中科院上海细胞库。RPMI-1640培养基及青霉素链霉素双抗购自美国HYCLONE公司,胎牛血清购自上海四季青公司,胰蛋白酶购自GIBCO公司,凋亡试剂盒购自珠海健康元生物医药有限公司,RNA酶及PI染液购自Omega公司,Caspase-3、Bcl-2、Bax兔抗人单克隆抗体购自Proteintech Group,Inc USA公司,β-actin兔抗人抗体购自SANTA CRUZ BIOTECHNOLOGY,ING公司,HRP标记的羊抗兔IgG购自Signalway Antibody(SAB)Co.Ltd。紫杉醇脂质体(力扑素)由南京绿叶思科公司提供。
1.2 细胞培养及收集SK-BR-3细胞使用100 mL/L胎牛血清及10 g/L青链霉素双抗的RPMI-1640培养基,放置于含有50 m L/L CO2的37℃的恒温培养箱中培养。传代时用胰蛋白酶进行消化。
1.3 药物浓度及放射线计量设定查阅相关文献并进行前期预实验后将实验药物紫杉醇酯质体(力扑素)浓度设定为5、10、15、20 mmol/L,并将放射线计量设定为4兆伏2 gy。
1.4 MTT法检测不同处理组细胞生长抑制作用取对数生长期细胞,以4×103个/孔接种于96孔板中,将培养板中细胞分为对照组、放疗组、单药组(力扑素组)以及联合组(放疗+力扑素组)。接种细胞培养18 h后换液,对单药组及联合组细胞按设置浓度加药,加药完成后将放疗组及联合组细胞继续于直线加速器下接受4 MV 2 gy X线照射。处理完毕的细胞置于恒温培养箱中培养48 h。培养完毕后于每孔中加入5 mg/mL的MTT液20μL,放置于培养箱中继续培养4 h,小心吸出孔内上清液,于每孔中加入DMSO 100μL,振荡5 min,使还原物质全部溶解,置于酶标仪上于560 nm波长下检测光吸收值,实验重复3次。按照以下公式计算细胞生长抑制率:细胞生长抑制率=(1-实验组A值/对照组A值)×100%。
1.5 流式细胞仪检测细胞凋亡取对数生长期细胞,消化后按1×105个/孔接种于6孔板中,分组同MTT。18 h后换液,按照MTT结果所得IC50浓度的1/3于单药组及联合组孔中加药,加药完毕后将放疗组及联合组细胞置于直线加速器下接受4 MV 2 gy X线照射。照射完毕后继续培养48 h。分别消化并收集各组细胞于事先标记好的离心管中,置于离心机中1 500 r/min离心5 min,轻轻弃去上清;用3 m L PBS轻轻吹打洗涤细胞2次,置于超低温离心机中1 000 r/min离心10 min,弃去PBS。用移液器吸取400μL Binding Buffer重悬细胞。重悬后的离心管中加入5μL Annexin V,室温避光孵育5 min,之后加入10μL PI染液,室温避光孵育15 min。1 h内流式细胞仪检测分析。
1.6 流式细胞仪检测细胞周期细胞接种、加药、加放射线照射及收集细胞过程同凋亡检测步骤。将收集好的细胞用-20℃预冷的700 mL/L的乙醇固定,4℃过夜。过夜后置于离心机中离心,轻轻弃去酒精,继续用3 mL PBS洗涤2次,1 500 r/min离心5 min,弃去PBS;首先加入RNA酶150μL,再加入PI染液150μL,4℃下避光染色30 min;1 h内上机检测。
1.7 Western blot检测凋亡相关蛋白Caspase-3、Bcl-2及Bax的表达细胞接种、加药、加放射线照射步骤同前。培养48 h后的细胞用RIPA蛋白裂解液提取蛋白并进行蛋白定量。定量完成后计算上样量。配制SDS-PAGE浓缩胶及分离胶,按照常规步骤电泳、转膜、孵育一抗、孵育二抗,最终于Odyssey红外成像系统(Infrared Imaging System,LiCor Biosciences)中检测PVDE膜上的荧光强度并进行分析。
1.8 统计学方法采用SPSS18.0软件进行统计学分析。计量资料用均数±标准差(±s)表示。两组间比较采用t检验,多组间均数的比较采用单因素方差分析(ANOVA),两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 不同处理组对SK-BR-3细胞的生长抑制作用MTT结果显示,单药组及联合组均表现出细胞生长抑制作用,与细胞对照组相比差异具有统计学意义(P<0.05);而联合组表现出更显著的细胞生长抑制作用,与单药组相比差异均具有统计学意义(P<0.05,图1)。

图2 不同处理组细胞凋亡的比较Eig.2 Comparison of apoptosis rate in different groups

图1 不同处理组细胞生长的抑制率曲线图Eig.1 Rate of cell growth inhibition in different groups
2.2 不同处理组对SK-BR-3细胞凋亡的影响放疗组及单药组细胞均表现出不同程度的凋亡,与细胞对照组相比差异具有统计学意义(P<0.05),但两组之间比较差异不具有统计学意义(P>0.05);而联合组细胞表现出比放疗组及单药组更为显著的细胞凋亡现象,差异具有统计学意义(P<0.05,图2、图3)。
2.3 不同处理组对SK-BR-3细胞周期的影响流式细胞仪检测对照组及单药组细胞均未出现明显亚G1峰,而放疗组及联合组细胞均出现亚G1峰,而联合组更为显著,两者相比差异具有统计学意义(P<0.05,图4、图5)。
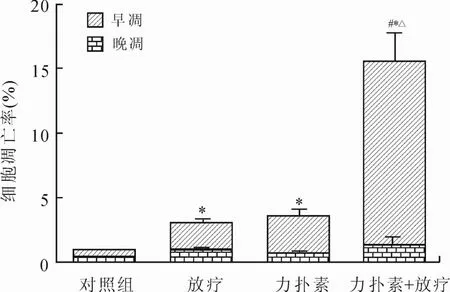
图3 不同处理组细胞凋亡的统计结果Eig.3 Statistical results of apoptosis rate in different groups
2.4 不同处理组凋亡相关蛋白Caspase-3、Bcl-2及Bax在SK-BR-3细胞中表达的变化与对照组相比,Caspase-3及Bax蛋白的表达在放疗组、单药组及联合组中均出现了不同程度的升高,差异具有统计学意义(P<0.05),而其中联合组细胞Caspase-3及Bax的表达升高尤为明显,与放疗组及单药组相比差异具有统计学意义(P<0.05);而Bcl-2蛋白的表达在不同处理组中表现出不同程度的下调,与对照组相比差异具有统计学意义(P<0.05),并且以联合组下调更为显著,与放疗组及单药组相比差异具有统计学意义(P<0.05,图6、图7)。

图4 不同处理组细胞周期的比较Eig.4 Results of cell cycle in different groups
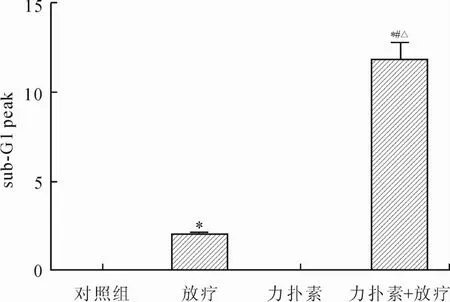
图5 不同处理组亚-G1峰的比较Eig.5 Statistical results of sub-G1 peak in different groups

图6 Western blot检测不同处理组凋亡相关蛋白的表达结果Eig.6 Expression of apoptosis-related proteins in different groups detected by Western blot
3 讨 论

图7 不同处理组凋亡相关蛋白表达的比较Eig.7 Comparison of the expressions of apoptosis-related proteins in different groups
放射治疗是乳腺癌患者重要的治疗手段之一,对于有高危因素的患者放射治疗显得尤为重要。但是放疗的长期应用也导致放射线耐受肿瘤细胞的出现,因此寻找有效且低毒的放疗增敏药物成为临床研究的热点。随着肿瘤分子生物学研究的进展,人们对放疗敏感性的认识和研究不断的深入。已经从最初的组织、细胞学水平发展到目前的分子生物学和基因水平,放射增敏剂已经从传统的乏氧细胞增敏剂发展成包括所有能够影响放射敏感性的化学和生物学手段,其作用机制研究领域也已经扩展到细胞微环境,血管生成因子,放射诱导的信号传导过程,DNA的损伤,细胞分化,细胞周期调控与细胞凋亡等[4]。紫杉醇为双萜紫杉烷类抗癌药物,在治疗卵巢癌、乳腺癌和非小细胞肺癌等多种恶性肿瘤具有显著疗效。紫杉醇虽然具有确切的抗肿瘤活性,但是却难溶于水,必须使用溶媒才能使之很好的溶解。目前临床上通常使用聚氧乙烯蓖麻油与无水乙醇体积按1∶1配比的混合溶媒,但聚氧乙烯蓖麻油在体内降解时会引起组胺释放而发生严重的过敏反应。临床用药前必须采取一系列的抗过敏措施,因此患者被动接受了大剂量激素所带来的不良反应。聚氧乙烯蓖麻油还可在血液中形成胶团包裹PTX分子,影响药物分子向组织间扩散,进而影响抗肿瘤效应[5]。
脂质体是20世纪70年代出现的一种新型药物载体,具有类细胞结构。其作为抗肿瘤药物的载体具有多种优势,可减轻被包裹药物的毒性,增加药物被肿瘤细胞的摄取率,改变药物在组织中的分布,有效延长药物在体内的滞留时间,从而提高疗效、减少不良反应[6-8]。脂质体紫杉醇是用卵磷脂等材料包裹的紫杉醇。具有更好的组织亲和性和缓释作用。
过去NGUYEN等[9]用原始紫杉醇对一种富含谷胱甘肽且耐放疗的淋巴瘤细胞株LY-ar进行放疗增敏研究时发现,其增敏作用可能是由于紫杉醇能大幅度降低LY-ar细胞内谷胱甘肽含量引起的。那么脂质体紫杉醇是否能像原始紫杉醇一样发挥放疗增敏作用以及其放疗增敏机制引起本课题组的关注。本实验应用MTT法检测放疗组,单药组以及联合组对细胞的生长抑制作用结果显示,联合组较放疗组及单药组表现出了更明显的细胞生长抑制作用,并且其作用明显优于两种单纯方案作用的叠加,提示紫杉醇脂质体联合放疗能够发挥放疗增敏作用。
细胞凋亡是细胞的程序性死亡[10],以往研究显示,细胞凋亡程度与细胞的放射线敏感性有着一定的相关性,并且诱导凋亡的程度能够作为衡量放射线敏感性的一项指标[11]。本实验检测不同处理组细胞凋亡结果显示,联合组细胞凋亡数量较放疗组及单药组细胞显著增多,同样提示紫杉醇脂质体具有放疗增敏作用。而在细胞周期中,在细胞增殖过程中,处于不同时相的细胞其DNA含量分布在2~4 n之间,但凋亡的细胞由于DNA裂解成很多碎片,经过染色后,用流式细胞仪检测其DNA含量,会出现一个DNA<2 n的位于G1期之前的分布区,即“亚G1峰”(Sub-G1)。Sub-G1法可应用于不同细胞周期时相的细胞凋亡定量分析[12]。在本实验中,对照组细胞及单药组细胞均未出现明显的亚G1峰,而放疗组及联合组细胞均出现亚G1峰,但联合组处于亚G1峰中的细胞数量显著多于放疗组。由此,细胞周期亚G1峰的出现同样提示我们,紫杉醇脂质体具有明显的放疗增敏作用。
上述的实验结果证明了紫杉醇脂质体具有放疗增敏作用,但是其放疗增敏机制尚不得而知。但上述细胞周期及凋亡结果均指向,紫杉醇脂质体的放疗增敏作用可能与细胞凋亡有关。由此,本实验检测细胞凋亡相关蛋白Caspase-3、Bax及Bcl-2的表达。Caspase即含半胱氨酸的天冬氨酸酶,是一种半胱氨酸蛋白酶,其起源于线虫(Celegans)细胞程序性死亡的研究[13]。Caspase-3基因是由EERNANDERS-ALNEMRI等[14]在1994年发现的,并且是整个细胞凋亡级联反应中的必经之路,是一个非常关键的调控点。而Bax和Bcl-2同属于Bcl-2家族,Bcl-2即B细胞淋巴瘤/白血病-2基因,最初是由TSUJIMOTO[15]在1985年研究滤泡性淋巴瘤时发现的,但Bcl-2属于抗凋亡蛋白,而Bax属于促凋亡蛋白。本课题利用Western blot法检测3种凋亡相关蛋白的表达结果显示,促凋亡蛋白Caspase-3及Bax的联合组细胞中表达显著高于对照组、放疗组及单药组,而抗凋亡蛋白Bcl-2表现出于促凋亡蛋白截然相反的结果。上述结果提示,紫杉醇脂质体可能是通过调控凋亡蛋白的表达来发挥其放疗增敏作用。
综上所述,本实验初步探索了紫杉醇脂质体的放疗增敏作用,并初步阐明了其放疗增敏作用的机制,为临床用药提供一定的理论基础的同时,也为寻找新的放疗增敏剂提供了实验基础。后续我们将进一步进行在体实验,对这一发现进一步论证。
[1]杨柯君.全球癌症状况最新数据更新[J].上海医药,2014,35(2):5.
[2]LU WL,LI HX,QIAN BY,et al.The clinical characteristics and prognosis of Chinese early stage breast cancer patients:A retrospective study[J].Breast J,2010,16(3):331-333.
[3]MAEDEH K,MOFTAKHARI EI,EBRAHIM A,et al.Cytotoxicity of liposomal paclitaxel in breast cancer cell line MCF-7[J].Ind J Clin Biochem,2013,28(4):358-360.
[4]赵继勇.放射治疗增敏的研究现状[J].临床肿瘤学杂志,2012,17(7):655-659.
[5]TENTIJE AJ,VERWEIJJ,LOOS WJ,et al.Pharmacological effects of formulation vehicles:implication for cancer chemotherapy[J].Clin Pharmacokinet,2003,42(7):665-685.
[6]SAMAD A,SULTANA Y,AQIL M.Liposomal drug delivery systems:An update review[J].Curr Drug Deliv,2007,4(4):297-305.
[7]刘文静,赵艳秋,胡秀峰,等.紫杉醇脂质体联合替吉奥治疗晚期胃癌的有效性及安全性评价[J].郑州大学学报:医学版,2014,49(6):783-786.
[8]周蔚,周彩存,孟淑燕,等.靶向肺癌的紫杉醇长循环脂质体抑瘤作用研究[J].肿瘤,2011,31(3):203-209.
[9]NGUYEN LN,MUNSHI A,HOBBS ML,et al.Paclitaxel restores radiation-induced apoptosis in a bcl-2-expressing,radiation-resistant lymphoma cell line.Cell survival analysis indicated that the combination of Taxol and radiation on cell killing was greater than additive[J].Int J Radiat Oncol Biol Phys,2001,49:1127.
[10]张晓静,张频.紫杉醇新剂型的开发及临床研究进展[J].癌症进展杂志,2007,5(1):6-72.
[11]KURDOGLU B,CHEONG N,GUAN J,et al.Apoptosis as a predictor of paclitaxel-induced radiosensitization in human tumor cell lines[J].Clin Cancer Res,1999;5(9):2580-2587.
[12]舒丹,陶德定,龚建平.流式细胞术的亚G1峰法分析细胞凋亡的重新评价[J].中华实验外科杂志,2000,17(1):59-60.
[13]NANCY A,YURI L.Caspases:Enemies within[J].Science,1998,281(5381):1312-1316.
[14]FERNANDES-ALNEMRI T,LITWACK G,ALNEMRI ES. CPP32 a novel human apoptotic protein with homology to Caenorhabditis elegans cell death protein Ced-3 and mammalian interleukin-1 betaconverting enzyme[J].J Biol Chem,1994,269:30761-30764.
[15]TSUJIMOTO Y,COSSMAN J,JAFFE E,et al.Involvement of the bc1-2 gene in human follicular lymphoma[J].Science,1985,228(47):1440-1443.
(编辑 韩维栋)
Effect of paclitaxel liposome on the radiosensitization in breast cancer cell line SK-BR-3 and related mechanisms
YAO Xuan1,ZHAO Ling2,LI Suo-ni3,SHI Ting-ting4,YAO Yu4
(1.Department of General Surgery,Central Hospital of Xi'an,Xi'an 710003;2.Department of Oncology,Central Hospital of Zhengzhou,Zhengzhou 450000;3.Department of Oncology,Tumor Hospital of Shaanxi,Xi'an 710061;4.Department of Oncology,the Eirst Affiliated Hospital of Xi'an Jiaotong University Health Science Center,Xi'an 710061,China)
Objective To explore the effect of paclitaxel liposome on the radiosensitization in breast cancer cell line SK-BR-3 and its related mechanisms.Methods MTT assay was used to test the inhibitory effect of paclitaxel liposome on breast cancer cell line SK-BR-3.Flow cytometry was used to detect the cell cycle and apoptosis.Western blot was used to detect apoptosis-related proteins Bcl-2,Bax and Casepase-3.Results Paclitaxel liposome combined with radiotherapy could inhibit cell growth more significantly than single paclitaxel liposome or single radiotherapy(P<0.05).The number of apoptotic cells increased more significantly in the combination group than in radiotherapy group or single paclitaxel liposome group(P<0.05).The combination grouphad an obvious apoptosis peak during the cell cycles.Western blot results showed that the expressions of Caspase-3 and Bax were significantly upregulated in radiotherapy group,single paclitaxel liposome group and the combination group compared with the control group(P<0.05),and that the effect was more obvious in the combination group(P<0.05).The expression of the anti-apoptosis protein Bcl-2 was downregulated in radiotherapy group,single paclitaxel liposome group and the combination group compared with the control group(P<0.05),and the effect was more obvious in the combination group(P<0.05).Conclusion Through regulating the expression of apoptosis-related proteins,paclitaxel liposome has an obvious radiosensitization effect.
breast cancer;radiosensitization;paclitaxel liposome;apotosis;cell cycle;Caspase;Bcl-2;Bax
R73-36
A
10.7652/jdyxb201505011
2015-01-22
2015-04-01
陕西省科技攻关资助项目(No.2013K12-03-12)Supported by Science and Technology Research Fund of Shaanxi Province(No.2013K12-03-12)
姚煜.E-mail:13572101611@163.com
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20150720.1740.014.html(2015-07-20)

