Fgl2-shRNA基因沉默对糖尿病大鼠心功能的改善及心肌病理形态变化
俞芽法,郑振中
(1.南昌大学第一附属医院心内科,江西南昌 330006;2.江西省抚州市第一人民医院心内科,江西抚州 344000)
Fgl2-shRNA基因沉默对糖尿病大鼠心功能的改善及心肌病理形态变化
俞芽法1,2,郑振中1
(1.南昌大学第一附属医院心内科,江西南昌 330006;2.江西省抚州市第一人民医院心内科,江西抚州 344000)
目的 探讨慢病毒介导的纤维介素(fgl2)基因沉默对糖尿病(DM)大鼠心功能的影响及其在心肌组织中的表达。方法 雄性SD大鼠腹腔注射STZ建立DM模型,随机分组为fgl2基因沉默组、GEP空载体组、DM模型组(DM组),基因沉默及GEP空载体组分别尾静脉注射慢病毒载体1×109IU,DM组注射生理盐水;另设对照组(各组8只)。14周后超声检测左室射血分数(LVEE)、左室短轴缩短率(即缩短分数,ES)、心率(HR)等,心肌组织进行HE染色观察病理形态及免疫组化染色检测fgl2表达。结果 DM组大鼠LVEE、ES降低,HR减少;HE染色示心肌纤维排列紊乱、纵横纹模糊、部分区域变性等;免疫组化fgl2染色示微血管内及周围大量棕黄色絮状染色。fgl2基因沉默组LVEE、ES、HR较DM组提高,差异有统计学意义(P<0.05);病理形态学表现为心肌纤维排列稍紊乱;免疫组化结果显示微血管内少量棕黄色絮状染色,较DM组明显减少,灰度值差异有统计学意义(P<0.05)。结论 Egl2基因沉默下调DM大鼠心肌fgl2表达,改善病理形态,抑制心室重构,保护心脏功能。
纤维介素(fgl2);糖尿病;糖尿病心肌病;基因沉默;心室重构
糖尿病(diabetes mellitus,DM)是当今严重危害人类健康的主要慢性疾病之一。DM心肌病(diabetic cardiomyopathy,DCM)是其主要心血管并发症,表现为舒张及收缩功能不全、心力衰竭等。纤维介素(fibrinogen-like protein 2,fgl2)蛋白属于纤维蛋白原家族,由活化的巨噬细胞及内皮细胞表达,具有fgl2的活力,能催化凝血酶原转化为凝血酶,启动凝血过程[1]。近年的研究表明,fgl2与多种疾病有相关性[2],可能参与DM心肌微循环中微血栓的形成。慢病毒载体是以人类免疫缺陷I型病毒(HIV-1)为基础发展起来的基因治疗载体,其特点是对分裂期细胞和非分裂期细胞均具有感染能力,其感染效力高并可在宿主体内长期稳定表达[3]。本研究通过RNA干扰特异性沉默fgl2基因,观察1型DM大鼠模型心肌fgl2表达、心肌病理形态及心脏功能变化,探讨DCM的可能机制。
1 材料与方法
1.1 材料清洁级雄性Sprague-Dawley SD大鼠,体质量200~220 g,南昌大学实验动物中心提供;链尿佐菌素(streptozotocin,STZ,美国Sigma公司);fgl2-ShRNA慢病毒载体由上海吉凯公司包装及测定病毒滴度;血糖仪及试纸(长沙三诺有限公司);辣根酶标记山羊抗小鼠IgG(H+L)(北京中杉金桥);免疫组化试剂盒(江苏碧云天生物技术研究所);多功能心脏彩色多普勒超声仪(美国GE公司);光学显微镜(日本Olympus公司);HMIAS2000高清晰度医学彩色图文分析系统(武汉干屏)。
1.2 模型制备及分组模型制备参阅文献[4]并进行改进,雄性SD大鼠40只,常规饲料适应性饲养1周,随机分组。32只空腹给予柠檬酸缓冲液稀释的STZ 60 mg/kg腹腔注射,第3天重复注射相同剂量,3 d及1周后测尾静脉血糖,以空腹≥16.6 mmol/L为DM成模型标准。成模稳定后2周,排除血糖不达标大鼠,符合DM模型大鼠24只,随机分为DM组、DM空载体组(GEP组)、fgl2基因沉默组(fgl2沉默组);并设对照组(NC组),各组n=8。基因沉默及GEP组分别尾静脉注射慢病毒载体1×109IU,DM组注射1 m L生理盐水。各组大鼠普通饲料喂养,室温自然光照,通风良好,自由饮水。
1.3 心脏超声检测心脏功能第14周末将所有大鼠进行心脏彩超。每只大鼠空腹8 h后,腹腔注射100 g/L水合氯醛(350 mg/kg或0.3 mL/100 g)麻醉,仰卧位固定,剔去胸部毛发。使用GEvivid7彩色多谱勒超声诊断仪,探头选用10 s,采用12 MHZ高频率探头,在取胸骨旁左心室短轴二维超声图像后,通过M型超声获得舒张末及收缩末左心室内径,计算左室射血分数(left ventricular ejection fraction,LVEE)、左室短轴缩短率(即缩短分数,left ventricular short axis reduced rate,ES)及心率(heart rate,HR)。
1.4 心脏指数及病理形态学观察大鼠处死前称重,取出心脏后去除多余组织并用生理盐水冲洗,滤纸吸干,称重,计算心脏质量与大鼠质量比值为心脏指数(mg/g)。
取左心室心肌,常规中性甲醛固定、石蜡包埋、切片,脱蜡至水,HE染色,光学显微镜下观察并摄片。
1.5 免疫组化检测心肌fgl2表达按照免疫组织化学染色二步法试剂盒说明书操作。心肌组织石蜡切片脱蜡至水,PBS配制新鲜的30 m L/L H2O2室温封闭,微波炉修复抗原,滴加1∶50稀释的一抗fgl2,置湿盒37℃孵育2 h,滴加生物素化二抗,37℃30 min,DAB显色,苏木素复染色1 min,PBS冲洗返蓝;碳酸锂浸2 s,脱水、脱乙醇、室温风干、中性树脂封片。采用HMIAS2000高清晰度医学彩色图文分析系统,应用普通光学显微镜进行判读,阳性表达为棕黄色或棕褐色,阳性表达部位在微血管周围,染色明显高于背景。每张切片随机选取5个不重叠视野(×400)摄片,观察并计算灰度值。
1.6 统计学分析应用SPSS 17.0软件进行统计学分析,实验数据以均数±标准差(±s)表示,组间比较在满足正态性和方差齐性的条件下,采用单因素方差分析,两两比较采用配对因素t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 各组血糖测定结果采用连续2次腹腔注射STZ法,32只大鼠有3只血糖未达标,成功率90.6%。选取符合标准的DM大鼠24只随机分组进行实验干预。各模型组大鼠血糖差异无统计学意义(P>0.05),分别为DM组(23.08±4.05)mmo/L,GEP组(19.91±3.56)mmol/L,fgl2沉默组(21.60± 3.63)mmol/L,均比NC组的(4.94±0.57)mmol/L明显升高,差异有统计学意义(P<0.05)。
2.2 心脏超声检测心功能及心脏指数DM组、GEP组的LVEE、ES较NC组降低,差异有统计学意义(P<0.05);HR降低,心脏指数增加,差异有统计学意义(P<0.01);DM组与GEP组的LVEE、ES、HR、心脏指数差异均无统计学意义(P>0.05);与正常组比较,fgl2沉默组LVEE、ES降低而心脏指数增加,差异有统计学意义(P<0.05);fgl2沉默组与DM组及GEP组比较,LVEE、ES、HR及心脏指数差异有统计学意义(P<0.05,表1)。
表1 各组大鼠心功能和心脏指数的变化Tab.1 The changes of cardiac function and cardiac index of rats(±s,n=8)

表1 各组大鼠心功能和心脏指数的变化Tab.1 The changes of cardiac function and cardiac index of rats(±s,n=8)
与NC组比较,#P<0.05,##P<0.001;与fgl2沉默组比较,*P<0.05。
组别LVEE(%)ES(%)HR(次/min)心脏指数(mg/g)81.99±1.763 45.56±3.351 294.33±16.99 2.668±0.949 DM组66.16±2.316#*33.50±0.836#*211.66±31.88##*3.536±0.535##*GEP组67.50±2.509#*31.20±4.543#*206.66±24.22##*3.813±0.169#*Egl2沉默组75.83±4.708#39.50±3.834#245.00±28.80##3.157±0.799 NC组#
2.3 各组心肌病理切片HE染色NC组光镜下心肌细胞心肌纤维形态结构基本正常;DM组及GEP组心肌纤维排列紊乱、心肌细胞肥大、细胞核大小不甚规则、心肌细胞存在不同程度的变性;心肌纤维混浊、纵横纹模糊、部分区域出现局灶性坏死,同时伴有不同程度的凝固性坏死;fgl2沉默组心肌病理形态稍有改变,表现为心肌纤维排列稍紊乱,但与DM组及GEP组比较,无明显心肌纤维混浊、变性、坏死等(图1)。

图1 各组心肌组织的HE染色Eig.1 The pathological changes of heart tissue by HE staining(×200)
2.4 各组fgl2免疫组化染色结果fgl2免疫组化阳性染色为黄色及棕黄色絮状染色。DM组及GEP组明显高表达,表达部位为血管、微血管等内皮细胞棕黄色絮状染色,及心肌细胞细胞核黄色及棕黄色特异性染色;NC组血管及微血管处未见明显絮状特异性染色,心肌细胞细胞核极少量棕黄色染色;fgl2沉默组可见血管、微血管内及周围少量表达。DM组(157.60± 17.52)及GEP组(159.80±2.77)与正常组(182.20 ±5.26)比较差异有统计学意义(P<0.05),fgl2沉默组(178.20±2.28)与DM组及GEP组比较差异有统计学意义(P<0.05,图2)。
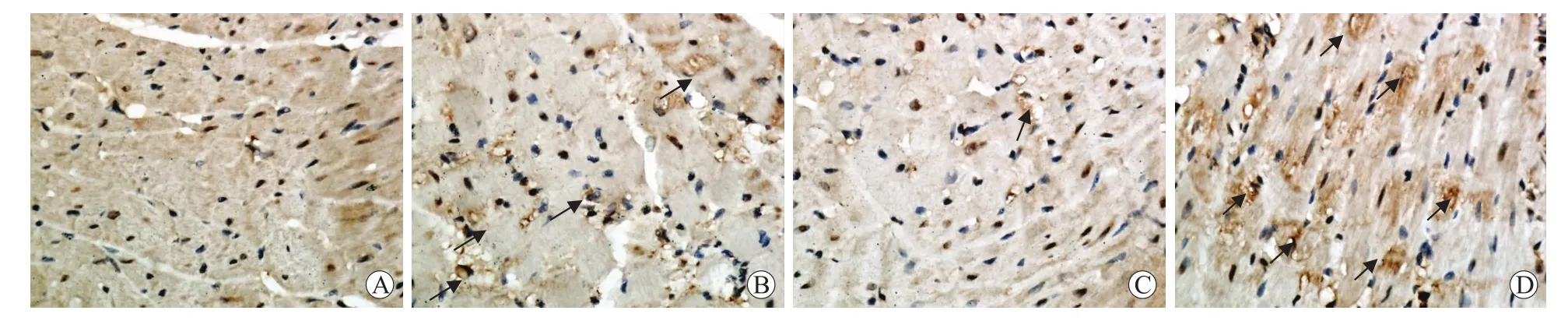
图2 各组fgl2免疫组化染色结果Eig.2 The immunohistochemical staining of fgl2 in each group(×400)
3 讨 论
DCM的概念已得到公认,糖尿病被视为心血管疾病发病和死亡的主要独立性危险因子[5-6]。DCM发病机制复杂[7],如高血糖、高血脂所致心肌代谢紊乱、微血管病变、心肌纤维化及心脏自主神经功能紊乱等所致的心肌结构异常,可引起左心室肥厚、舒张期和(或)收缩期功能障碍,最终心律失常、心力衰竭等。fgl2属纤维蛋白原相关蛋白超家族,主要由活化的巨噬细胞及内皮细胞产生。早期研究发现参与暴发性肝炎、自发性流产、同种和异种急性移植排斥反应等[8-10]。与经典凝血途径不同,它可直接催化凝血酶原转变成有活性的凝血酶而促凝血,LEVY等[11]将fgl2促凝途径称为“免疫凝血”。近来研究发现fgl2受多种细胞因子调控,具有促凝血和促炎症的双重作用,国内学者发现T2DM组大鼠心脏微血管内皮细胞中可见fgl2高表达,且表达量与微血栓的阳性血管数正相关[2]。由此推断,fgl2凝血酶原酶可能参与DM心肌微循环中微血栓的形成,进一步加重微循环障碍而促进DM的微血管病变的发生和发展。
慢病毒载体是以人类免疫缺陷Ⅰ型病毒(HIV-1)为基础发展起来的基因治疗载体,因其对分裂期细胞和非分裂期细胞均具有感染能力(如神经细胞),不易诱发免疫反应,感染效力高,并可在宿主体内长期稳定表达[3]。前期,我们构建了fgl2-sh RNA慢病毒基因载体[12-13],在大鼠心肌微血管内皮细胞的实验研究发现fgl2基因沉默促进心肌微血管内皮细胞MMVECs的增殖、迁移[14-15]。DM微血管病主要表现基底膜增厚、血栓形成、心肌细胞变性、心肌纤维化等,而针对特异性沉默fgl2基因是否改善DM心脏微血管病的发生、发展。本研究采用尾静脉注射法建立慢病毒介导的fgl2-sh RNA基因沉默DM大鼠模型,采用超声检测DM大鼠心功能,发现DM大鼠心脏LVEE、LVSE、HR明显降低;fgl2基因沉默组大鼠心脏LVEE、LVSE、HR等较DM组明显改善。虽然基因沉默组DM大鼠体质量及症状无明显改善,但检测各组大鼠心脏指数,结果显示DM大鼠心脏指数增加,fgl2基因沉默组大鼠心脏指数减低,心肌肥厚及心脏功能改善。心肌代谢紊乱、细胞坏死及心肌细胞纤维化是DCM特征性病理表现。本研究大鼠心肌病理切片的观察发现,fgl2基因沉默组表现为心肌纤维排列稍紊乱,但无明显心肌纤维混浊、变性、坏死等,较DM组心肌细胞病理形态明显改善。
通过fgl2免疫组化染色显示,DM大鼠心肌微血管内、周围及心肌细胞核大量棕黄色絮状物及棕黄染,正常组无明显黄染;fgl2-shRNA基因沉默组微血管内可见少量黄色及少量絮状染色,心肌细胞细胞核极少量棕黄异性染色。根据DM大鼠心肌微血管内皮细胞及周围fgl2高表达,说明fgl2参与微血管内微血栓形成;fgl2-shRNA基因沉默下调fgl2表达,降低微血管内血栓形成和心肌细胞变性坏死,抑制心室重构等。同时提示基因沉默模型成功建立。
总之,fgl2可能参与DCM微血管病的发生发展,fgl2基因沉默下调其表达,改善心肌细胞病理结构,抑制心室重构,保护心脏功能。
[1]ZHU C,SUN Y,LUO X,et al.Novel mfgl2 antisense plasmid inhibits murine fgl2 expression and ameliorates murine hepatitis virus type 3-induced fulminant hepatitis in BALB/cJ mice[J]. Hum Gene Ther,2006,17(6):589-600.
[2]DING YP,LIU K,WANG Y,et al.Expression and significance of fgl2 prothrombinase in cardiac microvascular endothelial cells of rats with type 2 diabetes[J].J HUAZHONG U SCIMED,2010,30(5):575-811.
[3]YACOUB N,ROMANOWSKA M,HARITONOVA N,et al.Optimized production and concentration of lentiviral vectors containing large inserts[J].J Gene Med,2007,9(7):579-584.
[4]黄鑫,李兵公,郑泽琪,等.神经调节蛋白-1对糖尿病心肌病大鼠心肌重构的影响[J].中国药理学通报,2011,27(11):1532-1536.
[5]BERRY C,BRETT M,STEVENSON K,et al.Nature and prognostic importance of abnormal glucose tolerance and diabetes in acute heart failure[J].Heart,2008,9(3):296-304.
[6]ASBUN J,VILLARREAL FJ.The pathogenesis of myocardial fibrosis in the setting of diabetic cardiomyopathy[J].Am Coll Cardiol,2006,47(4):693-700.
[7]NING Q,BROWN D,PARODO J,et al.Ribavirin inhibits viral induce macrophage production of TNF,IL-1,the proccegulant fgl2 prothrombinase and preserves Thl cytokine production but inhibits Th2 cytokine response[J].J Immunol,1998,160(7):3487-3493.
[8]孙奕,宁琴,李锦文,等.鼠纤维介素参与小鼠心脏移植急性排斥反应的作用及其意义[J].中华器官移植杂志,2003,24(5):294-297.
[9]NING Q,SUN Y,HAN M,et al.Role of fibrinogen-like protein2 prothrom-binase/fibroleukin in experimental and human allograft rejection[J].J Immunol,2005,174(11):7403-7411.
[10]GHANEKAR A,MENDICINO M,LIU H,et al.Endothelial induction of fgl2 contributes to thrombosis during acute vascular xenograft rejection[J].J Immunol,2004,172(9):5693-5701.
[11]LEVY GA,LIU MF,DING JW.et al.Molecular and functional analysis of the human prothrombinase gene(HFGL2)and its role in viral hepatitis[J].Am J Pathol,2000,156(4):1217-1212.
[12]王慧方,郑振中.FGL2基因RNAi慢病毒载体的构建及外源性筛选与鉴定[J].安徽医科大学学报,2012,47(10):1165-1168.
[13]ZHENG ZH,WANG L,WANG HF,et al.Fibrinogen-like protein 2 gene silencing activates angiopoietin/Tie system and induces myocardial microvascular endothelial cells proliferation and cell migration[J].Biomed Res,2012,23(1):37-42.
[14]郑振中,王亮,吴友平,等.慢病毒介导fgl2基因沉默对心肌微血管内皮细胞Ang-1、Ang-2m RNA表达及细胞增殖、迁移的影响[J].郑州大学学报:医学版,2013,48(1):28-31.
[15]王亮,吴友平,郑振中,等.慢病毒介导sh RNA沉默人纤维介素基因对心肌微血管内皮细胞增殖的影响[J].中国老年学杂志,2014,34(11):3030-3032.
(编辑 国 荣)
Effects of Fgl2 gene silencing on cardiac function and myocardial pathologic morphology in diabetic rats
YU Ya-fa1,2,ZHENG Zhen-zhong1
(1.Department of Cardiology,the Eirst Affiliated Hospital of Nanchang University,Nanchang 330006;2.Department of Cardiology,the Eirst People's Hospital of Euzhou City,Euzhou 344000,China)
Objective To investigate the effects of fibrinogen-like protein 2(fgl2)gene silencing mediated by lentivirus on cardiac function in diabetes mellitus(DM)rats and its expression in myocardial tissue.Methods Adult male Sprague-Dawley rats were randomly divided into control group and model group.Streptozotocin(STZ)was injected intraperitoneally in model group.Diabetes rats were randomly divided into①fgl2-LV RNAi group(n =8)fgl2 lentivirus vector 1×109IU/n,injected by tail vein rapidly,②GFP-lentivirus sh-RNAi group(n=8),GFP-lentivirus sh-RNAi 1×109IU/n injected rapidly by tail vein;③diabetes group,saline solution injected by tail vein.Cardiac functions of the rats including left ventricular ejection fraction(LVEF),left ventricular short axis reduced rate(FS),and heart rate(HR)were tested by ultrasonic method after 14 weeks.Myocardial tissue was fixed by formaldehyde for pathological slices.The pathological morphology was observed by HE staining and the expression of fgl2 was detected by immunohistochemical method.Results The cardiac functions of DM rats were impaired.LVEF,FS and HR were reduced;the arrangement of myocardial fibers was disordered;myocardial fibers were blurry with degeneration in some regions.A lot of brownish yellow flocculent staining of fgl2 could be observed in and around myocardial microvessels in diabetic group.LVEF,FS and HR increased significantly in fgl2 sh RNAi group compared with DM group(P<0.05).The arrangement of myocardial fibers was disorderly,and a small amount of brownish yellow flocculent dyeing within microvessels was shown byimmunohistochemical method.Thegray value decreased significantly compared with that in DM group(P<0.05).Conclusion Fgl2 gene silencing may downregulate the expression fgl2 in the myocardium of DM rats,improve pathologic morphology,and inhibit ventricular remodeling,thus protecting heart function.
fibrinogen-like protein 2(fgl2);diabetes mellitus;diabetic cardiomyopathy;gene silencing;diabetes mellitus;ventricular remodeling
R587.1
A
10.7652/jdyxb201505006
2014-05-27
2015-04-01
国家自然科学基金资助项目(No.81260044;30960119);江西省科技支撑计划项目(No.2010BSA12000)Supported by the National Natural Science Foundation of China(No.81260044,30960119)and Science Support Project of Jiangxi Province(No.2010BSA12000)
郑振中.E-mail:grteful@163.com
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20150814.1554.002.html(2015-08-14)

