IGF-Ⅱ对肝癌细胞MHCC97-H癌基因C-myc和N-ras表达的影响
姬媛媛,王志东,杨正安,王宝太,史 敏,惠 博,雷妮娜,岳卫娜
(西安交通大学医学部第二附属医院:1.科研中心实验室;2.干四病区普通外科,陕西西安 710004)
IGF-Ⅱ对肝癌细胞MHCC97-H癌基因C-myc和N-ras表达的影响
姬媛媛1,王志东2,杨正安2,王宝太2,史 敏2,惠 博2,雷妮娜2,岳卫娜2
(西安交通大学医学部第二附属医院:1.科研中心实验室;2.干四病区普通外科,陕西西安 710004)
目的 观察胰岛素样生长因子Ⅱ(IGE-Ⅱ)对肝癌细胞MHCC97-H中癌基因C-myc和N-ras表达的影响。方法 培养肝癌细胞株MHCC97-H,用IGE-Ⅱ(50 ng/m L)作用48 h后,分别采用细胞免疫荧光、Western blot法及Real-time PCR法检测细胞中C-myc和N-ras的表达情况,并与对照组比较,进行定量分析。结果 C-myc及N-ras蛋白阳性表达主要位于细胞核。对照组、IGE-Ⅱ组MHCC97-H细胞中C-myc荧光表达量分别为(100.00±2.89)%、(254.00±35.57)%,N-ras荧光表达量分别为(100.00±14.43)%、(257.30±22.43)%。与对照组相比,IGE-Ⅱ组MHCC97-H细胞中C-myc及N-ras蛋白表达明显增强,差异有统计学意义(P<0.05)。与对照组相比,IGE-Ⅱ组MHCC97-H细胞中C-myc和N-ras的mRNA表达明显增加,差异有统计学意义(P<0.05)。结论 IGE-Ⅱ可上调肝癌细胞MHCC97-H中癌基因C-myc和N-ras的蛋白及mRNA表达,这可能是IGE-Ⅱ促进肝癌细胞增殖的分子机制之一,这为临床上肝癌防治提供了新线索。
胰岛素样生长因子Ⅱ(IGE-Ⅱ);肝癌;增殖;C-myc;N-ras
肝癌是我国常见的恶性肿瘤之一,具有易侵袭、转移及复发等特点。肝癌的高侵袭转移是导致患者预后不良及临床疗效不佳的关键环节[1]。细胞生长增殖是肝癌侵袭转移的始动因素,在肝癌发生发展的过程中居于要位[2]。癌基因的突变可致其功能异常活化,通过促使细胞持续生长增殖,继而诱导大量肝细胞癌变[3]。胰岛素样生长因子Ⅱ(insulin-like growth factor-Ⅱ,IGE-Ⅱ)作为一种增殖调控因子,在细胞分化、增殖、胚胎的生长发育中发挥着重要的促进作用[4]。前期研究已证实,IGE-Ⅱ具有刺激肝癌细胞生长增殖的功能,然而,IGE-Ⅱ与癌基因表达之间的关系目前尚不清楚。因此,本实验以IGE-Ⅱ作用于人肝癌细胞MHCC97-H,观察其对肝癌细胞MHCC97-H中癌基因(C-myc及N-ras)表达的影响,进一步明确IGE-Ⅱ对肝癌细胞增殖的作用机制,以期为临床上肝癌的防治提供新线索。
1 材料与方法
1.1 材料人肝癌细胞株MHCC97-H由复旦大学肝癌研究所提供;胎牛血清(EBS)和DMEM高糖培养基购自美国Hyclone公司;IGE-Ⅱ购自美国Sigma公司;RIPA裂解液来自北京百泰克生物技术有限公司;蛋白酶抑制剂(Cocktail)购自美国Roche公司;NC膜购自美国Millipore公司;化学发光试剂ECL购自美国Pierce公司;兔抗人β-actin抗体购自美国Proteintech公司,兔抗人C-myc和N-ras抗体购自美国Abcam公司,羊抗兔IgG-HRP抗体由陕西先锋生物科技有限公司提供;总RNA提取试剂盒购自陕西先锋生物科技有限公司;逆转录试剂盒、SYBR Premix Ex TaqTMPerfect Real Time试剂盒购自TaKaRa宝生物工程有限公司,荧光实时定量PCR仪型号为美国Applied Biosystems StepOne;C-myc、N-ras及β-actin引物由TaKaRa宝生物工程有限公司合成。
1.2 细胞培养将人肝癌细胞株MHCC97-H接种在DMEM高糖完全培养基(100 m L/L EBS、100万U/L青霉素及100 mg/L链霉素)中,培养于37℃、50 m L/L CO2的细胞培养箱中,每2~3 d进行1次传代,选取处于对数生长期的细胞用于后续实验。
1.3 细胞免疫荧光法MHCC97-H细胞弃去培养液,加入含5 m L/L EBS的DMEM高糖完全培养基培养24 h同步化后,予以IGE-Ⅱ(50 ng/m L)作用48 h,对照组加入无血清的DMEM培养基。采用细胞免疫荧光染色法检测MHCC97-H细胞中C-myc、N-ras的表达,简要步骤如下:细胞爬片经40 g/L多聚甲醛溶液固定,即用2.5 mL/L Triton X-100室温10 min,PBS冲洗5×3 min,正常山羊血清室温下封闭30 min,兔抗人一抗C-myc(1∶250)及N-ras(1∶50)4℃孵育过夜,PBS冲洗5×3 min,EITC标记羊抗兔二抗避光常温孵育2 h,最后用DAPI复染细胞核。实验重复3次,每组设3个复孔。用甘油封片,使用激光共聚焦显微镜观察并拍照,且对荧光染色结果进行定量分析。
1.4 Western blot检测蛋白表达IGE-Ⅱ(50 ng/mL)刺激MHCC97-H细胞48 h后,弃去培养液,冷PBS轻轻漂洗后,加入细胞冷裂解液,刮下裂解细胞置于2 m L Eppedorf管中,经细胞膜破碎仪反复抽打细胞3次后,静置于冰上20 min,12 000 r/min、4℃离心15 min,将上清待测蛋白样品于—20℃冰箱内保存。实验组、对照组的蛋白定量按照BCA蛋白定量试剂盒说明书进行操作。
Western blot检测简要步骤如下:待测样品蛋白20μg上样,经SDS-PAGE(50 g/L浓缩胶及100 g/L分离胶)电泳,半干式电转移法将蛋白转移到NC膜上。50 g/L脱脂奶粉封闭液封闭2 h,加入一抗(兔抗人C-myc 1∶10 000,兔抗人N-ras 1∶500,兔抗人内参β-actin 1∶1 000),4℃孵育过夜,TBST冲洗15 min× 4,加入HRP标记的羊抗兔二抗(1∶5 000),37℃孵育1 h,TBST冲洗15 min×4,立即用ECL显色,利用凝胶图像分析系统曝光蛋白条带,对图像进行拍照和定量分析。实验重复3次,每组设3个复孔。结果表示为:IGE-Ⅱ组蛋白表达量/正常对照组蛋白表达量。
1.5 Real-time PCR检测mRNA表达按照试剂盒说明操作提取总RNA,使用紫外分光光度计进行RNA浓度及纯度测定,—80℃冰箱保存。将2μg提取总RNA逆转录合成cDNA,具体操作按逆转录试剂盒说明进行。取逆转录产物2μL进行Realtime PCR循环扩增。其中目的基因C-myc的引物序列为:上游5'-GCAGCTGCTTAGACGCTGGA-3',下游5'-CGCAGTAGAAATACGGCTGCAC-3',扩增片段为136 bp;目的基因N-ras引物序列为:上游5'-GCACTGACAATCCAGCTAATCCA-3',下游5'-GTCCAACAAACAGGTTTCACCATC-3',扩增片段为111 bp;β-actin内参的引物序列为:上游5'-TGGCACCCAGCACAATGAA-3',下游5'-CTAAGTCATAGTCCGCCTAGAAGCA-3',扩增片段为186 bp。Real-time PCR扩增程序为:预变性:95℃30 s,1个循环;95℃5 s,60℃30 s,40个循环。实验重复3次,每组设3个复孔,每个样本做3个复管。使用ABI Real-time PCR扩增仪器中的软件求出各样本的Ct值,用2-△△Ct法计算出实验组基因表达与正常对照组基因表达比较的Eolds值。此外,取PCR产物8μL上样于15 g/L琼脂糖凝胶(含溴化乙锭),85 V电泳25 min,利用凝胶图像分析系统进行扫描并拍摄图片。结果表示为:IGE-Ⅱ组mRNA表达量/正常对照组m RNA表达量。
1.6 统计学分析所有数据均以±s表示,用Prism 5.0统计软件进行分析。数据首先进行了正态性分布和方差齐性检查,然后组间两两比较采用Student's t检验。P<0.05认为差异有统计学意义。
2 结 果
2.1 IGF-Ⅱ明显增加MHCC97-H细胞中C-myc的荧光表达共聚焦显微镜结果显示,IGE-Ⅱ(50 ng/m L)作用于MHCC97-H细胞48 h后,C-myc阳性染色为绿色,主要定位于细胞核,其在细胞质中未见表达,而DAPI将细胞核染为蓝色,绿色和蓝色可以完全重合,进而说明C-myc在细胞核表达。对照组、IGE-Ⅱ组MHCC97-H细胞中C-myc荧光表达量分别为(100.00±2.89)%、(254.00±35.57)%。与对照组相比,IGE-Ⅱ组MHCC97-H细胞中C-myc荧光表达量明显增强,差异有统计学意义(P=0.042,图1)。
2.2 IGF-Ⅱ明显增加MHCC97-H细胞中N-ras荧光表达共聚焦显微镜结果显示,IGE-Ⅱ(50 ng/m L)作用于MHCC97-H细胞48 h后,N-ras阳性染色为绿色,主要定位于细胞核,其在细胞质中未见表达,而DAPI将细胞核染为蓝色,绿色和蓝色可以完全重合,进而说明N-ras在细胞核表达。对照组、IGE-Ⅱ组MHCC97-H细胞中N-ras荧光表达量分别为(100.00±14.43)%、(257.30±22.43)%。与对照组相比,IGE-Ⅱ组MHCC97-H细胞中N-ras荧光表达量明显增强,差异有统计学意义(P=0.043,图2)。
2.3 IGF-Ⅱ上调MHCC97-H细胞中C-myc和N-ras蛋白表达Western blot检测对照组、IGE-Ⅱ组MHCC97-H细胞中C-myc蛋白相对表达量分别为1.00 ±0.00、3.45±0.50;N-ras蛋白相对表达量分别为1.00 ±0.00、2.93±0.24。与对照组相比,IGE-Ⅱ组MHCC97-H细胞中C-myc和N-ras蛋白表达量明显增加,差异有统计学意义(P=0.039、P=0.016,图3)。
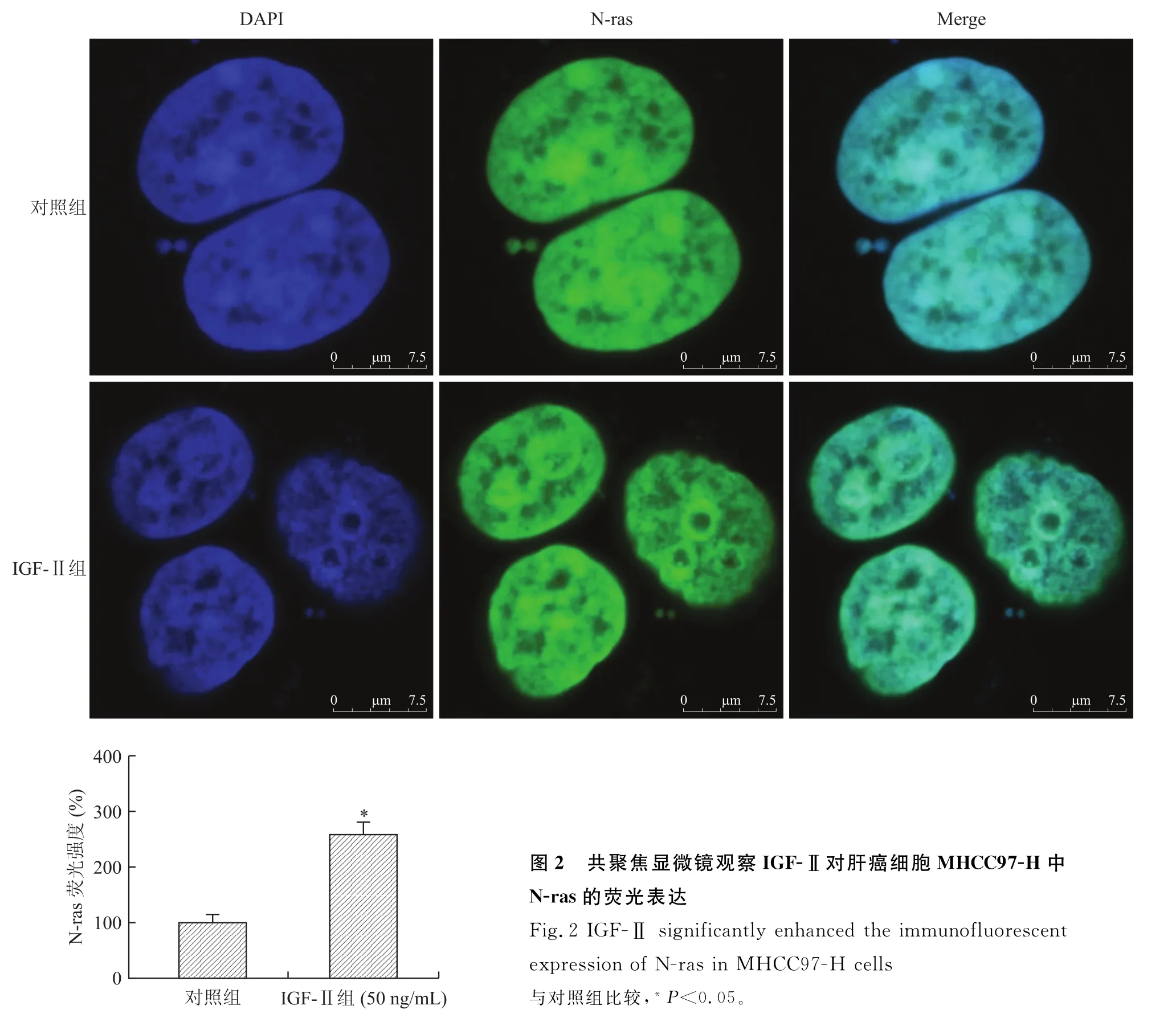
图2 共聚焦显微镜观察IGF-Ⅱ对肝癌细胞MHCC97-H中N-ras的荧光表达Eig.2 IGE-Ⅱsignificantly enhanced the immunofluorescent expression of N-ras in MHCC97-H cells

图3 Western blot检测肝癌细胞MHCC97-H中C-myc和N-ras蛋白表达Eig.3 Expressions of C-myc and N-ras in MHCC97-H cells detected by Western blot
2.4 IGF-Ⅱ上调MHCC97-H细胞中C-myc mRNA水平Real-time PCR检测对照组、IGE-Ⅱ组MHCC97-H细胞中C-myc mRNA相对表达量分别为1.00±0.00、3.98±0.34。与对照组相比,IGE-Ⅱ组MHCC97-H细胞中C-myc mRNA表达量明显增加,差异有统计学意义(P=0.013,图4)。
2.5 IGF-Ⅱ上调MHCC97-H细胞中N-ras mRNA水平Real-time PCR检测对照组、IGE-Ⅱ组MHCC97-H细胞中N-ras m RNA相对表达量分别为1.00±0.00、3.16±0.34。与对照组相比,IGE-Ⅱ组MHCC97-H细胞中N-ras mRNA表达量明显增加,差异有统计学意义(P=0.024,图5)。
3 讨 论
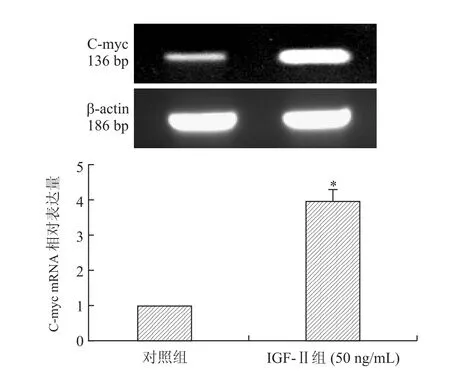
图4 Real-time PCR检测IGF-Ⅱ对肝癌细胞MHCC97-H中C-myc mRNA表达变化Eig.4 IGE-Ⅱupregulated the mRNA expression of C-myc in MHCC97-H cells

图5 Real-time PCR检测IGF-Ⅱ对肝癌细胞MHCC97-H中N-ras mRNA的表达变化Eig.5 IGE-Ⅱupregulated the m RNA expression of N-ras in MHCC97-H cells
目前研究认为,癌细胞的恶性转化是一个由细胞外多种促生长因子激活细胞内信号转导通路的异常活化,使得癌细胞内多种癌基因或者抑癌基因表达异常,继而促进癌细胞异常增殖的多步骤、多阶段的复杂过程。癌基因在调控肿瘤细胞的增殖过程中发挥着重要作用,而癌基因突变被认为是肝癌细胞增殖的分子基础[5]。常见的肿瘤癌基因有转化基因(N-ras)、增殖相关基因(C-myc)等。其中转化基因N-ras被认为是肝癌中最早发现的恶性转化基因,其可以导致肝细胞不断生长增殖而使细胞最终发生癌变[5]。新近研究发现,增殖相关基因C-myc的活化与大量肝细胞的癌变关系密切,并且其还直接参与诱导肝细胞癌前病变过程的形成[6]。
目前认为,生长因子IGE-Ⅱ在肝细胞的癌变过程中亦发挥重要作用,在转基因鼠、化学诱癌鼠等动物模型以及肝炎病毒慢性感染的肝组织中获得证实[7]。此外,我们前期实验研究也发现,不同浓度的IGE-Ⅱ(25、50、100 ng/m L)作用于肝癌细胞MHCC97-H不同时间点(24、48、72 h)后,对MHCC97-H细胞的生长增殖有一定的促进作用。因此,本实验以IGE-Ⅱ(50 ng/m L)刺激人肝癌细胞MHCC97-H 48 h,进一步观察其对肝癌细胞MHCC97-H中癌基因C-myc及N-ras表达的影响,进而明晰相关分子机制。本研究利用细胞免疫荧光、Western blot及Real-time PCR等方法,从蛋白及mRNA水平对MHCC97-H中C-myc及N-ras的表达进行定性、定位及定量分析。结果表明,IGE-Ⅱ可明显上调MHCC97-H细胞中癌基因C-myc及N-ras蛋白及mRNA表达,说明IGE-Ⅱ信号通路与C-myc及N-ras癌基因的表达途径上有交汇点,可以相互促进,而癌基因的过度表达又可进一步导致肝癌发生发展。
C-myc基因是myc基因家族的成员之一,作为原癌基因其编码的蛋白质属于核内转录因子,介导细胞外向细胞核内生物信号转导,在细胞凋亡和细胞增殖的调控中发挥着重要作用[8-10]。以前的研究发现,C-myc蛋白在肝癌组织中呈现出高度表达,而在癌旁组织中呈现出低表达,在正常肝组织中则表达更少;进一步的研究还显示,C-myc的蛋白表达与肝癌患者的年龄、性别、肿瘤大小及分化程度无关,而与肝癌的侵袭转移高度相关,提示C-myc的表达增强与肝癌的发生发展关系密切,可以作为判断肝癌是否发生转移的指标之一,与肝癌患者的预后密切相关[11-12]。研究证实,N-ras原癌基因通过G蛋白偶联受体信号转导通路发挥生物学效应,其表达异常被认为是肝癌发生恶性转化较早的分子表达变化,其表达水平随肝癌的恶性分化程度而逐渐增强,并且N-ras基因的表达水平增高还为癌变的肿瘤细胞提供了良好的生长环境[13-14]。此外研究报道,C-myc和N-ras基因的表达水平增高,还与肝细胞的增殖调控失衡以及肝癌进展密切相关。IGE-Ⅱ被认为是多种肿瘤细胞重要的自分泌生长因子,其过度表达具有明显的促进细胞增殖及细胞恶性转化的作用[15]。本实验结果显示IGE-Ⅱ作用时,癌基因C-myc、N-ras表达上调,提示可能是IGE-Ⅱ促进肝癌细胞增殖的分子机制之一,亦为临床上肝癌的防治提供了一些新线索。
[1]LI D,KANG J,GOLAS BJ,et al.Minimally invasive local therapies for liver cancer[J].Cancer Biol Med,2014,11(4):217-236.
[2]SUN Y,SONG GD,SUN N.Slug overexpression induces stemness and promotes hepatocellular carcinoma cell invasion and metastasis[J].Oncol Lett,2014,7(6):1936-1940.
[3]于秀石,关媛媛,田菊霞.肝癌发生的相关分子机制研究进展[J].健康研究,2010,30(5):390-393.
[4]WENG CJ,HSIEH YH,TSAI CM,et al.Relationship of insulin-like growth factors system gene polymorphisms with the susceptibility and pathological development of hepatocellular carcinoma[J].Ann Surg Oncol,2010,17(7):1808-1815.
[5]HO C,WANG C,MATTU S,et al.AKT(v-akt murine thymoma viral oncogene homolog 1)and N-Ras(neuroblastoma ras viral oncogene homolog)coactivation in the mouse liver promotes rapid carcinogenesis by way of m TOR(mammalian target of rapamycin complex 1),FOXM1(forkhead box M1)/ SKP2,and c-Myc pathways[J].Hepatology,2012,55(3):833-845.
[6]XIAO W,WANG J,OU C,et al.Mutual interaction between YAP and c-Myc is critical for carcinogenesis in liver cancer[J]. Biochem Biophys Res Commun,2013,439(2):167-172.
[7]陆园园,姚登福,吴信华,等.肝癌及癌旁组织IGF-I受体表达及临床病理学特征[J].南通大学学报:医学版,2008,28(3):169-171.
[8]SHIRAHA H,YAMAMOTO K,NAMBA M.Human hepatocyte carcinogenesis(review)[J].Int J Oncol,2013,42(4):1133-1138.
[9]LIN F,DING R,ZHENG S,et al.Decrease expression of micro RNA-744 promotes cell proliferation by targeting c-Myc in human hepatocellular carcinoma[J].Cancer Cell Int,2014,14:58.
[10]张艳,程旭芳,黄刚,等.新型核苷类似物FNC对Raji细胞增殖、凋亡和Bcl-6、PRDM1、C-myc表达的影响[J].郑州大学学报:医学版,2013,48(4):450-454.
[11]杨闯,魏振彤,郑宇,等.肝癌中Bcl-2、Bax和C-myc基因的表达及其临床意义[J].中国老年学杂志,2009,29(2):450-451.
[12]李莉,刘利锋,武彦宁,等.肝癌组织中C-myc基因突变的研究[J].临床荟萃,2013,28(9):976-978.
[13]TAKETOMI A,SHIRABE K,MUTO J,et al.A rare point mutation in the Ras oncogene in hepatocellular carcinoma[J]. Surg Today,2013,43(3):289-292.
[14]LUO D,LIU QF,GOVE C,et al.Analysis of N-ras gene mutation and p53 gene expression in human hepatocellular carcinomas[J].World J Gastroenterol,1998,4(2):97-99.
[15]杨季红,程树杰.IGF-2和H19与肿瘤关系的研究进展[J].河北医药,2011,33(18):2836-2639.
(编辑 国 荣)
Effect of IGF-Ⅱon C-myc and N-ras expressions in MHCC97-H cells
Objective To investigate the effect of insulin-like growth factor-Ⅱ(IGF-Ⅱ)on the expressions of oncogenes(C-myc and N-ras)in MHCC97-H cells.Methods Human HCC cell lines(MHCC97-H)were cultured and stimulated with IGF-Ⅱ(50 ng/m L)for 48 h.The expressions of C-myc and N-ras were identified with immunofluorescence.Furthermore,the protein expressions of C-myc and N-ras were detected by Western blot. mRNA levels of C-myc and N-ras were determined by Real-time PCR.Results Positive expressions of C-myc and N-ras could be found in the nucleus of MHCC97-H cells.Compared with those in the controls,immunofluorescent expressions of C-myc and N-ras were evidently enhanced by IGF-Ⅱ(P<0.05).Moreover,protein expressions of C-myc and N-ras were significantly increased by IGF-Ⅱ(P<0.05).m RNA levels of C-myc and N-ras were also obviously increased by IGF-Ⅱ(P<0.05).Conclusion IGF-Ⅱcan upregulate the expressions of oncogenes C-myc and N-ras in MHCC97-H cells,thus inducing the proliferation of hepatocellular carcinoma.
insulin-like growth factor-Ⅱ(IGF-Ⅱ);hepatocellular carcinoma;proliferation;C-myc;N-ras
R735.7
A
10.7652/jdyxb201505004
2015-02-16
2015-04-23
国家自然科学基金资助项目(No.81201925);西安交大二院人才培养专项科研基金资助项目[No.RC(GG)201404]Supported by the National Natural Science Eoundation of China(No.81201925)and Personnel Training Specialized Research Eoundation of the Second Affiliated Hospital of Xi'an Jiaotong University(No.RC(GG)201404).
王志东.E-mail:xawzd@163.com
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20150720.1640.010.html(2015-07-20)
JI Yuan-yuan1,WANG Zhi-dong2,YANG Zheng-an2,WANG Bao-tai2,SHI Min2,HUI Bo2,LEI Ni-na2,YUE Wei-na2
(1.Scientific Research Center;2.Department of VIP General Surgery,the Second Affiliated Hospital of Xi'an Jiaotong University Health Science Center,Xi'an 710004,China)

