H2O2诱导SD大鼠视网膜细胞凋亡过程中细胞内钙离子浓度的变化
冯 燕,张 波,王少兰,王宝英,李红波,杜芳英,俞小瑞
(1.西安交通大学医学部遗传与分子生物学系,陕西西安 710061;2.西安交通大学附属
红会医院骨质疏松科,陕西西安 710054;3.西安交通大学附属3201医院骨科,陕西汉中 723000)
◇基础研究◇
H2O2诱导SD大鼠视网膜细胞凋亡过程中细胞内钙离子浓度的变化
冯 燕1,2,张 波1,3,王少兰1,王宝英1,李红波1,杜芳英1,俞小瑞1
(1.西安交通大学医学部遗传与分子生物学系,陕西西安 710061;2.西安交通大学附属
红会医院骨质疏松科,陕西西安 710054;3.西安交通大学附属3201医院骨科,陕西汉中 723000)
目的 观察H2O2诱导原代培养SD大鼠视网膜细胞凋亡过程中细胞内Ca2+浓度([Ca2+]i)的变化及其来源。方法 取1~3 d内新生SD大鼠视网膜进行原代细胞培养,以100μmol/L H2O2作用0、2、4、8、12、24 h,采用MTT法进行细胞活力检测,应用Hoechst 33342染色法进行细胞凋亡检测,以Eluo-3 AM为细胞内Ca2+探针并利用荧光激活细胞分类技术(EACS)进行[Ca2+]i检测,确定H2O2诱导细胞损伤及凋亡过程中[Ca2+]i的变化;应用细胞外Ca2+螯合剂EGTA初步检测H2O2诱导的[Ca2+]i变化是否源于细胞外Ca2+内流。结果 100μmol/L H2O2可诱导原代培养的SD大鼠视网膜细胞发生凋亡,且凋亡数目呈时间依赖性递增;100μmol/L H2O2作用2~24 h均可显著降低细胞活力,而[Ca2+]i的升高出现在H2O2作用2 h且维持至12 h,然后逐渐下降,至24 h恢复至正常水平;0.5~5 mmol/L EGTA可显著削弱由100μmol/L H2O2作用2 h导致的[Ca2+]i增加。结论 在H2O2诱导原代培养的SD大鼠视网膜细胞发生凋亡过程中,[Ca2+]i的升高发生在凋亡的早期阶段,而非细胞凋亡全过程中;H2O2的损伤作用所导致的[Ca2+]i升高部分来源于细胞外Ca2+的内流。
[Ca2+]i;H2O2;SD大鼠;视网膜细胞;凋亡
1 材料与方法
1.1 主要材料、试剂和仪器多聚赖氨酸、Hoechst 33342由Sigma公司提供,DMEM/E-12培养液由Hyclone公司提供,胎牛血清由杭州四季青公司提供,H2O2由西安试剂厂提供,胰酶、DMSO、MTT、EGTA(extracellular Ca2+chelator)由Ameresco公司提供,Eluo-3 AM、20%Pluronic E-127由Biotium公司提供;24孔细胞培养板由Costar corporation提供;实验用相关基本试剂及实验耗材均购自西安交通大学实验耗材供应中心;实验用二氧化碳培养箱、全波长酶标仪、解剖显微镜、超净工作台、电热恒温培养箱等仪器均由西安交通大学医学部生物化学与分子生物学实验室提供;流式细胞仪由西安交通大学医学部中心实验室提供。
1.2 实验动物和细胞原代培养取3 d内新生SD大鼠10只(西安交通大学医学部实验动物中心,体质量5~12 g),解剖显微镜下剥离视网膜组织,2.5 g/L胰酶消化10 min,调整细胞密度为1×106个/m L,以1 000μL/孔接种到铺有多聚赖氨酸的24孔板内,于含100 m L/L胎牛血清的DMEM/E-12培养液,37℃50 m L/L的CO2培养箱培养。每24 h全量或半量换液。第1~9天分别应用光学显微镜观察细胞形态,明确细胞生长的最佳时期即第5~6天细胞用于实验。
1.3 H2O2干预及形态学观察在原代培养第5天
时用100μmol/L的H2O2干预,分别作用0、2、4、8、12、24 h,观察细胞形态学变化。
1.4 MTT法检测细胞活力0、25、50、100、150、200
μmol/L的H2O2作用2 h或以100μmol/L的H2O2作用0、2、4、8、12、24 h,加入5 mg/m L的MTT(1 m L培养液加入100μL),继续培养4 h;吸弃培养液,加入750μL的DMSO,37℃摇床振荡10 min充分溶解紫色甲臜晶体产物;全波长酶标仪检测490 nm波长处的吸光度值;计算细胞活力。空白对照为无接种细胞,每孔的实际吸光值为检测值减去空白对照孔的吸光值。细胞活力=实验组平均吸光度值/对照组平均吸光度值。
1.5 Hoechst 33342染色检测细胞凋亡实验分为对照组(不干预)和实验组,每组设有3个复孔。实验组细胞经100μmol/L的H2O2刺激0~24 h;2.5 g/L的胰酶消化、收集细胞并调整细胞密度至5×105/mL,将细胞悬液40μL滴片,用40 g/L多聚甲醛固定20 min;室温下与2μg/m L的Hoechst 33342荧光染料避光孵育10 min;PBS洗涤2次;以激发波长为340 nm,发射波长为510 nm,荧光显微镜下进行凋亡检测并计数。每个样本随机选择含有100个细胞的3~5个视野进行凋亡细胞计数,每组样本的凋亡细胞数为该组所有复孔随机选择的视野内凋亡细胞数的平均值。
1.6 荧光激活细胞分类技术(FACS)进行[Ca2+]i检测[14-16]细胞分别经以下干预处理:①0、25、50、100、150、200μmol/L的H2O2作用2 h;②100μmol/L的H2O2作用0、2、4、8、12、24 h;③0.1、0.2、0.5、1、2、5 mmol/L的EGTA预处理1 h,然后100μmol/L的H2O2作用2 h。同上收集细胞并用PBS(不含Ca2+)重悬细胞,调整细胞密度为1×106/m L;细胞悬液300μL,加入5μmol/L的Eluo-3 AM 100μL(用5 mmol/L的Eluo-3 AM储存液配制),37℃,避光孵育30 min;1 000 r/min,离心5 min,弃上清;用500μL PBS(不含Ca2+)洗涤细胞2次;应用EACS技术,选择526 nm为发射波长、488 nm为激发波长,进行[Ca2+]i检测。每个样本随机选择含有10 000个细胞的细胞群为检测对象。
实验组和对照组分别设有3个复孔。未加Eluo-3AM的设为空白对照。由于几何平均荧光值的正态分布性较好,因此将其用于数据分析,空白对照以E0表示,其他检测组以E1表示。每个样本的Eluo-3 AM实际荧光值(以E表示)须检测值减去空白对照(即E=E1-E0)。统计分析处理时进行数据转换,[Ca2+]i用“实验组的平均E值/对照组的平均E值”表示,此时将对照组的[Ca2+]i标准化为1。所有实验设计均进行4次独立的重复实验,以确保实验的可重复性。
1.7 统计学分析统计分析采用SPSS 16.0统计软件,所有数据均采用“均数±标准差”表示,组间比较采用单因素方差分析(One-way ANOVA),组间两两比较采用LSD法,以P<0.05为差异有统计学意义。

图1 光学显微镜下原代培养1~9 d的SD大鼠视网膜细胞形态学观察Eig.1 Morphological observation of retinal cells of primary cultured SD rats on 1-9 d under optical microscope(×400)
2 结 果
2.1 视网膜细胞生长状态观察原代培养1~9 d,随着培养时间的延长,细胞成簇生长,且逐渐出现突触连接。细胞第5~6天生长最旺盛而且生长状态最稳定。之后,在没有任何损伤因素的情况下,细胞会自发产生凋亡现象(图1)。因此,原代培养的第5~6天是进行后续实验的最佳时间。
2.2 视网膜细胞在H2O2作用各时间点的凋亡情况Hoechst 33342染色显示(图2),100μmol/L H2O2诱导视网膜细胞凋亡最早出现在作用4 h,且凋亡细胞数呈时间依赖性逐渐增加。
2.3 H2O2诱导视网膜细胞凋亡中[Ca2+]i的变化25~200μmol/L的H2O2作用2 h可以降低视网膜细胞活力,且呈浓度依赖性;与对照组相比,100~200 μmol/L的H2O2可显著降低细胞活力(图3A)。100 μmol/L H2O2作用随着时间延长,成簇生长的细胞逐渐变为单个细胞,细胞间突触连接逐渐消失,细胞形态逐渐变圆,贴壁生长的细胞逐渐脱落悬浮,最后发生细胞凋亡(图4),作用2~24 h均可显著降低视网膜细胞活力,且呈时间依赖性降低(图5A)。
25、50μmol/L H2O2作用2 h对[Ca2+]i无明显影响,100、150、200μmol/L的H2O2作用2 h可显著升高[Ca2+]i,且为剂量依赖性增加(图3中B、C、D)。100μmol/L的H2O2作用2、4、8、12 h,均可使[Ca2+]i显著升高,且2 h和4 h时[Ca2+]i升高最为显著,之后逐渐下降,至24 h恢复到正常水平(图5中B、C、D);与对照组相比,作用2 h轻度降低细胞活力而显著增加[Ca2+]i(P<0.001),作用24 h显著降低细胞活力(P<0.001)而[Ca2+]i无明显变化(图5中A、B)。
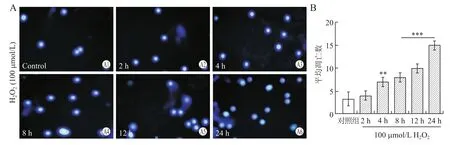
图2 H2O2作用于视网膜细胞各时间点的Hoechst 33342染色结果Eig.2 Apoptosis of retinal cells of primary cultured SD rats at different time points after H2O2stressing
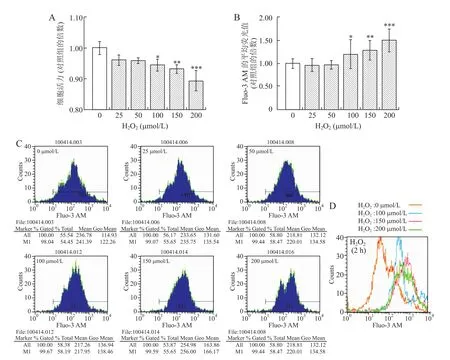
图3 0~200μmol/L的H2O2作用2 h对视网膜细胞活力和[Ca2+]i的影响Eig.3 Effects of 0-200μmol/L H2O2treatment for 2 h on cell viability and[Ca2+]iof retinal cells of primary cultured SD rats

图4 100μmol/L H2O2作用不同时间点视网膜细胞的形态学变化Eig.4 Morphological changes of retinal cells of primary cultured SD rats treated with 100μmol/L of H2O2for different time(×400)
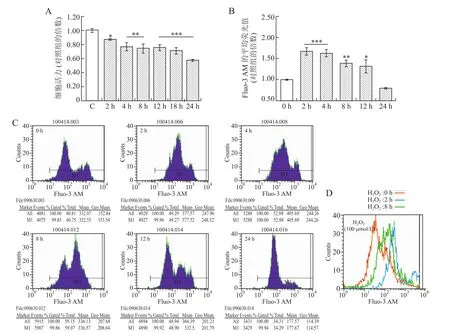
图5 100μmol/L H2O2作用不同时间对视网膜细胞活力和[Ca2+]i的影响Eig.5 Effects of 100μmol/L H2O2treatment for different time on cell viability and[Ca2+]iof retinal cells of primary cultured SD rats

图6 EGTA对100μmol/L H2O2导致的视网膜细胞[Ca2+]i变化的影响Eig.6 Effects of EGTA on 100μmol/L H2O2-induced[Ca2+]ialteration of primary cultured SD rat retinal cells
2.4 细胞外Ca2+螯合剂EGTA对H2O2引发的视网膜细胞[Ca2+]i升高的影响0.5~5.0 mmol/L EGTA显著削弱了100μmol/L H2O2作用2 h导致的[Ca2+]i的增加,且呈剂量依赖性(图6)。
3 讨 论
视网膜是中枢神经系统的一部分,位于眼的后方,包含较少基本类型的细胞,其中色素上皮细胞和光感受器之间几乎没有紧密的细胞粘连,使得视网膜可容易地与眼后组织完整分离。故易于操作并完整地从眼球后部取下,而从冷血脊椎动物分离的视网膜在湿润有氧的环境中可存活数小时。此外,人工培养基可使动物视网膜维持更长时间。因此,视网膜特殊的解剖结构特点和容易在体外培养存活的生长特点,使其成为研究中枢神经系统疾病的理想模型。
视网膜感光细胞层中的视杆细胞和视锥细胞具有高度光感性,使得视网膜易于遭受光刺激产生氧化应激而诱导视网膜细胞凋亡,成为视网膜退行性疾病的发病基础。视网膜退行性疾病是临床眼科常见疾病之一,常因最终致盲而严重影响患者生活质量。因此,研究视网膜退行性疾病的发病机制具有重要的临床应用价值。
H2O2诱导细胞凋亡已成为氧化应激诱导中枢神经系统退行性疾病研究的一个良好的体外模型。体外模型被广泛用于研究疾病的发病机制。原代细胞培养早已成为体外研究最为广泛使用的视网膜细胞培养方法[17]。混合原代培养的视网膜细胞包括各种类型的视网膜细胞,与细胞系相比能够更好地代表在体水平。本研究所得数据均基于H2O2诱导的原代混合培养视网膜细胞凋亡模型,可以代表多种视网膜退行性疾病的发病机制。
[Ca2+]i在多数细胞生命活动过程中起着重要作用,受机体内一系列复杂调控机制的严格调控。虽然短暂的[Ca2+]i升高是机体基本生命过程中维持细胞膜兴奋性所必需的,但是慢性[Ca2+]i升高却会触发毒性信号的级联反应,导致细胞死亡。近年研究证据表明,在许多中枢神经系统退行性疾病中都存在有[Ca2+]i异常。大量的研究显示,[Ca2+]i变化可能会导致细胞凋亡[18],提示了[Ca2+]i相关机制与细胞凋亡之间存在一定的相关性。有研究发现,H2O2刺激可以诱导体外培养的神经细胞凋亡,该凋亡过程是由[Ca2+]i的增加介导的。存在于细胞质膜上的离子通道、泵和交换体时刻门控着细胞内Ca2+的进入和释放,从而严格调控[Ca2+]i,以维持细胞内钙稳态。当细胞受到胞外信号刺激时,将会导致高达100倍的[Ca2+]i的增加,这些增加的[Ca2+]i来源于细胞摄取胞外Ca2+的进入或胞内钙裤释放的Ca2+。已经发现几个Ca2+通道参与H2O2介导的[Ca2+]i增加,包括NMDA受体、AMPA受体和VGCC[19-21]。TRP蛋白家族是一组非电压依赖性阳离子渗透的Ca2+通道,在哺乳动物细胞中均有表达,包括6个亚家族:TRPC、TRPV、TRPM、TRPA、TRPP和TRPML[22-23]。最近的证据表明,通过TRP通道使得Ca2+内流增加是氧化应激介导细胞死亡的一个重要机制;氧化应激可以激活TRPC和TRPM家族成员[23]。本研究中,我们发现Ca2+在H2O2诱导的原代培养SD大鼠视网膜细胞凋亡中发挥着一定的作用,且[Ca2+]i的增加出现在细胞凋亡的早期阶段,而不是在凋亡的后期。此外,增加的[Ca2+]i部分来源于细胞外Ca2+内流,有关调控H2O2诱导原代培养SD大鼠视网膜细胞凋亡早期[Ca2+]i增加的详尽分子机制正在深入进行中。
细胞内Ca2+指示剂和[Ca2+]i检测方法有多种,适当的指示剂和检测方法的选择对[Ca2+]i检测结果和研究结论是非常重要的。目前,常用的细胞内Ca2+指示剂有Eluo-3、Eura-2和Indo-1等。常用的[Ca2+]i检测方法有激光共聚焦、钙显像、EACS等。20多年前Eluo-3已被广泛应用于[Ca2+]i检测的Ca2+荧光探针[15]。在没有Ca2+存在的情况下,Eluo-3无荧光可见,但当与Ca2+结合时,Eluo-3在发射波长为526 nm处的荧光强度至少增强40倍以上。Eluo-3与Eura-2、Indo-1的不同之处是它的最大激发和发射荧光在与Ca2+结合前后都不会有明显的变化。因此,Eluo-3不适用于钙显像比率技术检测[Ca2+]i,而是EACS技术检测[Ca2+]i最合适的细胞内Ca2+探针之一。然而,虽然Eluo-3灵敏度很高,是EACS检测[Ca2+]i最合适的细胞内Ca2+探针之一,但只有少数细胞对其有通透性,从而限制了很多种类细胞的[Ca2+]i检测。随后人们发现Eluo-3 AM是酯膜渗透性Eluo-3,可以通过大多数细胞膜而被动扩散。Eluo-3 AM本身不与Ca2+结合,但当其一旦进入细胞内,被水解为Eluo-3,可以与Ca2+结合[16]。由此可见,本研究选用Eluo-3 AM为细胞内Ca2+指示剂,采用EACS技术检测[Ca2+]i是合理可行的,Eluo-3 AM的荧光强度能够真实反应[Ca2+]i实时变化。
因此,本研究应用H2O2诱导的原代混合培养视网膜细胞凋亡为模型,以Eluo-3AM为细胞内Ca2+探针,利用EACS技术检测H2O2诱导细胞损伤及凋亡过程中[Ca2+]i的变化,能够真实反应多种视网膜退行性疾病的发病机制,具有一定的理论意义。今后将进行动物体内实验进行深入研究。
[1]SELVARAJ S,SUN Y,SINGH BB.TRPC channels and their implication in neurological diseases[J].CNS Neurol Disord Drug Targets,2010,9(1):94-104.
[2]ORRENIUS S,ZHIVOTOVSKY B,NICOTERA P.Regulation of cell death:the calcium-apoptosis link[J].Nat Rev Mol Cell Biol,2003,4(7):552-565.
[3]NGUYEN TT,CHO SO,BAN JY,et al.Neuroprotective effect of Sanguisorbae radix against oxidative stress-induced brain damage:in vitro and in vivo[J].Biol Pharm Bull,2008,31(11):2028-2035.
[4]BERRIDGE MJ,BOOTMAN MD,LIPP P.Calcium—a life and death signal[J].Nature,1998,395(6703):645-648.
[5]CAO W,TOMBRAN-TINK J,CHEN W,et al.Pigment epithelium-derived factor protects cultured retinal neurons against hydrogen peroxide-induced cell death[J].J Neurosci Res,1999,57(6):789-800.
[6]CLEMENT MV,PONTON A,PERVAIZ S.Apoptosis induced by hydrogen peroxide is mediated by decreased superoxide anion concentration and reduction of intracellular milieu[J].FEBS Lett,1998,440(1-2):13-18.
[7]BERLIOCCHI L,BANO D,NICOTERA P.Ca2+signals and death programmes in neurons[J].Philos Trans R Soc Lond B Biol Sci,2005,360(1464):2255-2258.
[8]ARUNDINE M,TYMIANSKI M.Molecular mechanisms of glutamate-dependent neurodegeneration in ischemia and traumatic brain injury[J].Cell Mol Life Sci,2004,61(6):657-668.
[9]WU S,HYRC KL,MOULDER KL,et al.Cellular calcium deficiency plays a role in neuronal death caused by proteasome inhibitors[J].J Neurochem,2009,109(5):1225-1236.
[10]JOHNSON EM,JR.,KOIKE T,FRANKLIN J.A“calcium set-point hypothesis”of neuronal dependence on neurotrophic factor[J].Exp Neurol,1992,115(1):163-166.
[11]MO MS,LI HB,WANG BY,et al.PI3K/Akt and NF-kappaB activation following intravitreal administration of 17beta-estradiol:neuroprotection of the rat retina from light-induced apoptosis[J].Neuroscience,2013,228:1-12.
[12]LI H,WANG B,ZHU C,et al.17beta-estradiol impedes Baxinvolved mitochondrial apoptosis of retinal nerve cells induced by oxidative damage via the phosphatidylinositol 3-kinase/Akt signal pathway[J].J Mol Neurosci,2013,50(3):482-493.
[13]YU X,RAJALA RV,MCGINNIS JF,et al.Involvement of insulin/phosphoinositide 3-kinase/Akt signal pathway in 17 beta-estradiol-mediated neuroprotection[J].J Biol Chem,2004,279(13):13086-13094.
[14]ARROBA AI,WALLACE D,MACKEY A,et al.IGF-I maintains calpastatin expression and attenuates apoptosis in several models of photoreceptor cell death[J].Eur J Neurosci,2009,30(6):975-986.
[15]KAO JP,HAROOTUNIAN AT,TSIEN RY.Photochemically generated cytosolic calcium pulses and their detection by fluo-3[J].J Biol Chem,1989,264(14):8179-8184.
[16]TAKAHASHI A,CAMACHO P,LECHLEITER JD,et al. Measurement of intracellular calcium[J].Physiol Rev,1999,79(4):1089-1125.
[17]SEIGEL GM.The golden age of retinal cell culture[J].Mol Vis,1999,5:4.
[18]NOGUCHI A,TAKADA M,NAKAYAMA K,et al.c GMP-independent anti-apoptotic effect of nitric oxide on thapsigargin-induced apoptosis in the pancreatic beta-cell line INS-1[J]. Life Sci,2008,83(25-26):865-870.
[19]DUNCAN RS,GOAD DL,GRILLO MA,et al.Control of intracellular calcium signaling as a neuroprotective strategy[J]. Molecules,2010,15(3):1168-1195.
[20]LEE HJ,BAN JY,SEONG YH.Blockade of 5-HT(3)receptor with MDL7222 and Y25130 reduces hydrogen peroxide-induced neurotoxicity in cultured rat cortical cells[J].Life Sci,2005,78(3):294-300.
[21]HERSON PS,LEE K,PINNOCK RD,et al.Hydrogen peroxide induces intracellular calcium overload by activation of a non-selective cation channel in an insulin-secreting cell line[J]. J Biol Chem,1999,274(2):833-841.
[22]CLAPHAM DE.TRP channels as cellular sensors[J].Nature,2003,426(6966):517-524.
[23]CLAPHAM DE.Calcium signaling[J].Cell,2007,131(6):1047-1058.
(编辑 国 荣)
Alteration of intracellular calcium concentration in the process of H2O2-induced apoptosis of SD rat retinal cells
EENG Yan1,2,ZHANG Bo1,3,WANG Shao-lan1,WANG Bao-ying1,LI Hong-bo1,DU Eang-ying1,YU Xiao-rui1
(1.Department of Genetics and Molecular Biology,Xi'an Jiaotong University Health Science Center,Xi'an 710061;2.Department of Osteoporosis,the Red Cross Hospital Affiliated to Xi'an Jiaotong University,Xi'an 710054;3.Department of Orthopedics,3201 Hospital Affiliated to Xi'an Jiaotong University,Hanzhong 723000,China)
Objective To observe the alteration of intracellular Ca2+concentration([Ca2+]i)in the process of H2O2-induced apoptosis of retinal cells and to detect the source of[Ca2+]ion the in vitro model of primary cultured SD rat retinal cells.Methods In this study,we used primary cultured retinal cells as experimental model,detected the[Ca2+]iby FACS technique with Fluo-3 AM as a Ca2+indicator.Cell viability was measured by MTT. Apoptosis was assayed by Hoechst 33342 staining.Besides,we used extracellular Ca2+chelator EGTA to preliminarily determine whether the alteration of[Ca2+]isourced from Ca2+influx or not.Results H2O2of 100 μmol/L could induce the apoptosis of primary cultured SD rat retinal cells in a time-dependent manner.Cell viability of primary cultured retinal cells was reduced time dependently from 0 h to 24 h after 100μmol/L H2O2stressed,but[Ca2+]iincreased at 2 h,sustained to 12 h,and then recovered gradually.Increased[Ca2+]icaused by 100μmol/L H2O2treatment for 2 h significantly attenuated by 0.5-5 mmol/L EGTA,which was dose-dependent.Conclusion[Ca2+]iincrease occurred at the early stage of primary cultured SD rat retinal cells apoptosis induced by H2O2.The increase of[Ca2+]isourced partly from extracellular Ca2+influx.
[Ca2+]i;H2O2;SD rat;retinal cell;apoptosis Ca2+在细胞各种生命活动中起着重要作用[1-2],不同条件下[Ca2+]i的变化复杂多样。退行性疾病的发生发展中,[Ca2+]i过度升高或降低均有着重要作用[3-4];氧化应激诱导的细胞凋亡与神经系统退行性疾病密切相关。H2O2可以诱导各种细胞发生凋亡,并早已成为中枢神经系统退行性疾病发病机制研究的体外模型[4-6]。许多研究报道,氧化应激导致中枢神经系统退行性疾病中[Ca2+]i增加的作用[7-8],但近年来也有报道神经退行性疾病中[Ca2+]i减少的作用[9-10]。这些不同的研究结果,可能是由于Ca2+时间和空间特异性所造成的。近年来,相继出现应用H2O2诱导视网膜细胞凋亡的体外模型,进行视网膜退行性疾病的研究[11-13]。但有关Ca2+在视网膜退行性疾病发病机制中的研究较少。本研究旨在检测H2O2诱导原代培养SD大鼠视网膜细胞凋亡过程中[Ca2+]i变化及其来源,以期为阐明氧化应激诱导视网膜细胞凋亡的发病机制提供有力的实验及理论依据,并为视网膜退行性疾病寻求明确的防治靶点。
R774.1
A
10.7652/jdyxb201505002
2014-12-05
2015-05-21
国家自然科学基金资助项目(No.81271013);国家教育部高等学校博士点专项科研基金资助项目(No.20120201110051)Supported by the National Natural Science Foundation of China(No.81271013)and the National Research Foundation for the Doctoral Program of Higher Education of China(No.2012020111005)
俞小瑞.E-mail:xiaoruiy@mail.xjtu.edu.cn.冯燕、张波为共同第一作者.
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20150805.1252.002.html(2015-08-05)

