miR-19a 和miR-19b 在非小细胞肺癌中的表达
张 潍,王 辉,乔 哲,李 潇,王腾欢,李 鹏
(西安交通大学医学部第二附属医院:1.胸外科;2.麻醉科;3.泌尿外科,陕西西安 710004)
◇临床研究◇
miR-19a 和miR-19b 在非小细胞肺癌中的表达
张 潍1,王 辉1,乔 哲1,李 潇2,王腾欢2,李 鹏3
(西安交通大学医学部第二附属医院:1.胸外科;2.麻醉科;3.泌尿外科,陕西西安 710004)
目的通过检测非小细胞肺癌患者癌组织和血清中miR-19a、miR-19b的表达水平,探讨其与临床病理参数的关系和作为肿瘤分子标志物的可能性。方法采用实时荧光定量PCR技术检测正常人和非小细胞肺癌患者血清,以及非小细胞肺癌组织和癌旁组织中miR-19a、miR-19b的表达,分析miR-19a、miR-19b的表达与非小细胞肺癌临床病理参数的关系。采用ROC曲线分析miR-19a、miR-19b对非小细胞肺癌的诊断价值。结果miR-19a、miR-19b在癌组织中的表达量明显高于癌旁正常组织(P<0.05);miR-19a、miR-19b在NSCLC血清中的浓度显著高于对照组。miR-19a的ROC曲线下面积0.989,灵敏度95.1,特异度94.0;miR-19b的ROC曲线下面积0.983,灵敏度93.4,特异度94.0。结论非小细胞肺癌患者癌组织和血清miR-19a、miR-19b高表达,miR-19a、miR-19b有望作为NSCLC诊断及预后评价的检测指标。
miR-19a;miR-19b;荧光实时定量PCR;非小细胞肺癌;血清肿瘤标志物
肺癌发病率在人类肿瘤中排名第一位,也是导致癌症相关死亡的主要原因之一[1]。目前,手术治疗是延长患者生存时间最有效的方法。在美国等发达国家,尽管近15年来肺癌诊治技术不断进步,但其5年生存率一直徘徊在15%~20%之间,远低于乳腺癌(67%)和结肠癌(41%),而作为发展中国家的中国则不足15%[2]。因此,深入探讨和研究肺癌的发病机制、寻求有效的潜在治疗靶点迫在眉睫,以便实现肺癌诊疗上的突破。
miRNA是小的非编码RNA,长度为19~25个核苷酸,参与了重要生物学过程,包括发育、分化、凋亡、增殖等生物学过程[3]。研究发现,miRNA兼有类似癌基因及抑癌基因的作用,在肿瘤的发生发展中起重要作用[4]。一些肿瘤患者血清miRNA表达谱与健康人有显著差异,有望成为新的肿瘤标志物[5-8]。miR-19a、miR-19b被认为是miR-17-92家族中促进肿瘤形成的主要成员[9-10],但在肺癌形成与发展中的作用尚不明确。本研究拟通过Real time-PCR法验证其在非小细胞肺癌癌组织和血清中的表达量,为NSCLC无创伤性检出和治疗提供实验依据。
1 材料与方法
1.1 研究对象收集2014年4月至2014年9月西安交通大学医学部第二附属医院胸外科61例经手术病理证实为非小细胞肺癌组织。标本直接取自手术切除物,均为配对组织,每对为肿物、癌旁正常组织(距离病灶>5 cm,经病理证实无肿瘤细胞浸润)各一份,在手术切除后10 min之内获得,取材后置于无菌冻存管中,立即放入-80℃冰箱保存;同时采集这些患者术前5 mL静脉全血61例,并收集同期西安交通大学医学部第二附属医院的体检健康者5 m L静脉全血50例,促凝管中保存,3 000 r/min离心15 min后取上清,收集上清液于无RNA酶的2 m L离心管,所有标本置于-80℃冰箱保存。这些患者术前均未行放疗、化疗及免疫治疗,患者均知情同意,并获得当地医学伦理委员会批准。
1.2 主要试剂和仪器FAST1000总RNA提取试剂盒(北京先锋生物公司),逆转录试剂盒(北京艾德莱生物科技有限公司),Trizol试剂(Invitrogen公司),氯仿、异丙醇、无水乙醇(成都科龙化学试剂公司),DEPC水(西安先锋生物公司),实时荧光PCR反应试剂盒(北京艾德莱生物科技有限公司),-80℃超低温冰箱(REVCO公司),5810R高速冷冻离心机(Eppendorf),ND-1000紫外光分光光度计(NanoDrop公司),C1000梯度PCR扩增仪(BIO-RAD公司),Stepone实时定量PCR仪(ABI公司)。
1.3 血清、组织RNA提取取200μL血清,采用Trizol试剂说明书操作提取血清RNA;取100μg组织,按FAST1000试剂盒提取组织RNA。
1.4 荧光定量PCR(Real time-PCR)血清、组织miRNA的引物和反向互补探针委托天根生化科技(北京)有限公司设计并合成。血清、组织RNA逆转录反应总体系均为20μL。miR-19a上游引物序列为:5′-AGUUUUGCAUAGUUGCACUACA-3′,下游引物序列为:5′-GCTCACTGCAACCTCCTCCTCC-3′;miR-19b上游引物序列为:5′-UGUGCAAAUCCAUGCAAAACUGA-3′,下游引物序列为:5′-GCTCACTGCAACCTCCTCCTCC-3′,内参U6上游引物序列为:5′-GCTTCGGCAGCACATATACTAAAAT-3′,下游引物序列为:5′-CGCTTCACGAATTTGCGTGTCAT-3′;采用美国ABI-step one实时定量PCR仪进行扩增反应,PCR反应体系总体积为20μL,其中含有2×miR qPCR Mix(With Sybr Green)10μL、Forward primer 0.4μL、Reverse primer 0.4μL、miR 0.5μL,其余用dd H2O补齐反应体系。每次试验设置3个复孔。实时定量PCR反应条件:94℃预变性3 min,然后以94℃20 s、60℃20 s和72℃40 s进行40个循环。
1.5 统计学分析检测非小细胞肺癌患者和正常人血清的miRNA表达,应用SPSS18.0统计学软件处理,计量数据以()表示,组间比较采用t检验。运用MedCalc 14.0绘制受试者工作曲线(receiver operator characteristic curve,ROC曲线)及曲线下面积(AUC)评价miR-19a、miR-19b作为一种诊断方法是否具有临床应用价值。筛选预测的最佳界值,曲线下面积(AUC)≤0.5为无诊断价值,0.5<AUC≤0.7为诊断准确性较低,0.7<AUC≤0.9为诊断准确性较好,AUC≥0.9表示诊断准确性最高。以P<0.05为差异有统计学意义。
2 结 果
2.1 Real time-PCR测定miR-19a、miR-19b的表达水平荧光定量PCR检测非小细胞肺癌组织和血清标本中miR-19a、miR-19b和U6的扩增曲线与溶解曲线,分析miR-19a、miR-19b和U6扩增产物为单一的特异性产物,溶解曲线均为单一峰,未出现杂峰,实验中未出现污染、引物二聚体和非特异性扩增,提示本实验结果可靠。运用Real time-PCR法,我们发现,可以在肺癌组织和血清标本中检测到miR-19a、miR-19b的表达水平,且肺癌组织和血清标本中miR-19a、miR-19b成员的表达与正常对照组相比均上调,差异均有统计学意义(P<0.05),其中miR-19a的浓度上升最为显著(P=0.018,图1)。
2.2 miR-19a、miR-19b的表达与NSCLC的临床病理特征的关系61例NSCLC患者的组织及血清中,miR-19a、miR-19b的表达与肿瘤病理类型、TNM分期及淋巴结转移有关(P<0.05),而与年龄、性别、及吸烟史无明显关系(P>0.05,表1、2)。

图1 miR-19a、miR-19b在非小细胞肺癌患者中的相对表达量Fig.1 Expression levels of miR-19a and miR-19b in non-small cell lung cancer patients
表1 miR-19a、miR-19b的表达与非小细胞肺癌患者临床病理特征的关系Tab.1 Relationship of miR-19a and miR-19b expressions with the clinicopathologic features of NSCLC patients()
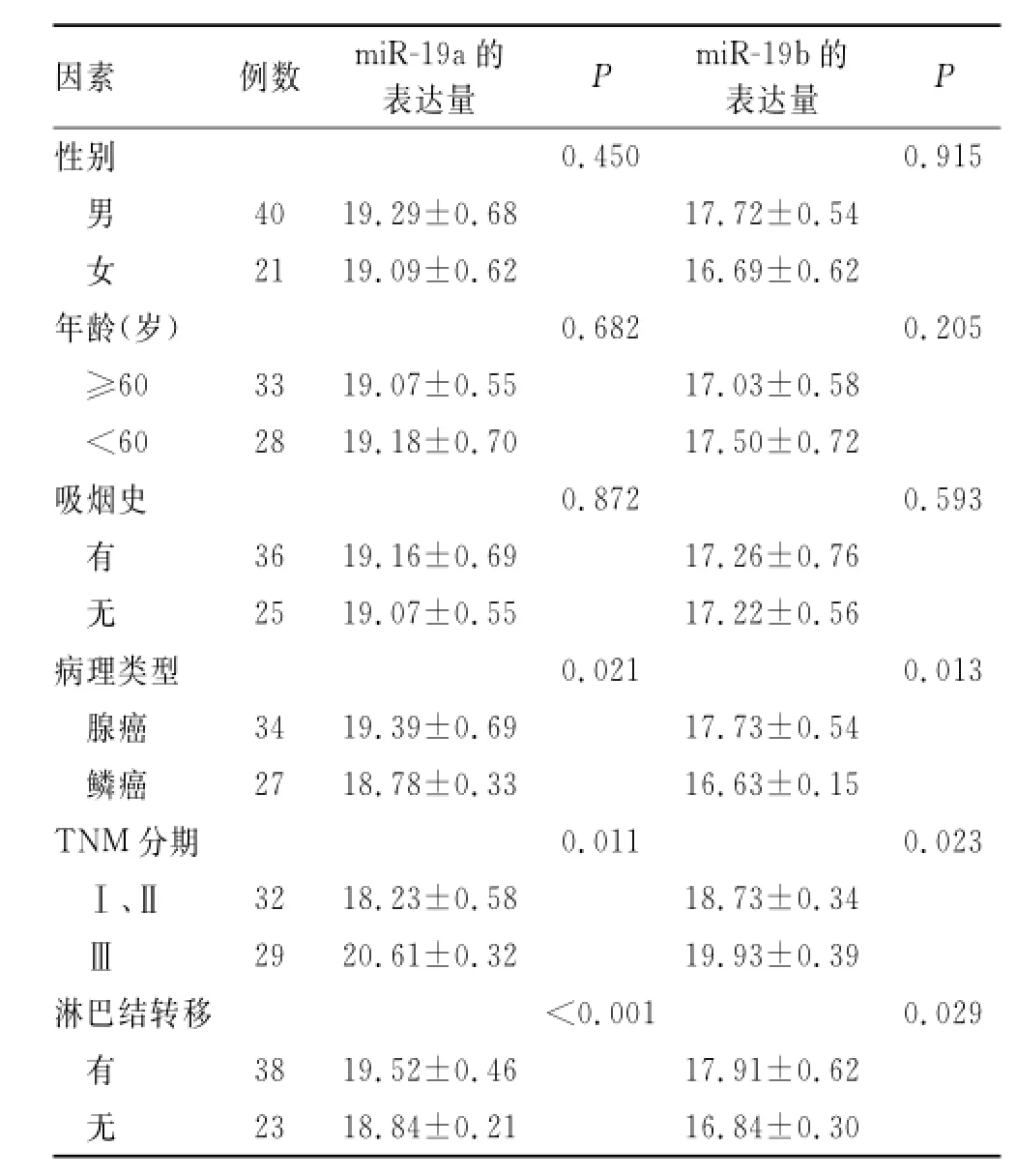
表1 miR-19a、miR-19b的表达与非小细胞肺癌患者临床病理特征的关系Tab.1 Relationship of miR-19a and miR-19b expressions with the clinicopathologic features of NSCLC patients()
2.3 ROC曲线分析血清miR-19a、miR-19b对NSCLC的诊断价值以灵敏度为纵坐标,误诊率(100-特异度)为横坐标在MedCalc 14.0软件上做ROC曲线图,然后计算曲线下面积(AUC),并计算出各miRNA的Cut off值。可以看出miR-19a、miR-19b对NSCLC的诊断均有很好的准确性(图2)。
2.4 肺癌组织中miRNA和血清中miRNA之间的相关性分析患者血清中miR-19a、miR-19b的表达与癌组织中的miR-19a、miR-19b表达间存在秩相关关系(P<0.05,图3)。
表2 实时荧光定量PCR验证血清中miRNA的相对表达量Tab.2 The relative expression levels of plasma miRNAs by using real-time fluorescence quantitative-PCR()
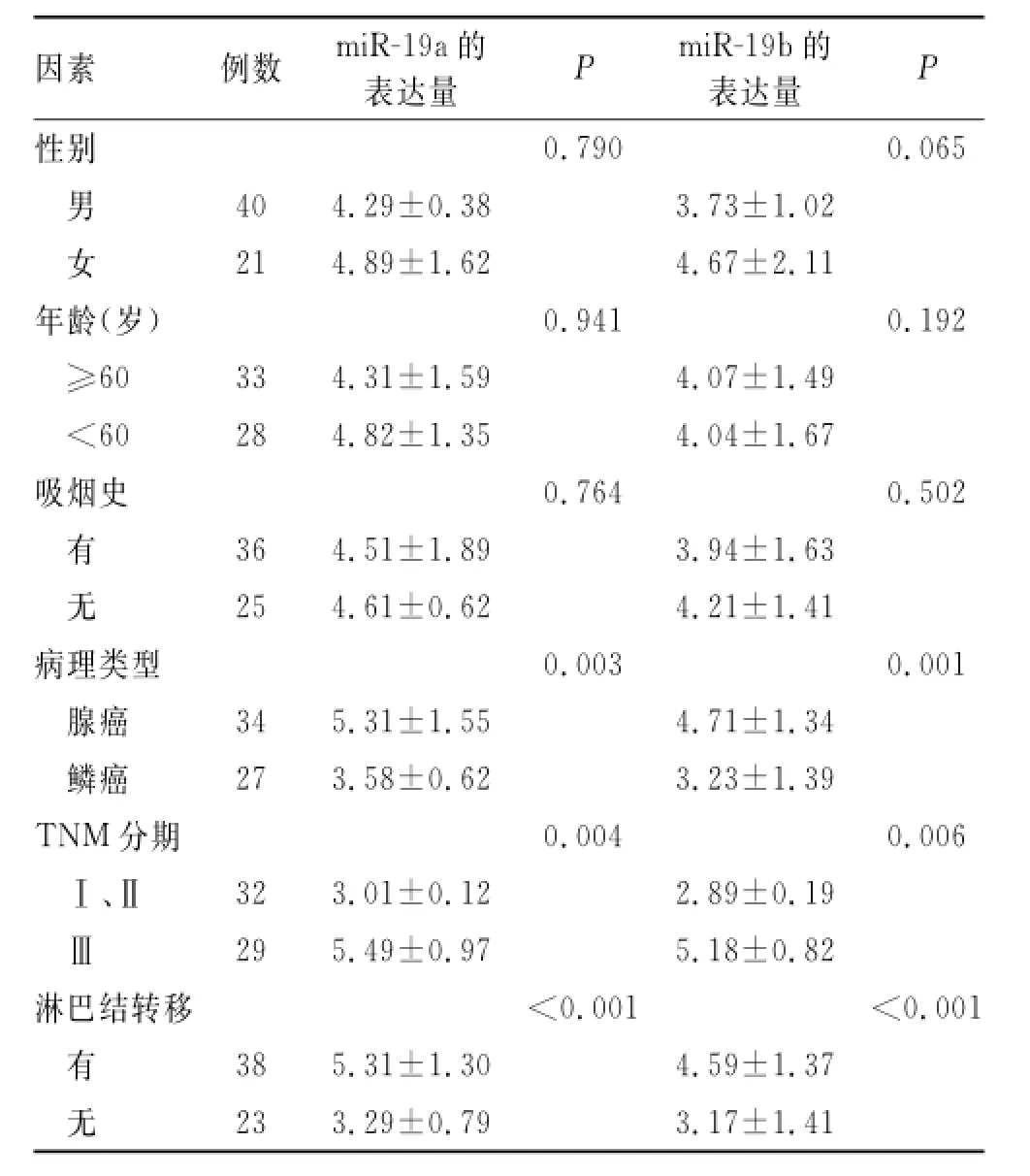
表2 实时荧光定量PCR验证血清中miRNA的相对表达量Tab.2 The relative expression levels of plasma miRNAs by using real-time fluorescence quantitative-PCR()
3 讨 论
miRNA是一类高度保守的包含19~25个核苷酸的非编码小分子RNA,可在转录后水平调控基因的表达。miRNA调控着约1/3的人类编码蛋白质的基因[13]。miRNA通过特异性识别并结合靶mRNA 3′-UTR区,促进靶mRNA降解和(或)阻碍翻译过程而发挥作用[11]。miRNA几乎在所有细胞的生物学进程中都发挥着十分重要的调控作用,如细胞增殖、分化、代谢、凋亡等[12]。LIPS等[14]研究发现,许多miRNA的功能异常与肺癌的发生密切相关。因此,把miRNA作为研究肺癌中基因表达调控的重要参与因子,并且研究miRNA在肺癌中可能的作用机制及其靶基因的功能,对于肺癌的诊断与治疗提供了一个新的检测和治疗方向。
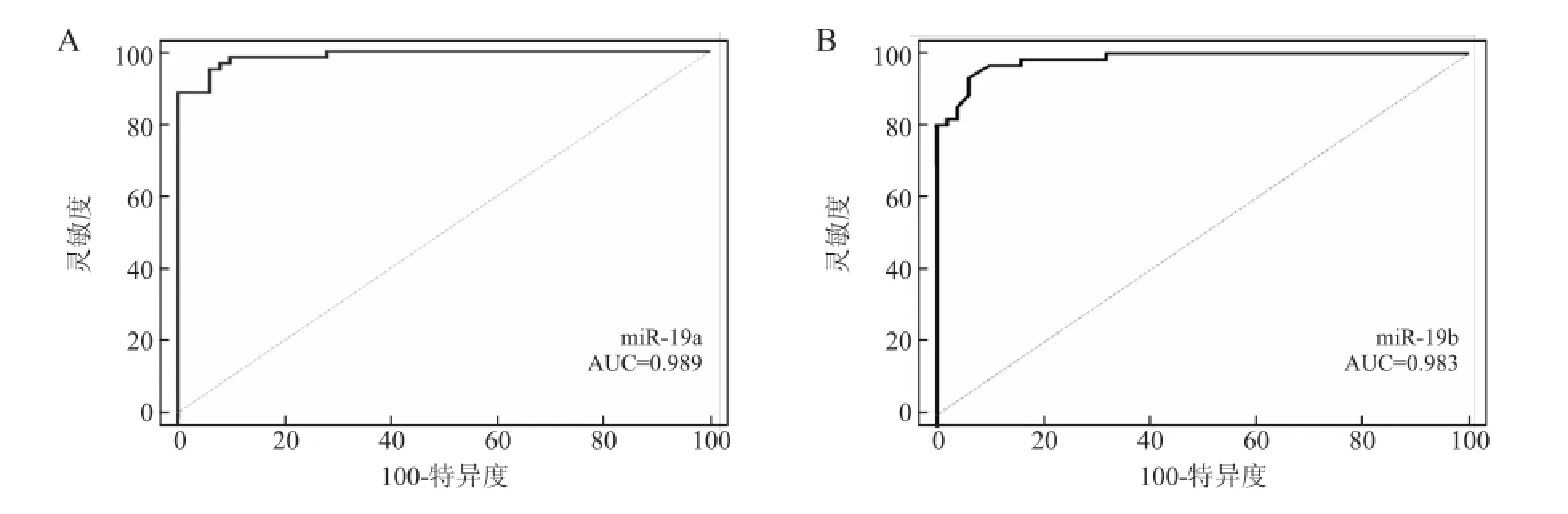
图2 血清miR-19a、miR-19b对NSCLC的诊断价值Fig.2 The diagnostic values of miR-19a and miR-19b for NSCLC
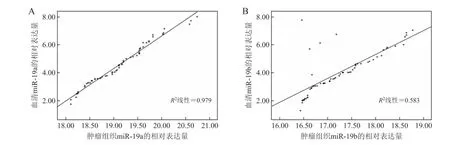
图3 miR-19a、miR-19b在非小细胞肺癌患者血清与癌组织中的相对表达关系Fig.3 The levels of miR-19a and miR-19b expressions in the serum and cancer tissues of non-small cell lung cancer patients
近年来,越来越多的研究发现,肿瘤细胞中的miRNAs可以进入血液循环,且其表达水平可以在一定程度上反映它在组织中的表达水平[15],并且外周血中miRNAs的表达相当稳定。循环血miRNA对肿瘤早期诊断、分期和预后评估等方面具有重要的提示作用[16-17]。虽然多种肿瘤组织miRNA表达水平的测量可以提供比较准确的诊断,但是肿瘤组织样本的采集由于对患者的伤害比较大,因此限制了其应用。新近的研究显示,循环血清miRNA作为肿瘤标志物可以用于指导癌症的诊断和治疗,并为有效地监控和预防癌症复发提供了新途径[18]。
miRNA-19a、miRNA-19b是miRNA-17-92家族中的重要成员[19],该家族包括6种成熟的miRNA:miR-17、miR-20a、miR-18a、miR-19a、miR-19b-1和miR-92-1。值得注意的是,与编码基因的作用方式一样,同一miRNA可依据其表达时所处的细胞环境不同而表现出其抑癌或致癌基因的功能[20];在有些情况下,为了维持体内平衡,同一个miRNA能对同一细胞发挥正面或负面的影响[21]。miR-17-92家族可以促进肺上皮细胞的迁移,无论肺上皮细胞是否已经恶变[22-23]。miR-17-92家族还可以促进正常组织及恶性组织中血管的生成[24]。miR-17-92簇中的miR-17-5p,一方面在乳腺癌细胞中通过抑制乳腺癌扩增性抗原和转录因子E2F1的翻译而抑制肿瘤细胞的增殖[25];另一方面,其又能通过抑制HMG盒转录因子1的表达而激活Wnt/β-catenin,从而促进乳腺癌细胞的侵袭和转移[26]。miR 17-92簇中的miR-20a能通过转录后水平调节信号转导与转录激活因子的表达而抑制胰腺癌细胞的增殖和侵袭[27];而在骨肉瘤患者中,miR-20a又可下调凋亡调控基因Fas表达而增强骨肉瘤细胞的转移能力,使癌细胞得以在Fas配体阳性表达的肺组织中生存[28]。以上现象表明,以现有的研究结果精确定义一个miRNA对癌症的具体作用,将是一个充满挑战性的难题。miRNAs的改变引起癌变还是癌变后引起组织坏死而导致miRNAs溢出或是miRNAs从癌组织中分泌出来,这些问题都有待进一步研究。
寻找理想的肿瘤诊断、预后判断及疗效监测的非创伤性分子指标是肿瘤诊断研究领域亟待解决的重要问题。近年来,miRNAs在肿瘤发生、发展中的重要作用逐渐被揭晓后,关注miRNA在肿瘤诊断、治疗以及预后评估等方面的研究日渐增多。本次研究采用Real time-PCR技术检测了miR-19a、miR-19b在非小细胞肺癌患者癌组织和癌旁组织中的表达,以及正常人和非小细胞肺癌患者血清的表达情况,结果提示非小细胞肺癌组织中miR-19a、miR-19b表达水平明显高于癌旁组织(P<0.05);非小细胞肺癌患者血清中miR-19a、miR-19b表达水平显著高于正常人血清(P<0.05),两者高表达之间呈现出一致性,提示血清miR-19a、miR-19b有可能来源于肿瘤组织的释放。非小细胞肺癌患者中miR-19a、miR-19b的表达水平与性别、年龄及吸烟史无明显相关性(P>0.05);miR-19a、miR-19b的表达与TNM分期有关,TNM分期越晚,其表达水平越高;在淋巴结转移阳性的非小细胞肺癌中表达明显增高;其表达水平还与病理类型相关,腺癌组织中miR-19a、miR-19b表达水平明显高于鳞癌,提示miR-19a、miR-19b的高表达可能与预后有关。那么,在NSCLC的治疗中我们是否可以通过各种方法下调miR-19a、miR-19b的表达,沉默其“致癌基因”的作用,从而达到治疗NSCLC的目的,这为NSCLC的治疗提供了一种新思路。在本次实验中miR-19a、miR-19b在腺癌中的表达明显高于在鳞癌中的表达,也提示我们在通过下调miR-19a、miR-19b的方法治疗NSCLC时可能对于腺癌的治疗效果优于鳞癌。
非小细胞肺癌患者血清中miR-19a、miR-19b相对表达量的ROC曲线分析显示,miR-19a、miR-19b对NSCLC的诊断有较高的准确性(敏感性和特异性为95.1和94.0;敏感性和特异性为93.4和94.0)。同时,还发现非小细胞肺癌患者血清中miR-19a、miR-19b的相对定量与癌组织中的miR-19a、miR-19b的相对定量间存在秩相关关系(R2=0.979,0.583;P<0.05),这使得miR-19a、miR-19b的血液检测成为可能,但血清miR-19a、miR-19b的检测是否比传统的肿瘤标记物具有更高的灵敏性及特异性,有待进一步大样本的临床研究。我们下一步将扩大研究的病例数,进行长期随访,以全面评估miR-19a、miR-19b对非小细胞肺癌的临床应用价值,以期为该病的诊治提供新的手段和思路。
[1]CALIN GA,CROCE CM.MicroRNA signatures in human cancers[J].Nat Rev Cancer,2006,6(11):857-866.
[2]ESQUELA-KERSCHER A,SLACK FJ.Oncomirs-microRNAs with a role in cancer[J].Nat Rev Cancer,2006,6(4):259-269.
[3]CHEN X,BA Y,MA L,et al.Characterization of microRNAs in serum:a novel class of biomarkers for diagnosis of cancer and other diseases[J].Cell Res,2008,18(8):997-1006.
[4]ZHANG C,WANG C,CHEN X,et al.Expression profile of microRNAs in serum:a fingerprintt for esophageal squamous cell carcinoma[J].Clin Chem,2010,56(12):1871-1879.
[5]LIU R,CHEN X,DU YI,et al.Serum micro RNA expression profile as a biomarker in the diagnosis and prognosis of pancreatic cancer[J].Clin Chem,2012,58(3):610-618.
[6]LIU R,ZHANG C,HU Z,et al.A five microRNA signature identifies from genome-wide serum microRNA expression profiling serves as a fingerprint for gastric cancer diagnosis[J]. Eur J Cancer,2011,47(5):784-791.
[7]OLIVE V,BENNETT MJ,WALKER JC,et al.miR-19 is a key oncogenic component of mir-17-92[J].Genes Dev,2009,23(24):2839-2849.
[8]MU P,HAN YC,BETEL D,et al.Genetic dissection of the miR-17-92 cluster of micro RNAs in Myc-induced B-cell lymphomas[J].Genes Dev,2009,23(24):2806-2811.
[9]OLIVE V,BENNETT MJ,WALKER JC,et al.miR-19 is a key oncogenic component of mir-17-92[J].Genes Dev,2009,23(24):2839-2849.
[10]MU P,HAN YC,BETEL D,et al.Genetic dissection of the miR-17-92 cluster of micro RNAs in Myc-induced B-cell lymphomas[J].Genes Dev,2009,23(24):2806-2811.
[11]ROSENFELD N,AHARONOV R,MEIRI E,et al.MicroRNAs accurately identify cancer tissue origin[J].Nat Biotechnol,2008,26(4):462-469.
[12]AMBROS V.The functions of animal micro RNAs[J].Nature,2004,431(7006):350-555.
[13]LIM LP,LAU NC,GARRETT-ENGELE P,et al.Microarray analysis shows that some microRNAs downregulate large numbers of target mRNAs[J].Nature,2005,433(7027):769-773.
[14]LIPS EH,VAN EIJK R,DE GRAAF EJ,et al.Integrating chromosomal aberrations and gene expression profiles to dissect rectal tumorigenesis[J].BMC Cancer,2008,11(5):23-30.
[15]WEILAND M,GAO XH,ZHOU L,et al.Small RNAs have a large impact:Circulating microRNA as biomarkers for human diseases[J].RNA Biol,2012,9(6):850-859.
[16]NUGENT M,MILLER N,KERIN MJ.Circulating mi R-34a levels are reduced in colorectal cancer[J].JSurg Oncol,2012,106(8):947-52.
[17]SCHETTER AJ,OKAYAMA H,HARRIS CC.The role of microRNA in colorectal cancer[J].Cancer J,2012,18(3):244-252.
[18]CHEN X,BA Y,MA LJ,et al.Characterization of microRNAs in serum:a novel class of biomarkers for diagnosis of cancer and other diseases[J].Cell Res,2008,18(10):997-1006.
[19]MITCHELL PS,PARKIN RK,KROH EM,et al.Circulating micro RNAs as stable blood-based markers for cancer detection[J].Proc Natl Acad Sci USA,2008,105(30):103-108.
[20]MENDELL JT.mi Riad roles for the miR-17-92 cluster in development and disease[J].Ceil,2008,133(2):217-222.
[21]LIU WH,YEH SH,LU CC,et al.Micro RNA-18a prevents estrogen receptor-alpha expression,promoting proliferation of hepatocellular carcinoma cells[J].Gastroenterology,2009,136(2):683-693.
[22]HAYASHITA Y,OSADA H,TATEMATSU Y,et al.Apolycistronic microRNA cluster,miR-17-92,is overexpressed in human lung cancers and enhances cell proliferation[J].Cancer Res,2005,65(21):9628-9632.
[23]HE L,THOMSON JM,HEMANN MT,et al.A microRNA polycistron as a potential human oncogene[J].Nature,2005, 435(7043):828-833.
[24]DEWS M,HOMAYOUNI A,YU D,et al.Augmentation of tumor angiogenesis by a Myc-activated micro RNA cluster[J]. Nat Genet,2006,38(9):1060-1065.
[25]HOSSAIN A,KUO MT,SAUNDERS GF.Mir-17-5p regulates breast cancer cell proliferation by inhibiting translation of AIB1 m RNA[J].Mol Cell Biol,2006,26(21):8191-8201.
[26]LI H,BIAN C,LIAO L,et al.miR-17-5p promotes human breast cancer cell migration and invasion through suppression of HBP1[J].Breast Cancer Res Treat,2011,126(3):565-575.
[27]YAN H,WU J,LIU W,et al.MicroRNA-20a overexpression inhibited proliferation and metastasis of pancreatic carcinoma cells[J].Hum Gene Ther,2010,21(12):1723-1734.
[28]HUANG G,NISHIMOTO K,ZHOU Z,et al.mi R-20a encoded by the miR-17-92 cluster increases the metastatic potential of osteosarcoma cells by regulating Fas expression[J].Cancer Res,2012,72(4):908-916.
(编辑 韩维栋)
The expressions of miR-19a and miR-19b in non-small cell lung cancer
ZHANG Wei1,WANG Hui1,QIAO Zhe1,LI Xiao2,WANG Teng-huan2,LI Peng3
(1.Department of Thoracic Surgery;2.Department of Anesthesiology;3.Department of Urinary Surgery,the Second Affiliated Hospital of Xi’an Jiaotong University Health Science Center,Xi’an 710004,China)
ObjectiveTo investigate the levels of miR-19a and miR-19b expressions in cancer tissues and serum of patients with non-small cell lung cancer(NSCLC),and evaluate the potential of miR-19a and miR-19b as biomarkers of NSCLC.MethodsReal time-PCR was used to detect the expressions of miR-19a and miR-19b in serum of normal people and patients with NSCLC and in cancer tissues and their corresponding non-tumor tissues. The diagnostic value of miR-19a and miR-19b for NSCLC was assessed by receiver operator characteristic(ROC)curve.ResultsThe expression levels of serum miR-19a and miR-19b were significantly higher in patients with non-small cell lung cancer than in normal people(P<0.05).The expressions of miR-19a and miR-19b in NSCLC were much higher than in the adjacent normal tissues.For miR-19a the area under ROC curve was 0.989,and the sensitivity and specificity were 95.1 and 94.0.The area under ROC curve for miR-19b was 0.983,and the sensitivity and specificity were 93.4 and 94.0.ConclusionThe high expressions of miR-19a and miR-19b are found in cancer tissues and serum from NSCLC patients.Therefore,they may be used as noninvasive biomarkers for diagnosis and prognosis of NSCLC.
miR-19a;miR-19b;fluorescence Real time-PCR;non-small cell lung cancer;serum tumor marker
R734.2
A
10.7652/jdyxb201506019
2015-03-09
2015-05-07
陕西省科技攻关项目(No.2012K13-02)
Supported by the Sci-tech Research Project of Shaanxi Province(No.2012K13-02)
张潍.E-mail:zw0009@126.com
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20150928.1512.008.html(2015-09-28)

