EGFR 对血管生成拟态的诱导作用及其相关机制
张 熙,赵启梅,尉春艳
(1.西安交通大学医学部第二附属医院神经外科,陕西西安 710004;2.十堰市堰桥医院急诊科,湖北十堰 442000;3.西安交通大学医学部第二附属医院妇产科,陕西西安 710004)
◇基础研究◇
EGFR 对血管生成拟态的诱导作用及其相关机制
张 熙1,赵启梅2,尉春艳3
(1.西安交通大学医学部第二附属医院神经外科,陕西西安 710004;2.十堰市堰桥医院急诊科,湖北十堰 442000;3.西安交通大学医学部第二附属医院妇产科,陕西西安 710004)
目的探讨表皮生长因子受体(epithelial growth factor receptor,EGFR)对血管生成拟态的促进作用。方法应用CD34-PAS双重染色法检测不同级别胶质瘤中血管生成拟态的存在情况,应用免疫组织化学法检测不同级别胶质瘤中EGFR蛋白的表达,应用化学缺氧法诱导人脑星形细胞瘤U87细胞在三维培养体系中形成血管生成拟态,Transwell法检测细胞的迁移及侵袭能力,甲基噻唑基四唑法(methyl thiazolyl tetrazolium,MTT)检测细胞的增殖能力,蛋白质印迹法(Western blot)检测EGFR、丝氨酸苏氨酸蛋白激酶AKT和磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase,PI3 K)蛋白的表达,探讨EGFR/AKT/PI3K通路对血管生成拟态的诱导作用。结果血管拟态阳性的患者EGFR阳性率为94.4%(17/18),血管拟态阴性的患者EGFR阳性率为71.8%(56/78),两者差异具有统计学意义(P<0.05)。U87细胞三维培养后,缺氧组平均每个视野网状结构数量、迁移能力,侵袭能力和增殖能力均显著高于常氧组(P<0.01)。Western blot显示缺氧组中EGFR、AKT、PI3K蛋白的表达显著高于常氧组。结论缺氧可诱导EGFR/AKT/PI3K信号通路活化,进而诱导血管生成拟态的形成,EGFR在血管生成拟态的形成过程中起着十分重要的作用。
血管生成拟态;缺氧;胶质瘤;EGFR/AKT/PI3K信号通路
血管生成拟态(vasculogenic mimicry,VM)是近年来发现的存在于恶性肿瘤中的一种独特的血液供应方式。它是由肿瘤细胞经过自身重塑围成的管腔样结构。它的管腔内表面没有内皮细胞,取而代之的是细长的肿瘤细胞,血液可在管腔内流动。只有同时抑制内皮细胞依赖性血管和血管生成拟态,彻底切断肿瘤血供,才有可能达到治疗肿瘤的目的。有研究证明,缺氧能够诱导血管生成拟态的形成。在缺氧条件下,EGFR蛋白的表达明显升高,它可通过激活其下游通路如AKT/PI3K激活层粘连蛋白5γ2和环氧合酶-2(cyclooxygenase-2,Cox2),进而诱导血管生成拟态的形成[1-2]。另有研究证明,层粘连蛋白5γ2和Cox2能诱导上皮间质转化的形成,上皮间质转化也能促进血管生成拟态的形成[3]。本实验拟探讨EGFR蛋白对胶质瘤血管生成拟态的促进作用及其相关机制。
1 材料与方法
1.1 主要材料与试剂U87胶质瘤细胞由ATCC(American Type Culture Collection)提供,免疫组化鼠抗人EGFR抗体购自Santa Cruz公司,Western blot检测所用EGFR、AKT和PI3K抗体购自Abcam公司。96例人脑胶质瘤标本为两安交通大学医学部第一附属医院、第二附属医院2002年2月至2013年10月手术存档石蜡标本。术后均经病理诊断证实为胶质瘤,包括72例星形细胞瘤,10例髓母细胞瘤,8例室管膜母细胞瘤,6例少突胺质细胞瘤。所有患者术前均未进行放疗或化疗。
1.2 免疫组织化学染色和CD34-PAS双重染色免疫组织化学采用SP法,按照CD34免疫组化试剂盒步骤操作。显微镜下观察,血管内皮呈现棕黄色后,蒸馏水冲洗1 min终止显色反应;然后行PAS染色,常规脱水、透明、树胶封片。计算阳性细胞所占比例,<10%为阴性,>10%为阳性。
1.3 细胞的三维培养将Matrigel基质胶与新生牛血清1∶1混合,加入到24孔板中,每孔加入20μL,室温下放置20 min,基质胶凝固后,每孔加入U87细胞1×104个。分为常氧组和缺氧组。常氧组加入100 m L/L的新生牛血清至达尔伯克必需基本培养基(Dulbecco’s minimum essential medium,DMEM),缺氧组中再加入二氯化钴(CoCl2)100μmol/L,每组随机选择8个视野,计数血管生成拟态数目。
1.4 细胞迁移能力检测采用Transwell法检测细胞的迁移能力。将U87细胞加入到Transwell小室的上室中,每孔2×104个,分为常氧组和缺氧组,每个上室中加入10 m L/L新生牛血清的DMEM培养液200μL,下室加入10 mL/L新生牛血清的DMEM培养液600μL。缺氧组在上室加入CoCl2100μmol/L,12 h后每组随机选择8个视野计数迁移细胞数目,观察各组细胞迁移至小室聚碳脂膜内的细胞数。
1.5 细胞侵袭能力的检测采用Transwell法检测细胞的侵袭能力。将Matrigel基质胶与新生牛血清1∶1混合,加入到Transwell小室的上室中,室温下放置20 min,基质胶凝固后,每个上室加入U87细胞8×104个,分为常氧组和缺氧组,上室中加入10 mL/L新生牛血清的DMEM培养液200μL,下室加入100 m L/L新生牛血清的DMEM培养液600μL。缺氧组在上室加入CoCl2至100μmol/L。24 h后U87细胞每组随机选择8个视野计数侵袭细胞数目,观察各组细胞侵袭至小室聚碳脂膜内的细胞数。
1.6 MTT检测收集对数期U87细胞,显微镜下用细胞计数板调整细胞密度,加入到96孔板中,每孔100μL,每孔细胞约5 000个。50 mL/L CO2、37℃培养,细胞贴壁后,分为常氧组和缺氧组,每组8个复孔,常氧组加入100 m L/L的新生牛血清DMEM培养液,缺氧组再加入CoCl2100μmol/L。在50 m L/L CO2、37℃培养24 h,显微镜下观察细胞生长情况,移去细胞培养液,PBS清洗2次,加入细胞培养液,加入MTT溶液20μL。去掉培养液。每孔加入150μL二甲基亚砜,振荡10 min,酶联免疫检测仪的A490 nm处测量吸光值。
1.7 Western blot检测提取常氧组和缺氧组细胞的总蛋白,经100 g/L十二烷基硫酸钠聚丙烯酰胺凝胶电泳,转移至聚偏氟乙烯膜。封闭2 h后与鼠抗人EGFR抗体孵育过夜,二抗孵育1 h,化学发光显色,以β-actin为内参校正。
1.8 统计学分析所得结果均用表示,采用SPSS 13.0统计软件进行分析,采用卡方检验,t检验,Spearman相关分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 胶质瘤中血管生成拟态与EGFR蛋白表达的关系96例人脑胶质瘤标本中,18例血管生成拟态阳性,78例血管拟态阴性。18例血管拟态阳性的标本17例EGFR蛋白表达阳性,阳性率为94.4%,78例血管拟态阴性的标本中,56例EGFR蛋白表达阳性,阳性率为71.8%,两组阳性率相比较差异具有统计学意义(P<0.05,表1、图1)。

表1 人脑胶质瘤中血管生成拟态与EGFR蛋白表达的关系Tab.1 The relationship between vasculogenic mimicry and EGFR protein in glioma
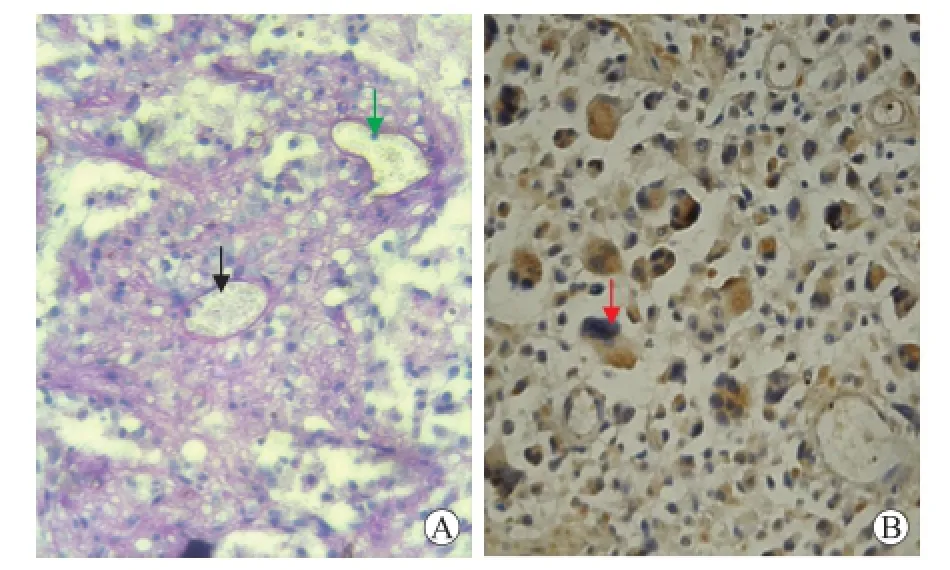
图1 胶质瘤中血管生成拟态的鉴定和EGFR蛋白的表达Fig.1 The identification of vasculogenic mimicry and EGFR protein expression in glioma
2.2 缺氧可诱导U87细胞血管生成拟态的形成24 h后发现常氧组及缺氧组均变形,相互连接形成网状结构,但是缺氧组的网状结构数目明显多于常氧组。缺氧组平均每个视野网状结构数量为58.29± 7.02,而常氧组为23.71±5.77,缺氧组和常氧组比较,差异具有统计学意义(P<0.01,图2)。
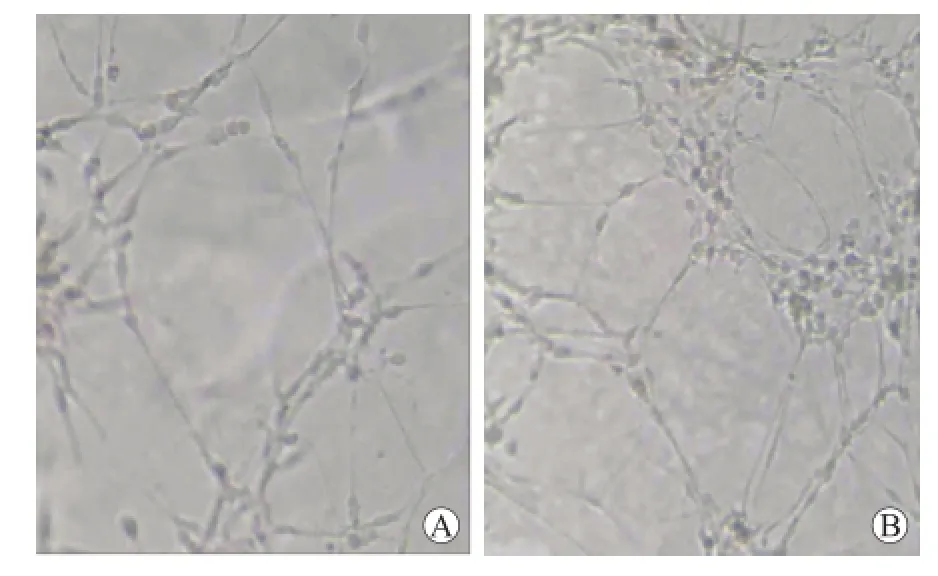
图2 三维培养中缺氧对U87细胞血管生成拟态的诱导作用Fig.2 Vasculogenic mimicry of U87 cells was induced in three-dementional culture in hypoxia
2.3 缺氧可上调U87细胞的迁移能力缺氧组U87细胞平均迁移数目为177.86±18.12,常氧组为70.43±9.32,两组间差异具有统计学意义(P<0.01),细胞迁移能力与血管生成拟态的形成呈显著正相关(r=0.713,P<0.01,图3)。

图3 缺氧对U87细胞迁移能力的影响Fig.3 The impact of hypoxia on migration of U87 cells
2.4 缺氧可上调U87细胞的侵袭能力在常氧组中,平均每个视野U87细胞侵袭数目为40.57± 6.48,而在缺氧组中,U87细胞侵袭数目为87.29± 10.70,两组之间差异具有统计学意义(P<0.01),细胞侵袭能力与血管生成拟态的形成呈正相关(r= 0.796,P<0.01,图4)。
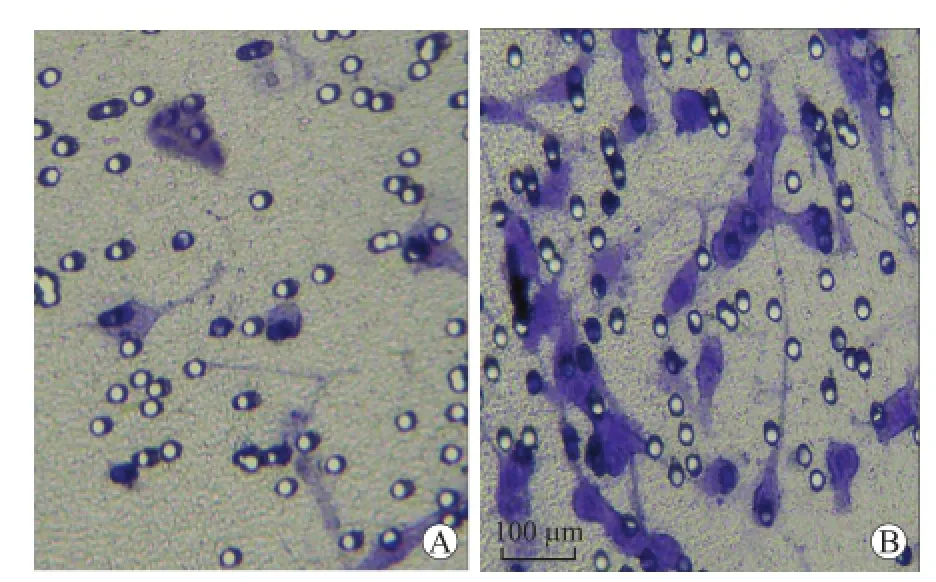
图4 缺氧对U87细胞侵袭能力的影响Fig.4 The impact of hypoxia on invasion of U87 cells
2.5 缺氧可上调U87细胞的增殖能力常氧组的平均A值为0.46±0.05,缺氧组的平均A值为0.60 ±0.06,两组之间的差异具有统计学意义(P<0.05),与血管生成拟态的形成呈显著正相关(r= 0.676,P<0.01)。
2.6 缺氧可激活EGFR/AKT/PI3 K通路与常氧组比较,缺氧组中EGFR蛋白的表达明显上调,其下游蛋白AKT和PI3K蛋白的表达也明显上调,EGFR/ AKT/PI3K信号通路明显活化(图5)。
3 讨 论
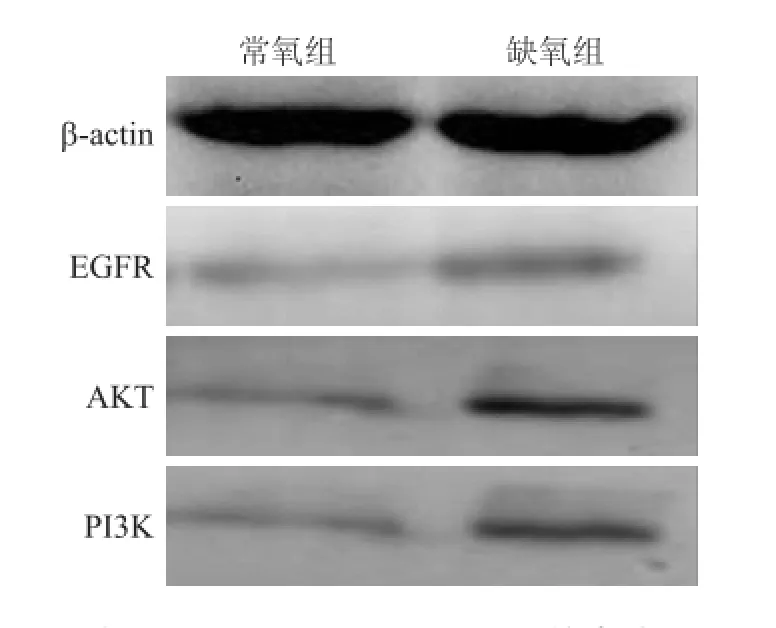
图5 两组中EGFR、AKT和PI3K蛋白的表达Fig.5 The expressions of EGFR,AKT and PI3K protein
血管生成拟态是新发现的肿瘤内微循环结构。它是由肿瘤细胞变形、重塑以及相互连接形成的管腔样结构,管道内没有血管内皮细胞的覆盖,管腔内可见血细胞,可向肿瘤组织供血。目前已在多种肿瘤中发现有血管生成拟态的存在,如肝癌,胶质瘤[4-5]等,它对肿瘤的发展、转移、复发均起着十分重要的作用。
形成血管生成拟态的肿瘤细胞主要有以下2个特点:①形成拟态血管的肿瘤细胞具有一定的可塑性;②它们丧失肿瘤细胞本身的一些标志蛋白,转而表达一些内皮细胞特有的蛋白,存在多分化潜能[6]。研究表明,在多种肿瘤中,上皮间质转化能够赋予肿瘤细胞重塑、分化的能力[7],能够促进肿瘤细胞血管生成拟态的形成。RIZVI等[8]认为,在卵巢癌中上皮间质转化往往伴随着EGFR的过表达。在肿瘤细胞中,血管内皮钙粘蛋白(vascular endothelial cadherin,VE-cadherin)可诱导Eph A2蛋白转移至细胞膜。细胞膜上的Eph A2蛋白相互作用,导致其磷酸化,进而激活基质金属蛋白酶2(matrix metalloproteinase,MMP2)蛋白。活化的MMP2蛋白能够切割层粘连蛋白5γ2形成γ2’片段和γ2x片段,增加肿瘤的迁移及侵袭能力,诱导拟态血管的生成[9]。另外,Cox-2与血管生成拟态的形成也密切相关,应用Cox-2抑制剂可明显抑制血管生成拟态的形成[10]。层粘连蛋白5γ2的Ⅲ链中包含了多个类似EGF的氨基酸序列,可和EGFR结合,进而激活下游通路[11]。Cox-2可催化花生四烯酸转化为前列腺素H2,前列腺素H2随后被转化成前列腺素E2,然后激活EGFR通路,发挥其生物学效应[12]。由此可见,EGFR可能在血管生成拟态的形成过程中发挥十分重要的作用。我们前期的实验表明,在缺氧环境下能够诱导血管生成拟态的形成[13]。在缺氧环境下,细胞可能通过激活EGFR蛋白及其下游通路上调血管生成拟态的形成能力。我们首先在胶质瘤标本中证明了血管生成拟态的形成与EGFR蛋白的表达存在相关性,EGFR蛋白表达阳性的标本中,越容易形成血管生成拟态。缺氧环境中胶质瘤细胞的EGFR蛋白的表达明显上调,进而激活AKT/PI3K通路,最终诱导血管生成拟态的形成。可见EGFR/AKT/PI3K通路在血管生成拟态的形成过程中起着十分重要的作用。EGFR/ AKT/PI3 K通路也可作为分子靶点,用于抑制血管生成拟态,达到治疗肿瘤的目的。
[1]LIU XM,ZHANG QP,MU YG,et al.Clinical significance of vasculogenic mimicry in human gliomas[J].J Neurooncol,2011,105(2):173-179.
[2]TANG NN,ZHU H,ZHANG HJ,et al.HIF-1αinduces VE-cadherin expression and modulates vasculogenic mimicry in esophageal carcinoma cells[J].World J Gastroenterol,2014,20(47):17894-17904.
[3]QI H,SUN B,ZHAO X,et al.Wnt5a promotes vasculogenic mimicry and epithelial-mesenchymal transition via protein kinase Cαin epithelialovarian cancer[J].Oncol Rep,2014,32(2):771-779.
[4]LI Y,CAI W,YI Q,et al.Lipid droplets may lay a spacial foundation for vasculogenic mimicry formation in hepatocellular carcinoma[J].Med Hypotheses,2014,83(1):56-59.
[5]SONG Y,MU L,HAN X,et al.Micro RNA-9 inhibits vasculogenic mimicry of glioma cell lines by suppressing Stathmin expression[J].J Neurooncol,2013,115(3):381-390.
[6]YAO XH,PING YF,BIAN XW.Contribution of cancer stem cells to tumor vasculogenic mimicry[J].Protein Cell,2011,2(4):266-272.
[7]BEDI U,MISHRA VK,WASILEWSKI D,et al.Epigenetic plasticity:A central regulator of epithelial-to-mesenchymal transition in cancer[J].Oncotarget,2014,5(8):2016-2029.
[8]RIZVI I,GURKAN UA,TASOGLU S,et al.Flow induces epithelial-mesenchymal transition,cellular heterogeneity and biomarker modulation in 3D ovarian cancer nodules[J].Proc Natl Sci USA,2013,110(22):E1974-1983.
[9]PAULISYW,SOETEKOUW PM,VERHEUL HM,et al.Signalling pathways in vasculogenic mimicry[J].Biochim Biophys Acta,2010,1806(1):18-28.
[10]BASU GD,LIANG WS,STEPHAN DA,et al.An novel role for cyclooxygenase-2 in regulating vasuclar channel formation by human breast cancer cells[J].Breast Cancer Res,2006,8(6):R69.
[11]FAN YZ,SUN W.Molecular regulation of vasculogenic mimicry in tumors and potential tumor target therapy[J].World J Gastrointest Surg,2010,2(4):117-127.
[12]KIRSCHMANN DA,SEFTOR EA,HARDY KM,et al.Molecular pathways:vasculogenic mimicry in tumor cells:diagnostic and therapeutic implications[J].Clin Cancer Res,2012,18(10):2726-2732.
[13]张熙,郭世文,尉春艳.缺氧诱导SHG44细胞拟态血管的形成及相关机制[J].中华神经外科疾病研究杂志,2011,10(3):218-221.
(编辑 韩维栋)
The effect and mechanism of epithelial growth factor receptor(EGFR)in inducing vasculogenic mimicry formation
ZHANG Xi1,ZHAO Qi-mei2,WEI Chun-yan3
(1.Department of Neurosurgery,the Second Affiliated Hospital of Xi’an Jiaotong University Health Science Center,Xi’an 710004;2.Department of Emergency,Yanqiao Hospital,Shiyan 442000;3.Department of Obstetrics and Gynecology,the Second Affiliated Hospital of Xi’an Jiaotong University Health Science Center,Xi’an 710004,China)
ObjectiveTo investigate the effect and mechanism of EGFR in inducing vasculogenic mimicry(VM)formation.MethodsImmunohistochemistry was used to detect the expression of EGFR protein and CD34-PAS double staining was used to detect the VM in gliomas paraffin blocks.The migration and VM formation of U87 cell in hypoxic and normoxic groups were detected by transwell and three-dimensional culture.Then we used Western blot to detect the expressions of EGFR,AKT and PI3K protein.ResultsThe positive rate of EGFR expression in VM positive patients was 94.4%,which was significantly higher than that in VM negative patients(71.8%).In hypoxic group,the abilities of migration and VM formation were significantly higher those in normoxic group.The expressions of EGFR,AKT and PI3 K were higher in hypoxic group.ConclusionVM formation can be induced by the activation of EGFR/AKT/PI3K signaling pathway.EGFR is very important for VM formation.
vasculogenic mimicry;hypoxia;glioma;EGFR/AKT/PI3 K signaling pathway
R739.41
A
10.7652/jdyxb201506005
2015-01-18
2015-03-19
陕西省社会发展攻关计划资助项目(No.2014K11-01-01-12)
Supported by the Social Development Research Project of Shaanxi Province(No.2014K11-01-01-12)
尉春艳.E-mail:weichy1023@163.com
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20150928.1603.016.html(2015-09-28)

