内质网应激在高脂饲料诱导幼年大鼠脂肪性肝损伤中的作用
刘 亮,肖延风,尹春燕,张卫琴,3
(1.西安交通大学医学部第二附属医院儿科,陕西西安 710004;2.西安市儿童医院,陕西西安 710003;3.浙江大学附属儿童医院,浙江杭州 310003)
◇基础研究◇
内质网应激在高脂饲料诱导幼年大鼠脂肪性肝损伤中的作用
刘 亮1,2,肖延风1,尹春燕1,张卫琴1,3
(1.西安交通大学医学部第二附属医院儿科,陕西西安 710004;2.西安市儿童医院,陕西西安 710003;3.浙江大学附属儿童医院,浙江杭州 310003)
目的研究内质网应激在高脂饮食所致肝损伤中的作用及其机制。方法48只刚断乳雄性SD大鼠,随机分为高脂组和对照组。分别采用高脂饲料和普通饲料喂养,在第8、12、16周末测量体质量、内脏脂肪质量及肝脏质量;检测血清肝功能;HE染色观察肝脏病理变化;透射电镜观察肝脏内质网情况;RT-PCR法检测两组大鼠肝细胞内活化转录因子6(ATF6)、糖调节蛋白78(GRP78)m RNA的表达。结果①高脂组大鼠体质量和内脏脂肪质量明显高于对照组(P<0.05)。②高脂组谷丙转氨酶(ALT)及谷草转氨酶(AST)均随时间延长轻度升高(P>0.05),ALT在第16周与对照组有显著差别(P<0.05)。③HE染色光镜下可见高脂组在第8周肝内出现小泡性脂肪变性,12~16周时,肝脏脂肪变性进一步加重。④电镜下可见,8周时,高脂组大鼠肝细胞内聚集大量脂滴,结构基本清晰,粗面内质网结构基本正常;12周及16周,细胞内脂滴增加,粗面内质网池内可见线样结构沉积。⑤高脂组大鼠肝组织内ATF6、GRP78 m RNA在各个时间点均显著高于对照组(P<0.05)。结论幼年高脂饮食可引起内脏脂肪聚集、肝细胞脂肪变性及肝功损伤。高脂饮食诱导肝损伤的机制可能与ATF6介导的内质网应激密切相关。
内质网应激;肝损伤;幼年大鼠;高脂饮食;非酒精性脂肪性肝炎
近些年来,随着社会的快速发展,肥胖越来越成为全球关注的疾病。全球范围流行病调查表明,超过1亿人群达到超重水平,肥胖占30%,超过10%学龄儿童达到超重[1]。随着肥胖在全球的流行,肥胖伴发非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)的状况也越来越受到关注。目前,NAFLD是最常见的慢性肝脏疾病[2-3]。NAFLD在普通儿童中的发病率为3%,而在肥胖儿童的发病率为80%[4]。NAFLD导致肝脏损害的主要病理表现为非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH),进而发展为肝脏纤维化和肝硬化。肝细胞富含内质网,为脂肪酸代谢的第一场所。内质网含有大量的三酰甘油合成酶,在脂肪酸的代谢中有着重要的作用。并且,内质网是一个非常敏感的细胞器,当受到刺激时,会出现错误折叠与未折叠蛋白在腔内聚集及细胞内钙离子平衡紊乱,称为内质网应激(endoplasmic reticulum stress,ERS)。近期文献显示内质网平衡紊乱或内质网应激参与脂肪肝向NASH的转化和进展[5]。本研究建立幼年大鼠高脂饮食模型,观察高脂膳食对幼年大鼠肝脏脂肪变性及肝功能影响,采用RT-PCR方法检测活化转录因子6(activating transcription factor-6,ATF6)、糖调节蛋白78(glucose regulated protein78,GRP78)mRNA在肝细胞的表达,探究其在高脂膳食诱导肥胖大鼠脂肪肝及肝损伤中的作用。
1 材料与方法
1.1 动物饲养与分组购自西安交通大学医学部实验动物中心刚断乳SPF级的雄性SD大鼠48只,体质量约为40~60 g。随机分为高脂组和对照组,每组各24只。对照组给予无菌普通饲料,高脂组给予无菌高脂饲料。各组又分为8、12、16周组,每组8只。饲养室温度22~24℃,光照8∶00~20∶00,自由进食。普通饲料(普通清洁级动物基础饲料)和高脂饲料(普通饲料+20%蔗糖+10%的猪油+5%蛋黄粉+1%的胆固醇)[6]。饲料由西安交通大学医学部实验动物中心加工制成。
1.2 标本采集与制备分别在饲养8、12、16周留取标本。前一天20∶00后禁食,次日晨先称质量,后用100 g/L水合氯醛按0.3 m L/100 g腹腔注射麻醉;心脏穿刺采集血液,用于肝功指标测定;摘除肝脏称质量;切取1 mm3肝组织,25 g/L戊二醛初固定,于12 h内送电镜室制备电镜标本;取5 mm3肝脏组织2块,液氮罐储存,备用RT-PCR检测;再取约1 cm3肝组织2块,40 g/L多聚甲醛溶液固定、石蜡包埋,行HE染色。完整剥离双侧附睾脂肪和两侧肾周脂肪垫,称质量[5]。
1.3 HE染色摘除肝脏后,迅速肉眼观察肝脏的色泽、触摸质地,将肝脏组织石蜡包埋,采用人工操作HE染色方法,常规脱蜡、染色、脱水、透明等操作后封片,显微镜下观察、拍照并进行图像分析。
1.4 电镜标本制备肝脏组织块依次在25 g/L戊二醛固定液和10 g/L四氧化锇固定液4℃后固定;乙醇梯度脱水;然后浸入还氧丙烷置换;环氧树脂Epon812浸透、包埋,聚合后制作半超薄切片(1~2μm),美兰染色后在光学显微镜下定位,使用瑞典LKB-Ⅴ型超薄切片机进行超薄切片(50~70 nm),醋酸铀、柠檬酸铅染色后,于日本日立H-600透射式电子显微镜下观察、拍照。
1.5 血清学肝功能结果测定心脏穿刺采血,于4 000 r/min的低温离心机上离心10 min,送至西安交通大学医学部第二附属医院检验科使用自动生物分析仪(奥林帕斯,AU5400,日本)测定血清中丙氨酸氨基转移酶(alanine aminotransferase,ALT)和天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)。
1.6 RT-PCR检测GRP78、ATF6 mRNA表达①提取RNA:采用RNAfast200总RNA急速抽提试剂盒提取肝组织的总RNA。取总RNA液于紫外分光光度计下测定其A260/280的值,选取A值在1.9~2.1间的总RNA溶液备用,并于-70℃冰箱储存。②逆转录反应:采用Revert AidTMFirst Strand cDNA Synthesis Kit试剂盒逆转录RNA。将合成的cDNA储存于-70℃冰箱中,备用。③引物制备:ATF6、GRP78引物由上海生工生物工程有限公司设计合成,内参GAPDH由陕西先锋生物科技有限公司设计合成。④PCR检测:采用Dream TaqTMGreen PCR Master Mix进行扩增,待试剂盒中的试剂溶解后,轻轻混匀,并瞬时离心;取200μL无菌无酶的PCR管置于冰上,按以下顺序加入反应物:Dream TaqTMGreen PCR Master Mix(2×)12.5μL,Forward primer 1μL,Reverse primer 1μL,Template DNA 1μL,Water,nuclease-free 9.5μL;将混合物轻轻摇晃,并瞬时离心;置于PCR仪上,按下述条件进行反应:预变性95℃3 min×1 cycle,变性95℃30 s,退火55℃30 s×35 cycle,延伸72℃30 s,再延伸72℃5 min×1 cycle。⑤琼脂糖凝胶电泳:放置制胶板,用移液器将上述扩增好的样本小心加入各点样孔中,同时加入相同量的DNA Marker以识别样本大小。电泳约40 min,在紫外灯下观察结果,并使用凝胶成像系统拍照。⑥图像半定量分析:使用Gel-Pro专业图像分析软件进行扫描,测定产物条带的积分吸光度(IA),并与相应的内参GAPDH的IA值相比,确定各目的基因mRNA在肝脏组织中的相对表达含量。
1.7 统计学分析所有数据资料的分析均使用SPSS13.0统计软件分析处理。数据采用均数±标准差()表示。采用Shapiro-Wilk检验及Levene检验检测数据的正态性及方差齐性,根据情况,选择t检验或Mann-Whitney U检验比较两组均数,P<0.05为差异有统计学意义。
2 结 果
2.1 两组大鼠体质量的比较高脂组大鼠体质量从第5周开始显著高于对照组(P<0.05,图1)。第14周开始,两组大鼠体质量均增长较慢,呈现“平台期”,虽然高脂组大鼠的体质量仍然较高,但与对照组已没有统计学意义(P>0.05,图1)。
2.2 两组大鼠内脏脂肪质量的比较第8、12、16周两组大鼠的内脏脂肪质量比较,高脂组大鼠内脏脂肪质量均显著大于对照组(P<0.05,图2)。
2.3 两组大鼠血清肝功能指标的比较高脂组谷丙转氨酶及谷草转氨酶水平随着时间的延长呈逐渐升高趋势,谷丙转氨酶在第16周时与对照组有显著差别(P<0.05,图3)。

图1 两组大鼠体质量的比较Fig.1 Comparison of body weight of young rats in different groups

图2 两组大鼠脂肪质量的比较Fig.2 Comparison of visceral fat weight of young rats in different groups
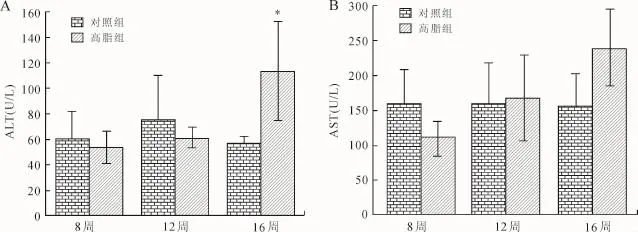
图3 两组大鼠肝功能指标的比较Fig.3 Comparison of liver function of young rats in different groups
2.4 两组大鼠肝脏质量的比较高脂组肝脏质量从8周起均显著高于对照组(P<0.05,图4)。

图4 两组大鼠肝脏质量的比较Fig.4 Comparison of liver weight of young rats in different groups
2.5 两组大鼠肝细胞的形态学变化①肝脏大体形态:高脂组大鼠的肝脏明显肿大,颜色变黄,有油腻感,质地松脆,并且随着时间的延长而加重,而对照组大鼠肝脏颜色深红、质软,边缘锐利。②肝脏光镜下特点:HE染色光镜下观察,对照组大鼠肝细胞形态基本正常;高脂组大鼠肝细胞在8、12、16周时均出现不同程度的脂肪变性,肝细胞肿大,胞质疏松并可见大小不等的脂滴空泡,肝细胞脂肪变性程度随着时间的延长而加重。③肝脏电镜下特点:对照组形态基本正常;高脂组8周时肝细胞内脂滴蓄积,结构基本清晰,细胞核基本呈圆形,核内染色质轻度凝集,细胞质内线粒体轻度肿胀,粗面内质网结构基本正常,附着的核糖体可见;高脂组12周时,细胞内见大量脂滴,细胞核呈圆形,细胞核内染色质轻度凝集,细胞质内线粒体轻度肿胀,粗面内质网池内可见到线样结构沉积;高脂组16周时,肝细胞内可见大量脂滴,细胞结构清晰,细胞质内线粒体嵴结构清晰,粗面内质网表面附着的核糖体可见,内质网池内可见到线样结构沉积(图5)。

图5 两组大鼠肝细胞超微结构的变化Fig.5 Comparison of liver cell structure of young rats in different groups
2.6 两组大鼠肝组织ATF6 mRNA的表达高脂组大鼠在8、12、16周时,肝细胞内ATF6 mRNA表达均较对照组明显增高(P<0.05,图6),对照组ATF6 mRNA的表达随着时间的延长无明显改变,而高脂组随着时间的延长,ATF6 mRNA的表达水平逐渐增加,呈时间依赖效应。
2.7 两组大鼠肝组织内GRP78 mRNA的表达高脂饮食组在8、12、16周时,肝细胞内GRP78 mRNA表达均较对照组明显增高(P<0.05),对照组的GRP78 mRNA表达随着时间的延长无明显改变,而高脂组随着时间的延长,GRP78 mRNA的表达水平逐渐增加,呈时间依赖效应。且随着时间的延长,增加更为明显(图7)。
3 讨 论
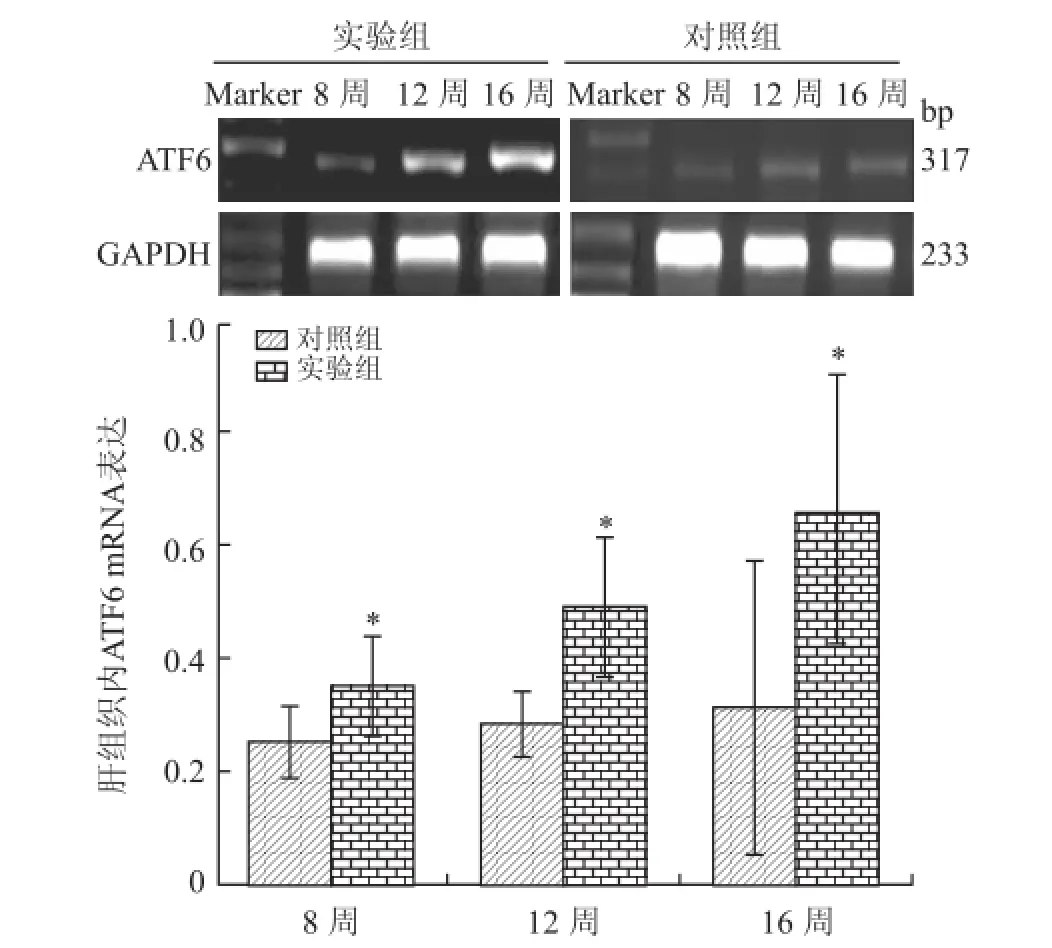
图6 两组大鼠肝组织ATF6 m RNA表达的比较Fig.6 Comparison of ATF6 mRNA expression of young rats in different groups

图7 两组大鼠肝组织内GRP78 mRNA表达的比较Fig.7 Comparison of GRP78 m RNA expression in young rats in different groups
在世界范围内,肥胖已成为危害人类健康的重要影响因素之一。近10年来超重或肥胖的儿童所占的比例逐年快速的增加。WTO专家估计,世界上5岁以下肥胖儿童将超过4 300万,到2020年世界上肥胖引起的相关性疾病将占据疾病谱的60%[7]。肥胖不仅危害着人们的健康,同时也增加了人们的健康支出。肥胖患者在医疗卫生上的个人支出较体质量正常者高出将近30%,肥胖不仅给个人,也给社会增加了沉重的负担[8]。目前,引起肥胖的确切原因还不明确,但高脂饮食无疑在肥胖的发生中起着相当重要的作用。内质网的功能是通过调节蛋白质合成、折叠和运输维持蛋白质平衡。当内质网的生理功能发生紊乱时,内质网腔内出现错误折叠与未折叠蛋白在腔内聚集,可引起内质网非折叠蛋白反应(unfolded protein response,UPR)。GRP78是位于内质网中的一种糖蛋白,又被称为免疫球蛋白重链结合蛋白(immunoglobulin heavy chain binding protein,Bip),是内质网中重要的分子伴侣,为热休克蛋白70家族中的一员[9],它能够调节蛋白的折叠、传递以及降解。当发生内质网应激时,GRP78的表达异常增高,是判断内质网应激的标志性蛋白。ATF6位于内质网膜中,是一种Ⅱ型跨膜蛋白,它的分子量为90 ku,当出现内质网应激时它会被酶解成50 ku大小的片段进入细胞核,成为转录因子,启动内质网应激相关基因的表达,如GRP94、GRP78等。它参与ERS中的UPR反应,它的过度表达是判断内质网应激UPR信号通路的良好指标。
为了探究肝细胞中是否存在ERS,本研究首先通过透射电镜观察高脂组与对照组大鼠中肝细胞内质网的变化。结果发现,在高脂喂养第8周时,肝细胞内仅可见大量脂滴,粗面内质网结构基本正常,而在12及16周时,肝细胞内粗面内质网池中可见到线样蛋白物质沉积,但粗面内质网上附着的核糖体仍可见。据此,我们推测这种线样蛋白物沉积,就是UPR反应中的未折叠蛋白的积聚,表明UPR反应参与高脂饮食性肝损伤的发病机制。
进一步我们采用RT-PCR法检测了大鼠肝组织中GRP78及ATF6基因的表达,结果发现高脂组在8、12、16周时GRP78及ATF6基因的表达均进行性增高,与对照组有统计学差异(P<0.05)。同时,WANG等[10]在研究中发现,通过高饱和脂肪酸喂养Wistar大鼠,结果发现GRP78/Bip等ERSb标志分子基因表达均增高,提示存在ERS。而DHAHBI等[11]研究发现,通过长时间的限制饮食可以降低小鼠肝脏中GRP94及GRP78 mRNA的含量,并且随着m RNA含量的下降相应蛋白也随之下降,这又从反方向验证了我们的实验结果。这就提示了高脂饮食可引起肥胖大鼠肝脏脂肪变性、脂肪性肝炎,且存在ATF6介导的内质网应激反应,提示高脂饮食诱导的大鼠NAFLD与ERS密切相关,ERS可能是高脂饮食所致NAFLD的机制之一。
在本实验中,我们还可以看出,通过对幼年大鼠进行长期高脂饮食喂养,两组大鼠体质量及内脏脂肪含量均发生明显变化。与对照组相比,高脂组大鼠体质量及内脏脂肪含量均随着时间延长而升高,尤其是内脏脂肪含量,在第8周、12周、16周时高脂组大鼠的内脏脂肪均较对照组高,两组间有明显差异(P<0.05)。以上结果说明,使用高脂饲料饲养大鼠确实可以导致大鼠体质量增加而引起肥胖,而且这种肥胖是内脏脂肪增加的腹型肥胖。在国内,一项针对145例单纯性肥胖儿童的调查显示,儿童单纯性肥胖是以腹型肥胖为主的,腹型肥胖的儿童比非腹型肥胖的儿童更容易发生代谢紊乱[12]。而另一项针对286例肥胖患儿的研究也显示了,儿童期的腹型肥胖和心血管危险因素的发生密切相关,并且相较其他危险因素其胰岛功能更值得关注[13]。因此,儿童期的肥胖更需我们警惕及长期密切关注。
儿童NAFLD病理改变包括从单纯脂肪肝变性到非酒精性脂肪性肝炎(NASH)等一系列肝脏病理改变[4,14]。脂肪肝早期表现为脂肪浸润。本研究可以看到,与对照组比较,高脂组大鼠肝脏明显肿大、色黄,有油腻感,质地松脆,并且随着时间的延长而加重。第8、12、16周高脂组大鼠肝脏质量均显著高于对照组(P<0.05),且肝细胞肿大,脂肪变性,胞质疏松并可见大小不等的脂滴空泡,肝细胞脂肪变性程度随着时间的延长而加重。表明在第8、12、16周大鼠肝脏细胞中均有脂肪堆积,即表现为NAFLD。此时多数NAFLD儿童并无肝病相关症状,但患儿的肝脏其实已经出现明显的损害。血清转氨酶是反映肝脏损伤的一个非常灵敏的指标,也常常被作为诊断肝炎的指标。转氨酶的种类较多,但以ALT及AST最为常用。由于肝细胞内转氨酶浓度比血清中高出1 000~5 000倍,在肝细胞膜的通透性增加时,即使肝细胞没有坏死,细胞内的转氨酶也可以渗透入血中。因此,血清转氨酶是肝细胞损伤的敏感指标。本研究中,高脂组大鼠血清ALT、AST均随着时间的延长而增高,提示肝脏发生了损害,但ALT敏感性高于AST,高脂组大鼠血清中ALT水平在16周时显著高于对照组(P<0.05)。值得一提的是,本实验中,肝脏在8周时已出现明显的脂肪变性(电镜下),但ALT在16周时才出现显著差别(P<0.05),提示当发现肝功出现异常时,脂肪肝已经在机体中发生发展了一段时间。因此,这就说明了,虽ALT是反应肝脏损伤的敏感指标,但它并不能早期反应病情,亦不能提前预警。据此,我们认为幼年高脂饮食可引起内脏脂肪聚集、肝细胞脂肪变性、肝功损伤,高脂饮食诱导肝损伤的机制可能与ATF6介导的内质网应激密切相关,高脂饮食在内质网应激及NAFLD中均起着重要作用。
随着社会经济条件的发展,饮食方面越来越偏向高脂高糖,越来越多的儿童患有肥胖症,从而可能出现NAFLD。患有NAFLD危害相当大,因其早期无特异性症状,难以早期识别及发现,可以继续发展为肝纤维化及肝硬化,产生严重后果。至今已有数例肥胖儿童NASH并发肝硬化的报道,对家庭及社会均造成严重的伤害及负担。好在儿童NAFLD是一种可逆性疾病,早期发现及治疗可避免该病恶化,使患儿重获健康。因此,合理控制饮食是我们预防及治疗NAFLD的一个关键环节。通过饮食控制、体育锻炼及改变生活方式是治疗儿童和青少年NAFLD的最主要方法[4,15]。同时,越来越多的研究表明,内质网应激在NAFLD发病中起着重要的作用,随着分子生物技术的进一步发展,或许会为肥胖儿童NAFLD的早期诊断及治疗提供新的思路。
[1]SHARMA M.Dietary education in school-based childhood obesity prevention programs[J].Adv Nutr,2011,2(2):207S-216S.
[2]PAPANDREOU D,ANDREOU E.Role of diet on non-alcoholic fatty liver disease:An updated narrative review[J]. World J Hepato,2015,7(3):575-582.
[3]Abd El-KADER SM,El-Den ASHMAWY EM.Non-alcoholic fatty liver disease:The diagnosis and management[J].World J Hepatol,2015,7(6):846-858.
[4]SINGER C,STANCU P,COSOVEANU S,et al.Non-alcoholic fatty liver diesease in children[J].Curr Health Sci J,2014,40(3):170-176.
[5]MOSLEHI A,NABAVIZADEH F,DEHPOUR AR,et al.Naltrexone attenuates endoplasmic reticulum stress induced hepatic injury in mice[J].Acta Physiol Hung,2014,101(3):341-352.
[6]陈璐璐,李凝旭,邓向群.限食对高脂喂养大鼠肝脏内质网应激的影响[J].中国病理生理杂志,2008,24(3):568-572.
[7]KELISHADI R,AZIZI-SOLEMAN F.Controlling childhood obesity:A systematic review on strategies and challenges[J].J Res Med Sci,2014,19(10):993-1008.
[8]WITHROW D,ALTER DA.The economic burden of obesity worldwide:A systematic review of the direct costs of obesity[J].Obes Rev,2011,12(2):131-141.
[9]DAUGAARD M,ROHDE M,JAATTELA M.The heat shock protein 70 family:Highly homologous proteins with overlapping and distinct functions[J].FEBS Letters,2007,581(19):3702-3710.
[10]WANG D,WEI Y,PAGLIASSOTTI MJ.Saturated fatty acids promote endoplasmic reticulum stress and liver injury in rats with hepatic steatosis[J].Endocrinology,2006,147(2):943-951.
[11]DHAHBI JM,MOTE PL,TILLMAN JB,et al.Dietary energy tissue-specifically regulates endoplasmic reticulum chaperone gene expression in the liver of mice[J].J Nutr,1997,127(9):1758-1764.
[12]余洁,熊丰,朱岷,等.不同类型肥胖儿童代谢紊乱的特点[J].解放军医学杂志,2010,35(1):101-103.
[13]鲍鹏丽,刘戈力,杨箐岩,等.儿童腹型肥胖与心血管代谢危险因素关系的研究[J].天津医科大学学报,2010,16(3):509-511.
[14]BRUNT EM.Pathology of nonalcoholic fatty liver disease[J]. Nat Rev Gastroenterol Hepatol,2010,7(4):195-203
[15]NOBILI V,ALISI A,RAPONI M.Pediatric non-alcoholic fatty liver disease:preventive and therapeutic value of lifestyle intervention[J].World J Gastroenterol,2009,15(48):6017-6022.
(编辑 韩维栋)
Effects of endoplasmic reticulum stress on hepatocellular injury in young rats fed with high-fat diet
LIU Liang1,2,XIAO Yan-feng1,YIN Chun-yan1,ZHANG Wei-qin1,3
(1.Department of Pediatrics,the Second Affiliated Hospital of Xi’an Jiaotong University Health Science Center,Xi’an 710004;2.Xi’an Children’s Hospital,Xi’an 710003;3.Children’s Hospital,Zhejiang University School of Medicine,Hangzhou 310003,China)
ObjectiveTo study the effects of endoplasmic reticulum stress on liver damage in young rats fed with high-fat diet.MethodsWe divided 48 male weaned young rats randomly into high-fat diet group and control group,which were separately fed with high-fat diet and normal diet.After feeding 8,12 and 16 weeks,the body weight and visceral fat of the rats were measured.The serum liver function was measured.The morphology of livers was observed by HE and transmission electron microscopy.The m RNA expressions of ATF6 and GRP78 in hepatocytes were measured with RT-PCR.Results①The body weight and visceral fat weight of rats in high-fat diet group increased compared with those in control group(P<0.05).②Alanine aminotransferase and aspartate aminotransferase in high-fat diet group increased slightly over time(P>0.05);alanine aminotransferase at week 16 was increased significantly compared with that in controls(P<0.05).③Liver cells in high-fat diet group had steatosis at week 8 and the steatosis became more serious between week 12 and week 16.④In high-fat diet group at week 8 there were a large number of lipid droplets in the cytoplasm,and the cell structure was close to that of normal cells;rough endoplasmic reticulum was nearly normal and the ribosome was visible.At week 12 and week 16,besides a large number of lipid droplets,we could also see that some substances with line-like structure deposited in rough endoplasmic reticulum pool.⑤The expressions of ATF6 and GRP78 m RNA in hepatocytes in high-fat group at weeks 8,12 and 16 were significantly increased compared with those in control group(P<0.05).ConclusionHigh-fat diet in infants can cause visceral fat accumulation,fatty degeneration of hepatocytes and liver injury.ATF6-mediated endoplasmic reticulum may be closely related to the liver injury which results f rom highfat diet.
endoplasmic reticulum stress;hepatocellular injury;young rat;high-fat diet;nonalcoholic steatohepatitis(NASH)
Q493.5
A
10.7652/jdyxb201506002
2014-11-24
2015-04-25
国家自然科学基金资助项目(No.81172689);西安交通大学医学部第二附属医院重大科研方向资助计划[No.YJ(ZDJH)2013(03)]
Supported by the National Natural Science Foundation of China(No.81172689),Important Scientific Projects of the Second Affiliated Hospital of Xi'an Jiaotong University Health Science Center[No.YJ(ZDJH)2013(03)]
肖延风.E-mail:xiaoyanfeng0639@sina.com
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20150928.1610.018.html(2015-09-28)
——疾病防治的新靶标

