粒细胞集落刺激因子对兔慢性心肌缺血的保护作用
赵庆斌,周 娟,吴 岳,田雨灵,刘治全
(西安交通大学医学部第一附属医院:1.老年内科;2.心内科,陕西西安 710061)
◇基础研究◇
粒细胞集落刺激因子对兔慢性心肌缺血的保护作用
赵庆斌1,周 娟2,吴 岳2,田雨灵2,刘治全2
(西安交通大学医学部第一附属医院:1.老年内科;2.心内科,陕西西安 710061)
目的探讨粒细胞集落刺激因子(G-CSF)对慢性心肌缺血的保护作用及其机制。方法雄性日本大耳白兔为研究对象,开胸后不全结扎冠状动脉左前降支,建立慢性心肌缺血模型。将成功制备的模型兔随机分为2组,即G-CSF干预组和对照组。应用流式细胞术测定外周血CD34+细胞百分率,应用免疫组化法测定心肌组织CD34+细胞归巢和vWF的表达。结果G-CSF明显提高慢性心肌缺血模型兔的生存率,增加外周血CD34+细胞百分率,促进缺血心肌组织中CD34+细胞归巢和vWF表达。结论G-CSF对兔慢性心肌缺血损伤具有明显保护作用,其机制与外周血CD34+细胞动员和归巢于缺血心肌以及促进血管新生有关。
粒细胞集落刺激因子;心肌缺血;血管新生;CD34+
粒细胞集落刺激因子(granulocyte-colony-stimulating factor,G-CSF)是25 ku的糖蛋白分子,由单核细胞/巨噬细胞和淋巴细胞等产生。G-CSF可以刺激中性粒细胞及其前体细胞增生。体外研究证实,G-CSF可以直接刺激内皮细胞迁移和增殖[1],修复机械损伤的内皮单细胞层及生成毛细血管样结构[2]。G-CSF也能促进血管平滑肌细胞增殖[3]。有研究表明,G-CSF具有直接的心脏保护作用[4]。缺血性心脏病是当前人类死亡的主要原因之一。本研究探讨G-CSF对兔慢性心肌缺血模型的保护作用和潜在机制,为G-CSF治疗缺血性心脏病提供理论基础。
1 材料与方法
1.1 材料兔淋巴细胞分离液购于北京普利莱基因技术有限公司;CD34单克隆抗体及阴性对照购于B.D.公司;G-CSF(商品名:立生素300μg/支)购于北京双鹭药业股份有限公司;CD34和vWF因子免疫组化试剂盒均购于武汉博士德生物工程有限公司。Beckman Coulter公司流式细胞仪由西安交通大学医学部实验中心提供。雄性日本大耳白兔88只,体质量2~3 kg,购于西安交通大学医学部实验动物中心。实验前,实验动物在动物中心适应性喂养1周。
1.2 兔慢性心肌缺血模型制备[5]30 g/L戊巴比妥钠(30 mg/kg)耳缘静脉麻醉。随后经耳缘静脉注射利多卡因(1 mg/kg),以预防冠状动脉结扎过程中发生室性心律失常。将兔仰卧位固定于手术台上,备皮,沿胸骨左缘剪断左侧第3~4肋软骨,暴露纵隔和心脏,保持两侧胸膜完整,距左冠状动脉冠状窦开口4~5 mm处,用5/0无损伤带针缝合线穿过左前降支下方,将直径分别为0.8 mm和0.1 mm的粗、细丝线各一根置于左前降支前缘,将丝线与左前降支一起结扎,随后迅速抽出细丝线,相当于血管90%狭窄。观察左前降支远端血管充盈不明显,左心室前壁和心尖部心肌颜色稍变暗,表明结扎成功。术后常规饲养,肌肉注射青霉素(40万单位/只)3 d预防感染。
1.3 实验分组88只模型兔随机分成2组。GCSF干预组(G-CSF组,n=44);应用G-CSF 10μg/(kg·d)皮下注射,每日1次,共6 d;对照组(n=44),应用等量的生理盐水皮下注射模型兔,其余同G-CSF干预组。各组中的20只用于生存分析,观察28 d,另外24只用于细胞和组织分析。
1.4 生存分析观察G-CSF干预组和对照组各20只动物28 d生存状况,任何原因的死亡均为终点事件。
1.5 外周血CD34+细胞百分率测定各组的另外24只兔,分别于术后1、3、7、28 d,自耳缘静脉取血5 m L,肝素抗凝,用淋巴细胞分离液分离外周血单个核细胞。取2×106个细胞,分别加入10μL CD34单克隆抗体和荧光素藻红蛋白标记(阴性对照),室温避光孵育20 min,用流式细胞仪检测外周血中CD34+细胞百分率。
1.6 CD34+细胞和vWF免疫组化染色于术后1、3、7、28 d处死动物,取出心脏,将缺血心肌组织放入40 m L/L中性甲醛缓冲液中固定16 h后,常规石蜡包埋并制作4~5μm厚切片,贴于洁净的载玻片上,室温过夜之后存放于干燥避光处备用。按照试剂盒说明书采用SP法进行CD34+细胞和v WF(1∶100)免疫组化染色。
结果判断:CD34阳性着色表现为胞质染成棕色或棕黄色。在400倍光学显微镜下,每张切片随机取3个视野数出CD34+细胞,求其均值作为最终值。微血管计数标准:抗vWF抗体是最特异的内皮细胞标记物,能较好地显示组织中的小血管和毛细血管,作为反映血管生成的间接手段。血管内皮细胞被染成棕黄色。低倍光学显微镜(100倍)下找到血管密度较大区域,再转到高倍视野(200倍)下精确计数每高倍视野下的微血管数量。单个内皮细胞、内皮细胞簇、微小血管均予计数。随机测定8个视野,取其均值作为测定值。
1.7 统计学分析应用GraphPad Prism 4.0统计软件进行数据分析。计量资料以均数±标准差表示,组间比较采用两因素方差分析及LSD-t检验,P<0.05为差异具有统计学意义。应用Kaplan-Meier乘积限法估计生存率,应用Log-rank检验比较两组生存时间。
2 结 果
2.1 生存分析结果应用Kaplan-Meier分析结果显示,G-CSF干预慢性心肌缺血模型兔的28 d生存时间明显提高,G-CSF干预组和对照组兔28 d生存率分别为75%和40%(P<0.05,图1)。

图1 G-CSF干预组与对照组的生存分析Fig.1 Analysis of the rabbits’survival from chronic myocardial ischemia in G-CSF and control groups
2.2 外周血CD34+细胞百分率检测结果G-CSF干预组兔在术后第1、第3、第7和第28天,外周血CD34+细胞百分率显著高于相应时间点的对照组(n=6,P<0.01)。在术后第7天,干预组和对照组外周血CD34+细胞百分率均明显高于其他时间点(P<0.01,图2)。提示G-CSF能显著提高心肌缺血早期的外周血CD34+细胞百分率。

图2 G-CSF干预组和对照组外周血CD34+细胞百分率的变化Fig.2 Changes of CD34-positive cell percentage in the peripheral blood of model rabbits
2.3 缺血心肌组织中CD34+细胞的表达情况免疫组化染色结果显示,在术后第7天,G-CSF干预组缺血心肌组织中CD34+细胞数目明显高于相应的对照组;在术后第28天,两组缺血心肌组织中均未观察到CD34+细胞(图3)。
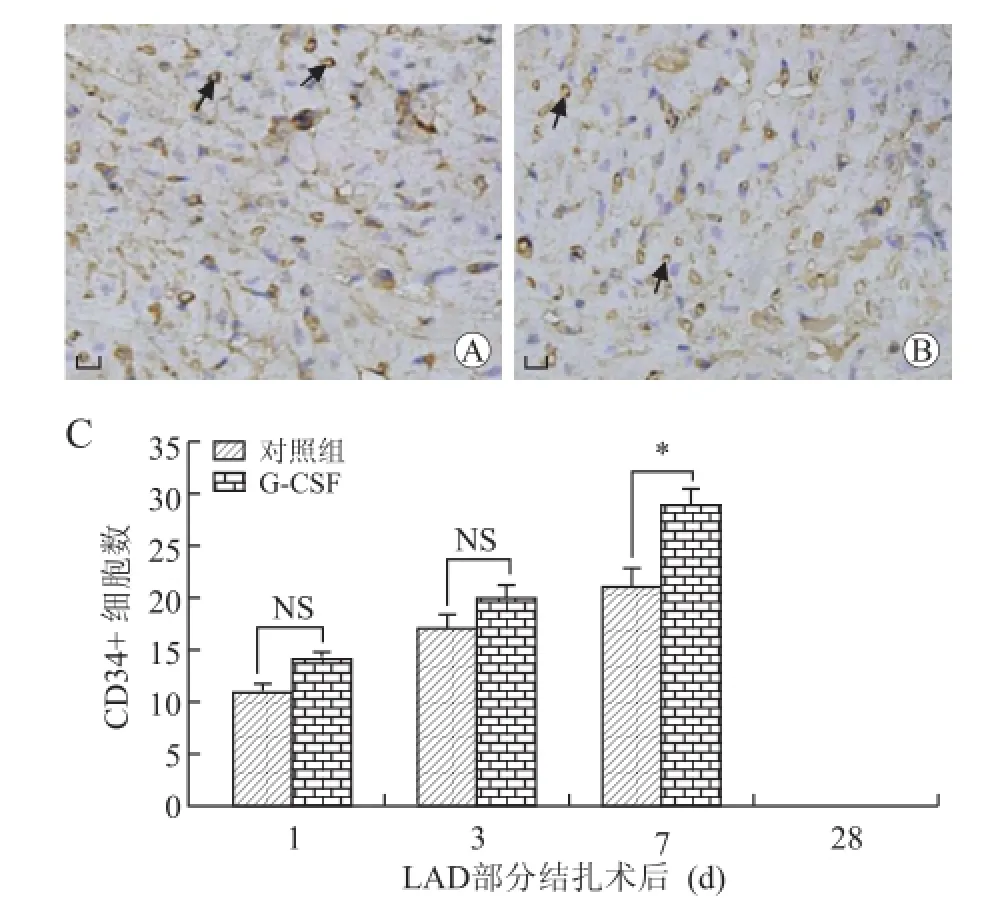
图3 术后28 d对照组(A)和G-CSF干预组(B)缺血心肌组织中CD34+细胞染色和各组细胞计数(C)Fig.3Resultsof immunocytomitry for the CD34-stained sections in control group(A)and G-CSF group(B)at day 28 post-operation,and the number of CD34+cells in ischemic myocardium at different time points(C)
2.4 缺血心肌组织中vWF的表达结果应用免疫组化法观察缺血心肌组织中v WF表达以确定内皮细胞数目,并计数vWF染色阳性血管,在高倍视野下(200倍)随机测定8个视野,取其均值作为测定值。在术后第28天,干预组[(33.6±10.4)/mm2)]较对照组缺血心肌组织中有明显的血管新生[(16.2 ±5.6)/mm2,P<0.01,图4]。

图4 术后28 d对照组(A)和G-CSF干预组(B)缺血心肌组织中vWF染色和各组微血管计数(C)Fig.4 The vonWillebrand factor(v WF)-stained sections in control group(A)and G-CSF group(B),and the number of vWF-positive vessels in the ischemic areas(C)
3 讨 论
心脏作为终末分化器官不能再生的法则现在已经受到挑战。在特定条件下部分心肌细胞有可能重新进入细胞周期,并通过募集局部和循环中的干细胞来实现有限的再生。虽然这种有限的再生不足以对临床上急性心肌梗死和慢性充血性心力衰竭产生足够的代偿作用,但存在内源性的修复机制提示实现心脏修复并不是空想。基础研究已经证实,将干细胞或祖细胞移植到心脏能改善受损心脏的组织灌注和收缩功能,可能的机制包括干细胞与心肌细胞融合,横向分化为心肌细胞、血管细胞以及所谓的旁分泌作用。
临床研究所采用的细胞主要为可从自体获得的骨髓细胞(包含了不同的干细胞和祖细胞群,如造血干细胞、内皮祖细胞和骨髓间充质干细胞)和骨骼肌成肌细胞,移植途径包括经冠状动脉内输注、在体动员、直接注射入心室壁(经心外膜、经心内膜和经冠状静脉窦)。近年来,已有不少关于干细胞移植治疗缺血性心脏病的临床报道,虽然这些研究多为小样本、非随机对照研究,但却初步提示了这种方法应用于患者的可行性和安全性。
G-CSF是强有力的造血细胞因子,它能影响粒细胞的增殖、存活、成熟以及功能活性,并且能动员骨髓中的粒细胞、干细胞或前体细胞到血循环[6-7]。这种动员机制还未完全明确,但可能是通过结合到特异性的细胞表面受体即G-CSF受体而进行调节,从而引起后续黏附分子的消化。SDF-1及其受体CXCR-4可能起了关键作用[8]。动物实验证明了G-CSF动员干细胞改善心肌梗死后左室功能,促进血管生成,以及减轻心肌梗死后心室重塑[9-10]。ORLIC等[9]将重组鼠干细胞因子和重组人G-CSF注射到小鼠动员干细胞5 d,然后结扎冠状动脉,随后再应用干细胞因子和G-CSF 3 d,结果显示有新的心肌和血管形成,射血分数明显提高。近来也有实验结果显示,在兔心肌梗死再灌注模型应用G-CSF,结果发现左室射血分数提高,减低了心室重塑[11]。
本研究结果证实,应用G-CSF早期干预慢性心肌缺血模型兔,观察到G-CSF除能动员骨髓干细胞提高外周血CD34+细胞百分率外,还能促进CD34+细胞归巢于缺血心肌,促进血管新生,提高模型兔生存率。因此,慢性心肌缺血早期应用G-CSF可以提高生存率,其作用机制可能与骨髓干细胞动员和归巢以及新生血管生成有关。
[1]SILVESCU CI,SACKSTEIN R.G-CSF induces membrane expression of a myeloperoxidase glycovariant that operates as an E-selectin ligand on human myeloid cells[J].Proc Natl Acad Sci USA,2014,111(29):10696-10701.
[2]XUE J,DU G,SHI J,et al.Combined treatment with erythropoietin and granulocyte colony-stimulating factor enhances neovascularization and improves cardiac function after myocardial infarction[J].Chin Med J(Engl),2014,127(9):1677-1683.
[3]LAVIN B,GOMEZ M,PELLO OM,et al.Nitric oxide prevents aortic neointimal hyperplasia by controlling macrophage polarization[J].Arterioscler Thromb Vasc Biol,2014,34(8):1739-1746.
[4]MATSUMOTO S,IWATA H,SHIRAHASHI K,et al.Suppression of right ventricular hypertrophy after extensive pulmonary resection in rats by granulocyte colony-stimulating factor[J].J Surg Res,2010,162(2):153-159.
[5]ZHAO Q,SUN C,XU X,et al.CD34+cell mobilization and upregulation of myocardial cytokines in a rabbit model of myocardial ischemia[J].Int J Cardiol,2011,152(1):18-23.
[6]GARCIA NP,DE LEON EB,DA COSTA AG,et al.Kinetics of mesenchymal and hematopoietic stem cells mobilization by G-CSF and its impact on the cytokine microenvironment in primary cultures[J].Cell Immunol,2015,293(1):1-9.
[7]田婧,王雪晶,马耀华,等.rh G-CSF对缺氧SH-SY5Y细胞及大鼠缺血脑组织中LAMP-2a和HSC-70蛋白表达的影响[J].郑州大学学报:医学版,2013,48(4):481-484.
[8]TAVERNIER E,AANEI C,SOLLY F,et al.CXCR4:a new therapeutic target of the leukaemic cell?Role of the SDF-1/ CXCR4 axis in acute myeloid leukaemia[J].Bull Cancer,2014,101(6):593-604.
[9]ORLIC D,KAJSTURA J,CHIMENTI S,et al.Mobilized bone marrow cells repair the infarcted heart,improving function and survival[J].Proc Natl Acad Sci USA,2001,98(18):10344-10349.
[10]GONG Y,ZHAO Y,LI Y,et al.Plasminogen regulates cardiac repair after myocardial infarction through its noncanonical function in stem cell homing to the infarcted heart[J].J Am Coll Cardiol,2014,63(25 Pt A):2862-2872.
[11]SANGANALMATH SK,ABDEL-LATIF A,BOLLI R,et al. Hematopoietic cytokines for cardiac repair:mobilization of bone marrow cells and beyond[J].Basic Res Cardiol,2011,106(5):709-733.
(编辑 国 荣)
Protective effect of granulocyte-colony-stimulating factor against chronic myocardial ischemia in rabbits
ZHAO Qing-bin1,ZHOU Juan2,WU Yue2,TIAN Yu-ling2,LIU Zhi-quan2
(1.Department of Gerontology;2.Department of Cardiology,the First Affiliated Hospital of Xi’an Jiaotong University Health Science Center,Xi’an 710061,China)
ObjectiveTo investigate the protective effects and mechanisms of granulocyte-colony-stimulating factor(G-CSF)on a rabbit model of chronic myocardial ischemia.MethodsMyocardial ischemia models were created by partial ligation of the left anterior descending coronary artery in Japanese white male rabbits.Rabbits were subcutaneously injected with G-CSF(G-CSF group)or saline(control group)for 6 days after myocardial ischemia.The percentage of CD34-positive cells in the peripheral blood was evaluated by flow cytometry,and CD34-positive cells homing and v WF expression in the ischemic myocardium were determined by immunohistochemistry.ResultsRabbits in G-CSF group had a higher survival rate than those in control group(P<0.05).Immunohistochemistry of the ischemic myocardium showed that compared with control group,G-CSF group had increased homing of CD34-positive cells on day 7 post-surgery,and more vessels on day 28 post-surgery by anti-von Willebrand factor staining.In addition,we observed an increase in the percentage of CD34-positive cells in the peripheral blood in G-CSF group.ConclusionG-CSF produces an obvious protective effect against chronic myocardial ischemia in rabbits by increasing stem cell mobilization,homing to ischemic myocardium and accelerating neovascularization.
granulocyte-colony-stimulating factor(G-CSF);myocardial ischemia;neovascularization;CD34+
R541.4
A
10.7652/jdyxb201506004
2015-03-05
2015-05-26
国家自然科学基金资助项目(No.81200098);陕西省自然科学基金项目(No.2014K11-03-04-06)
Supported by the National Natural Science Foundation of China(No.81200098)and the Natural Science Foundation of Shaanxi Province(No.2014K11-03-04-06)
赵庆斌.E-mail:zhaoqingbin05@163.com
优先出版:http://w ww.cnki.net/kcms/detail/61.1399.R.20150928.1758.030.html(2015-09-28)

