西安市采暖季与非采暖季PM2.5染毒的人胚肺细胞基因差异表达研究
杨宇轩,闫思琪,衣颖杰,张 喆,聂雨晨,郭 坤,于 燕
(西安交通大学医学部,陕西西安 710061)
◇临床研究◇
西安市采暖季与非采暖季PM2.5染毒的人胚肺细胞基因差异表达研究
杨宇轩,闫思琪,衣颖杰,张 喆,聂雨晨,郭 坤,于 燕
(西安交通大学医学部,陕西西安 710061)
目的寻找与大气污染致病相关的相关基因,为阐明大气污染致病的生物学机制提供科学依据。方法采用m RNA斑点杂交鉴定技术,克隆经采暖季≥75μg/m3PM2.5与非采暖季<75μg/m3PM2.5染毒的WI-38人胚肺细胞,分析其间的基因表达差异。放免法测定炎性因子TNF-α、IL-2、IL-6和IL-8。结果与对照组比较,PM2.5>100μg/m L染毒24 h后,WI-38人胚肺细胞细胞因子TNF-α、IL-6和IL-8明显升高,IL-2明显减低(P<0.05)。不同浓度PM2.5处理的WI-38人胚肺细胞间差异表达的基因片段,可见48份基因样本在350 bp处出现清晰条带;该48份基因样本经斑点杂交后,Tester cDNA杂交的48个斑点中,41份可见黑褐色斑点,而同样样本与Driver cDNA杂交的该48份样本均未见明显显色。结论PM2.5能诱导WI-38人胚肺细胞产生炎性损伤,≥75μg/m3PM2.5染毒的WI-38人胚肺细胞存在明显的基因损伤。
PM2.5;WI-38人胚肺细胞;基因差异表达;斑点杂交;TNF-α;IL-2;IL-6;IL-8
KAY WORDS:PM2.5;WI-38 human embryo lung cell;differential expression of gene;dot blot hybridization; TNF-α;IL-2;IL-6;IL-8
西安市采暖季PM2.5污染浓度显著高于非采暖季;PM2.5的污染加剧是西安市居民心血管系统和呼吸系统疾病的死亡率升高的原因之一。随着我国大气污染的日趋严重,雾霾范围和程度日益加重,对PM2.5与疾病的发病率、死亡率关系研究,尤其是呼吸系统疾病及心血管疾病发病机制的研究越来越引起学者的关注[1-4]。资料显示,欧洲因大气细颗粒物每年可导致近30万人早死,降低平均寿命8.6月[5]。基于对PM2.5健康危害的认识,我国环境保护局(EPA)已经于2011年11月首次制定PM2.5的国家环境质量标准[6-7]。且PM2.5表面吸附多种有机多环芳烃类及重金属镍、镉、铬等,其可直接或间接作用于DNA,引起DNA损伤、断裂或DNA加合物形成,也可通过与细胞作用产生活性自由基间接作用于DNA,诱导DNA链断裂[8]。朱丽瑾等[9]选用抑制性消减杂交(suppressing subtractive hybridization,SSH)技术克隆了不同季节不同浓度PM2.5染毒的人胚肺细胞,并对其基因差异表达进行分析,提示大气污染致病性与相关基因关系密切,为本研究拟进一步阐明大气污染致病的生物学机制提供基因差异表达的依据。本实验选用mRNA斑点杂交鉴定技术,克隆经采暖季PM2.5浓度≥75μg/m3与非采暖季PM2.5浓度<75μg/m3染毒的人胚肺细胞间的基因差异表达分析,力图寻找与大气污染致病的相关基因,为阐明大气污染致病的生物学机制提供科学依据。
1 材料与方法
1.1 仪器与试剂颗粒物采样器(ST2120FT大流量分级采样器),人胚肺WI-38细胞株(中科院上海细胞所),消减杂交试剂盒(美国BD公司),热启动聚合酶链式反应法(PCR)试剂盒(德国Qiagen公司),PCR-Select Differential Screening Kit(美国BD公司),地高辛标记与检测试剂盒(德国Roche公司)。
1.2 PM2.5的布点与采样本项目组采用网格式布点,分别在西安市东(碑林区)、南(雁塔区)、西(莲湖区)、北(未央区)四个城区及一个对照区(长安区),采用直径80 mm的玻璃纤维滤膜,每次采样时间为24 h,按PM2.5采样说明书采集西安市大气中PM2.5样本。以上采样区域分别代表工业区混合区、交通繁忙区、对照区。共采集161 d(份),其中2012年采暖季119份,非采暖季123份,2013年采暖季121份,非采暖季244份。采样点周围无明显污染源,能较好地代表西安市大气PM2.5污染状况。采用ST2120FT大流量分级采样器,采样点集中于城市区域的主干道,工厂密集处,采样高度:呼吸带(距地面1.5米)。
1.3 颗粒物的制备将载有样品的玻璃纤维滤膜放入去离子水中,超声振荡10 min以洗脱颗粒物,真空冷冻干燥,称重。将载有颗粒物的滤膜剪裁成2 cm ×2 cm,浸入去离子蒸馏水中,超声振荡3次,每次20 min,洗脱颗粒物。震荡液经6层纱布过滤,滤液于4℃30 000 r/min,离心30 min,收集下层悬液低温冰箱保存备用。用PBS制成贮备液,高压灭菌,4℃保存,临用前超声悬浮混匀。临用前振荡使颗粒物充分混匀。
1.4 细胞培养WI-38人胚肺细胞由中科院上海细胞所细胞库提供。冻存的WI-38人胚肺细胞用含100 m L/L胎牛血清和10 g/L青链霉素双抗的DMEM培养液,于37℃、50 m L/L CO2条件下培养,细胞融合80%时用1.25 g/L胰蛋白酶消化,1∶3传代,用含100 m L/L胎牛血清和10 g/L青链霉素双抗的DMEM培养液,在37℃、50 m L/L CO2条件下传代培养至对数生长期用于实验。
1.5 细胞因子的测定WI-38人胚肺细胞培养条件同前,接种于24孔培养板上,24 h后染毒PM2.5,终质量浓度分别为0、25、50、100、200μg/m L,每个浓度设3个平行。培养24 h,取上清液,冷冻干燥。放射免疫法测定细胞因子TNF-α、IL-2、IL-6和IL-8。
1.6 细胞损伤模型的构建取对数生长期的WI-38人胚肺细胞,以1×105/mL的细胞悬液1mL,接种于24孔培养板,置37℃、50 mL/L CO2培养箱24 h,弃上清,用D-Hanks液洗3次,加入不含小牛血清、以终质量浓度为100μg/mL的采暖季≥75μg/m3样品与非采暖季<75μg/m3样本(中国大气环境PM2.5日平均最高允许质量浓度为75μg/m3)分别染毒,1次/周,24 h/次,共染毒8周。以采暖季≥75μg/m3PM2.5处理的WI-38人胚肺细胞为检测样本(Tester),以非采暖季<75μg/m3样本处理的WI-38细胞为驱赶样本(Driver)。
1.7 mRNA提取按照mRNA提取试剂盒说明书进行,提取物溶于20μL缓冲液中,所得总RNA的A260/280在1.8~2.1。
1.8 cDNA合成[9]以两种染毒WI-38人胚肺细胞mRNA各2μg为模板,反转录合成双链cDNA。把含有目的基因的cDNA称为测试(tester),把参考cDNA称为驱动(driver)。
1.9 mRNA斑点杂交鉴定[10]取1μL阳性菌液点于尼龙膜上,分别以等量5′端地高辛标记的TestercDNA和Driver-cDNA为探针进行斑点杂交,寡核苷酸5′端标记地高辛探针:5′-GGCGACTTTGTGTACATGTTCCCGTTTTACGGCTACCGG-3′。探针合成及5′端地高辛标记均由上海生工生物工程公司完成,其余操作按BD公司PCR-Select Differential Screening Kit说明书进行。
1.10 统计学方法采用SPSS17.0统计软件,两样本比较采用t检验,多个样本比较采用方差分析,根据方差齐性检验结果,方差齐性时选择LSD法,方差不齐时选择Tamhane’s T2法,α=0.05。
2 结 果
2.1 2013年PM2.5监测结果及其与2012年结果的比较采暖季PM2.5浓度均明显高于非采暖季(P<0.01);与2012年比较,2013年采暖季和非采暖季的PM2.5浓度均明显增高(P<0.05,表1)。
2.2 PM2.5对WI-38人胚肺细胞细胞因子的影响PM2.5在25~200μg/m L的质量浓度范围内,随着染毒浓度的增加,WI-38人胚肺细胞产生炎性因子TNF-α、IL-6和IL-8的明显升高,IL-2明显减低(P<0.05,表2)。

表1 2012~2013年采暖季与非采暖季PM2.5的变化情况Tab.1 PM2.5 changes in the heating and non-heating seasons between 2012 and 2013(μg/m3)
表2 PM2.5染毒WI-38人胚肺细胞24 h后对细胞因子的影响Tab.2 Effects on cytokines in WI-38 human embryo lung cells infected with PM2.5 after 24 h(n=3,)
表2 PM2.5染毒WI-38人胚肺细胞24 h后对细胞因子的影响Tab.2 Effects on cytokines in WI-38 human embryo lung cells infected with PM2.5 after 24 h(n=3,)
与对照组(PM2.5为0)相比,*P<0.05。
2.3 斑点杂交鉴定 选择该48份样本斑点杂交显色,结果可见,与Tester c DNA杂交的48个样品中,有41个显黑褐色斑点(图1A),而同样样本与Driver cDNA杂交的该48个样品均未见明显显色(图1B)。
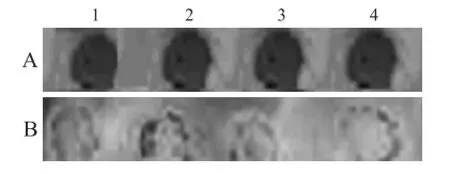
图1 差异片段与Tester cDNA(A)、Driver cDNA(B)斑点杂交Fig.1 Differential segments and Tester c DNA(A)and Driver cDNA(B)dot blot hybridization
3 讨 论
我国人群因呼吸系统疾病而死亡者占城市总死亡率的第3位,而肺癌是最常见的癌症死亡原因,并呈现逐年上升趋势[11]。已有资料显示,PM2.5不仅能在支气管、肺部沉积,还可以到达肺的深处,引起上呼吸道感染、支气管炎就诊人数的增加[12],且PM2.5可引起人的肺泡Ⅱ型上皮细胞MLE-12活性下降或死亡,其合成和分泌肺表面活性物质,补充和分化肺泡Ⅰ型上皮细胞的功能受损[13],而降低肺组织的气体交换功能,导致呼吸系统疾病死亡率上升。同时PM2.5能明显降低肺巨噬细胞的吞噬能力,导致其非特异性免疫功能降低,增加了人体肺部疾患发病的几率[14]。
已有研究显示,西安市大气环境污染中PM2.5较为严重[15]。本课题组前期研究结果亦显示,西安市PM2.5浓度在采暖季显著高于非采暖季,采暖季PM2.5超标率高达95.61%,且采暖季PM2.5吸附As、Pb明显加重[16-17]。同时本课题组又检索了西安市2004-01-01至2011-12-31的每日居民死亡人数(包括总死亡人数和疾病别死亡人数)与2004年至2012年西安市PM2.5浓度监测结果,对二者的相关性分析结果提示,COPD、下呼吸道感染、冠心病、中风的死亡率均呈上升趋势,且与PM2.5浓度存在一定的相关性。可见,西安市采暖季PM2.5污染浓度显著高于非采暖季;PM2.5的污染加剧是西安市居民心血管系统和呼吸系统疾病的死亡率升高的原因之一。
研究表明,PM2.5进入肺内后,作为化学激惹物,刺激肺细胞分泌大量的细胞因子,肿瘤坏死因子(TNF-α)、IL-6和IL-8分泌量增加[18],而IL-2分泌量降低[18],且随着浓度的增加,损伤作用明显增强。本研究的细胞因子测定结果一方面证实,PM2.5染毒剂量在25~200μg/m L的剂量范围内,可对WI-38人胚肺细胞产生明显的炎性损伤,并随着浓度的增加,炎性损伤作用亦明显增强。且在PM2.5>100 μg/mL染毒24 h后,WI-38人胚肺细胞炎性因子TNF-α、IL-6和IL-8的明显升高,IL-2明显减低(P<0.05);同时为进一步构建细胞损伤模型时,确定了PM2.5染毒的终质量浓度为100μg/m L。
为了进一步获得PM2.5对呼吸系统疾病影响的直接证据,本研究利用体外细胞培养,分别采用采暖季和非采暖季的PM2.5质量浓度≥75μg/m3及PM2.5<75μg/m3的洗脱液染毒,WI-38人胚肺细胞出现了差异表达的基因片段,且采暖季PM2.5≥75μg/m3染毒后呈明显高表达。经mRNA斑点杂交后,PM2.5≥75μg/m3的Tester cDNA样品杂交获得的48个样品中,有41个呈黑褐色斑点,而同样与PM2.5<75μg/m3Driver cDNA样本杂交的该48个样品,均未见明显色斑。
本研究结果提示,当大气中PM2.5≥75μg/m3时,对WI-38人胚肺细胞表现出更明显的基因损伤效应,而肺组织DNA的损伤,其原因可能是采暖季PM2.5进入肺组织后,由于其吸附的复杂组分,而表现出明显的炎性刺激作用;同时PM2.5本身体积小、穿透性强的特点,可直接引起IL-2表达下调,分泌量降低[19],而TNF-α、IL-6分泌量增加,在限制免疫应答的强度的同时,又引起过度的炎症刺激,进而导致人体呼吸系统功能的相关基因损害,从而提高人群呼吸系统的疾病的死亡率。
本研究还将PCR产物进行了全mRNA序列测定,测序结果将与GenBank的已知基因序列进行比对,以确定记录已知基因序列,登记未知基因序列。其结果总结完成后将在后续文章报道。
[1]徐晓程,陈仁杰,阚海东,等.我国大气污染相关统计生命价值的meta分析[J].中国卫生资源,2013,16(1):64-67.
[2]FENG J,YANG W.Effects of particulate air pollution on cardiovascular health:A population health risk assessment[J]. Plos One,2012,7(3):e33385.
[3]FOKIN MV.Algorithm for taking into account the average annual background of air pollution in the assessment of health risks[J].Gigiena i Sanitariya,2013,1:85-86.
[4]齐晓艳,周刚,卫峰,等.河南省医疗卫生机构室内PM2.5浓度监测[J].郑州大学学报:医学版,2013,48(6):825-828.
[5]CESARONI G,BADALONI C,GARIAZZO C,et al.Longterm exposure to urban air pollution and mortality in a cohort of more than a million adults in Rome[J].Environ Health Perspect,2013,121(3):324-331.
[6]郭新彪,魏红英.大气PM2.5对健康影响的研究进展[J].科学通报,2013,58(13):1171-1177.
[7]孟宪林,王晓红,姜曼曼.某煤炭资源型城市大气污染物健康风险评价[J].哈尔滨工业大学学报,2012,44(6):41-44.
[8]李朋昆,高知义,蒋蓉芳,等.细颗粒物暴露对人群DNA损伤的影响[J].环境与职业医学,2010,27(5):254-256.
[9]朱丽瑾,肖芸,钱亚玲,等.体外应用抑制性消减杂交技术克隆和筛选大气细颗粒物(PM2.5)污染相关基因[J].毒理学杂志,2008,22(5):362-364.
[10]邵雪君,吴士良.基于尼龙膜的斑点杂交条件的建立及优化[J].实用医技杂志,2006,13(4):509-511.
[11]庄丽颖,李丽萍.空气细颗粒物污染对健康影响的流行病学研究进展[J].汕头大学医学院学报,2012,25(4):233-235.
[12]MA Y,CHEN R,PAN G.Fine particulate air pollution and daily mortality in Shenyang,China[J].Sci Total Environ,2011,409(13):2473-2477.
[13]曲凡,丁文军,伊硕,等.PM2.5对肺泡Ⅱ型上皮细胞MLE-12的毒性研究[J].毒理学杂志,2010,24(1):19-23.
[14]黄雪莲,金昱,郭新彪,等.沙尘暴PM2.5、PM10对大鼠肺泡巨噬细胞吞噬功能的影响[J].卫生研究,2004,33(2):154-157.
[15]耿雅妮.西安市大气环境质量现状分析与评价[J].河南科学,2013,31(2):197-200.
[16]杨宇轩,闫思琪,聂雨晨,等.西安市大气中PM2.5污染状况及其人群健康危害防护策略[J].中国医药指南杂志,2013,11(19):472-474.
[17]杨宇轩,闫思琪,衣颖杰,等.西安市PM2.5污染现状及其对健康的影响[J].国外医学·医学地理分册,2014,35(1):13-17.
[18]贾玉巧,赵晓红,郭新彪.大气颗粒物PM10和PM2.5对人肺成纤维细胞及其炎性因子分泌的影响[J].环境与健康杂志,2011,28(3):206-208.
[19]乔果果,张志红,董洁,等.交通相关的PM2.5亚急性染毒对大鼠肺泡灌洗液和血清细胞因子水平的影响[J].毒理学杂志,2011,25(4):275-277.
(编辑 卓选鹏)
Genes'differential expression with PM2.5 exposure in human embryo lung cells between heating season and un-heating season in Xi'an City
YANG Yu-xuan,YAN Si-qi,YI Ying-jie,ZHANG Zhe,NIE Yu-chen,GUO Kun,YU Yan
(Xi’an Jiaotong University Health Science Center,Xi’an 710061,China)
ObjectiveTo investigate the pathogen-related genes of atmospheric polluting disease so as to clarify the biology mechanism and provide the scientific basis.MethodsBy using the technique of dot blot hybridization,we analyzed genes'dif ferential expression with cloning by exposure to≥75μg/m3PM2.5 in heating season and<75μg/m3PM2.5 in un-heating season in WI-38 human embryo lung cells.The levels of cytokines TNF-α,IL-2,IL-6 and IL-8 were determined by radio immunity assay.ResultsAfter 24h of treatment,compared with control group,more than 100μg/m L PM2.5 significantly increased TNF-α,IL-6 and IL-8 levels,and decreased IL-2 in WI-38 human embryo lung cells(P<0.05).The clear stripe was found in 350 bp in 48 gene samples with segment with differential expression of genes exposed to different concentrations of PM2.5 in WI-38 human embryo lung cells.Through the dot blot hybridization,black brown spots were found in 41 samples in Tester c DNA hybridization,and no similar spots were found in all of the same samples in Driver c DNA hybridization.ConclusionPM2.5 exposure may induce the inflammatory damage of WI-38 human embryo lung cells.Obvious genetic damage was observed in those cells exposed to≥75μg/m3PM2.5 in heating season.
R12
A
10.7652/jdyxb201506024
2014-04-10
2014-06-18
2013年国家级大学生创新训练项目(No.201310698066)
Supported by the fund for The National-level University Students’Innovation Training Project(No.201310698066)
于燕.E-mail:yuyan@mail.xjtu.edu.cn
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20150929.0834.002.html(2015-09-29)

