转化生长因子β1对牙周膜干细胞迁移、粘附及增殖的影响
王 爽,丰培勋,陈 悦,石建峰,曹 沛,张海娟
(1.西安交通大学医学部口腔医院正畸科及口腔医学研究中心,陕西西安 710004;2.武警陕西总队医院口腔科,陕西西安 710054)
◇基础研究◇
转化生长因子β1对牙周膜干细胞迁移、粘附及增殖的影响
王 爽1,丰培勋2,陈 悦1,石建峰1,曹 沛1,张海娟1
(1.西安交通大学医学部口腔医院正畸科及口腔医学研究中心,陕西西安 710004;2.武警陕西总队医院口腔科,陕西西安 710054)
目的研究转化生长因子β1(TGF-β1)对牙周膜干细胞(PDLSCs)的迁移、粘附和增殖的影响,初步探讨TGF-β1通过影响牙周组织干细胞参与牙周改建的机制。方法分离培养人PDLSCs,鉴定其多向分化潜能。用Transwell法检测TGF-β1对PDLSCs的迁移的影响。用粘附实验检测TGF-β1对PDLSCs粘附能力的影响。用MTT法和生长率法检测TGF-β1对PDLSCs增殖的影响。结果浓度为2.5 ng/m L以及10 ng/m L的TGF-β1可促进PDLSCs的迁移,而且此作用呈剂量效应关系。粘附实验结果显示,在分别作用2 h和4 h后,浓度为10 ng/m L的TGF-β1可促进PDLSCs的粘附。MTT法的结果证实了TGF-β1可促进PDLSCs的增殖,该作用呈剂量效应关系。再将细胞在含有或者不含有10 ng/m LTGF-β1的培养基中培养2、4、6 d,对细胞进行计数后发现TGF-β1显著促进PDLSCs的生长。结论TGF-β1可促进PDLSCs的迁移、粘附和增殖。推测TGF-β1可能通过诱导PDLSCs向牙周组织部位迁移并提高其粘附和增殖能力。
牙周膜干细胞;TGF-β1;迁移;粘附;增殖
错颌畸形是常见的颌面部发育畸形,常表现为牙齿排列不齐,牙齿前突,在我国儿童与青少年的患病率高达67.82%[1]。错颌畸形的治疗主要是通过各种矫治器对牙齿施加矫治力,引起牙周组织的改建,从而使牙齿移动到适当的位置达到矫治目的。此疗程一般长达2~3年。因此,提高骨改建效率,加快牙齿移动,显著缩短疗程是亟待解决的重要问题。正畸牙齿移动的生物学机制是机械应力作用下牙周组织的改建。在该领域的研究中发现正畸力可以影响TGF-β的表达。汪玲丽等[2]应用正畸大鼠模型研究发现,在正常的牙周组织中有TGF-β1表达,在正畸牙移动时其表达增加了,而且在张力侧高于压力侧。另一项研究也证明了TGF-β1在正畸大鼠模型的牙槽骨中高表达[3]。还有研究发现正畸力可显著增加正畸患者龈沟液中TGF-β1的含量[4]。这些研究均表明TGF-β1可能参与了正畸牙周改建,但其中的具体机制还不清楚。
牙周膜干细胞(periodontal ligament stem cell,PDLSCs)具有多向分化潜力及牙周再生能力[5],在牙周改建、再生中PDLSCs具有重要作用。有研究发现,TGF-β可以促进BMMSCs的迁移和归巢[6],但TGF-β对PDLSCs的迁移、粘附的影响还未见报道。根据以上发现,我们假设TGF-β可通过促进PDLSCs的迁移而参与牙周组织改建。故我们拟通过本研究探讨TGF-β1对PDLSCs迁移、粘附以及增殖的影响,从而深入了解TGF-β1参与牙周改建的机制。
1 材料与方法
1.1 牙周膜细胞的分离培养健康的因正畸原因拔除的前磨牙(n=3)和埋伏的第三恒牙(n=3)来自于西安交通大学医学部口腔医院颌面外科门诊。患者或其家长签署了知情同意书(本项目研究得到西安交通大学口腔医院伦理委员会批准)。在无菌条件下,小心分离离体牙牙根中1/3处牙周膜,酶消化,3 mg/mL的Ⅰ型胶原酶(Worthington Biochem,Freehold,NJ,USA)和4 mg/m L的胰蛋白酶(Worthington Biochem,Freehold,NJ,USA),37℃消化1 h,将牙周膜细胞植入10 cm培养皿,培养基为Dulbecco’s Modified Eagle’s Medium-Low Glucose(DMEM;Sigma-Aldrich,St.Louis,MO,USA),含100 m L/L胎牛血清(Biocell,Rancho Dominguez,CA,USA),10 m L/L antibiotics-antimycotics(Invitrogen),在37℃、50 m L/L CO2培养箱中培养。
1.2 FACS法鉴定分选PDLSCs用Tryple E消化细胞后,将细胞重悬在blocking buffer中(HBSS,20 mmol/L HEPES,10 m L/L人血清,10 m L/L BSA,50 mL/L FCS)在0℃放置20 min,用STRO-1 Ig M抗体(Developmental Studies Hybridoma Bank,Iowa City,IA,USA)(2μg/mL)孵育1 h。用流式细胞仪分选STRO-1+细胞,即PDLSCs,将细胞传代培养,用第2或者第3代细胞进行后续实验。
1.3 对细胞克隆形成率的测定400个STRO-1+细胞(PDLSCs)和400个STRO-1-(PDLCs)细胞于5 cm培养皿中,标准培养液中培养14 d。用100 mL/L甲醛(Fischer Scientific,Fair Lawn,NJ,USA)固定后用10 mg/L紫兰(Violet blue,Sigma-Aldrich,Milwaukee,WI,USA)染色。超过50个细胞聚成的细胞集落算作一个克隆。每个培养皿中的克隆数与植入的细胞数的比率即为克隆形成率(colony-forming efficiency,CFE)。
1.4 PDLSCs多向分化能力的检测取第2代PDLSCs以5×104/m L的细胞浓度,加入24孔板,孵育24 h,将培养液更换为成骨诱导液(含10 nmol/L地塞米松、0.05 mmol/L维生素C磷酸酯镁和10 mmol/Lβ2磷酸甘油钠的DMEM培养液)。成软骨诱导液(含10 ng/m L TGF-β3的DMEM培养液);成脂诱导液(含0.5μmol/L地塞米松,50 m L/L FBS,0.5μmol/L异丁基甲基黄嘌吟,50μmol/L消炎痛的DMEM培养液);倒置显微镜下观察,每3 d换液一次。21 d后,成骨诱导组采用冯库萨染色(von kossa)观察培养板内矿化形成情况。番红花精(Safranin)O染色观察软骨形成情况,油红‘O’染色观察脂滴形成情况。
1.5 Transwell法检测TGF-β1对细胞迁移能力的影响PDLSCs于实验前1 d以无血清培养液培养过夜。再取12孔板,孔内放置Transwell,以2×105/m L的浓度将细胞植入上室,下室加入含有或者不含TGF-β1的DMEM培养液,37℃培养10 h。对已经迁移穿过chamer孔、粘附在chamer底部的细胞固定后,DAPI染色,显微镜下计数。每组设阴性对照及阳性对照。
1.6 细胞粘附实验检测TGF-β1对细胞粘附能力的影响24孔细胞培养板,每孔加入2 m L含有TGF-β1的PBS,41℃静置16 h,PBS清洗3次。再加含30 m L/L BSA的PBS,室温下静置2 h。PDLSCs加入含有TGF-β1的培养基中,每孔放入30 000个细胞,37℃、50 m L/L CO2培养2 h和4 h。用PBS洗去未粘附细胞。收集粘附细胞,计数。
1.7 TGF-β1对细胞增殖影响的检测①MTT法。将PDLSCs以每孔4×104个的浓度种入96孔板,以不同浓度的TGF-β1(0、2、5、10 ng/m L)孵育48 h后检测。以5 mg/m L MTT的PBS溶液换去培养液,在37℃、50 m L/L CO2中孵育48 h。用570 nm波长读取A值。②细胞生长率检测。将PDLSCs以每孔5 000个的密度种在12孔培养板上,24 h后,细胞在无血清DMEM再培养24 h。然后在含有TGF-β1的培养基中,再培养2 d和4 d。消化细胞并进行细胞计数。
1.8 统计学分析采用SSPS 11.5统计软件,数据以平均值±标准差()表示,组间比较采用单因素方差分析(One-way ANOVA),组间两两比较采用LSD法或者Dunnett’s t法,检验水准α=0.05。当P<0.05为差异有统计学意义。
2 结 果
2.1 PDLSCs与PDLCs克隆形成率的比较PDLSCs为来源于牙周膜的成体干细胞,应具有干细胞特性,而干细胞的特性之一为有较强的自我更新复制能力。本研究用克隆形成率来检测分离培养的PDLSCs的自我更新复制能力。研究结果发现,培养14 d后,PDLSCs的CFE显著高于PDLCs(图1,P<0.05),证实本研究分离培养的细胞具有较好的干细胞特性。
2.2 PDLSCs多向分化能力的检测PDLSCs成骨向诱导分化后,冯库萨染色(von kossa)发现出现矿化结节;成脂诱导培养后,油红‘O’染色出现脂滴;成软骨诱导培养后番红花精‘O’染色呈阳性,证明PDLSC具备多向分化潜能,显示出良好的干细胞特性(图2)。
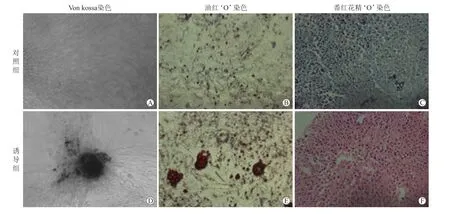
图2 PDLSC向成骨、成脂、成软骨方向诱导分化Fig.2 Osteogenic,adipogenic and chondrogenic differentiation of PDLSCs(×100)
2.3 TGF-β1对PDLSCs迁移能力的影响用Transwell细胞迁移实验观察不同浓度TGF-β1(0、2、5、10 ng/m L)对PDLSCs迁移的影响。在该实验中,将细胞放在培养小室的上层,在下室中加入含有TGF-β1的培养液,在实验结束时,以穿过滤膜的细胞数作为指标,评价细胞的迁移情况。本实验中使用的具体指标为每个视野里的已迁移的细胞数。实验结果表明,与对照组相比,2 ng/mL的TGF-β1就可促进PDLSCs的迁移,随着浓度的增加,TGF-β1对PDLSCs迁移的促进作用也增强,显示出明显的剂量效应关系(图3,P<0.05)。
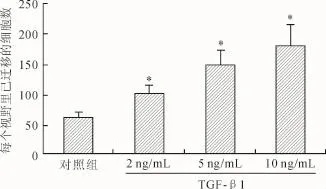
图3 TGF-β1对PDLSCs迁移能力的影响Fig.3 TGF-β1 induced the migration of PDLSCs
2.4 TGF-β1对PDLSCs粘附能力的影响结果显示,浓度为10 ng/m L的TGF-β1作用2 h后,与对照组相比,即可提高PDLSCs的粘附能力。而且,在作用4 h后,该粘附能力得到了进一步的提高,这种作用呈时间依赖式(图4,P<0.05)。
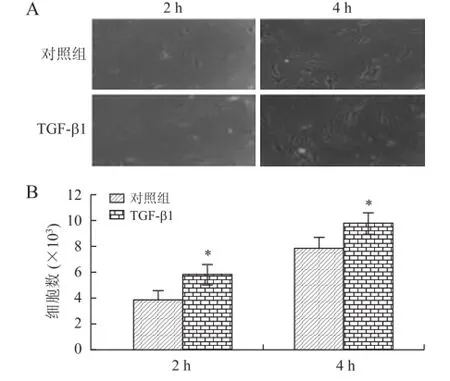
图4 TGF-β1对PDLSCs粘附能力的影响Fig.4 TGF-β1 promoted the attachment of PDLSCs
2.5 TGF-β1对PDLSCs增殖能力的影响用MTT法观察了TGF-β1对PDLSCs增殖的影响。结果表明,与对照组相比2 ng/m L的TGF-β1就可促进PDLSCs的增殖,而且随着浓度的增加,TGF-β1对PDLSCs增殖的促进作用也增强,显示出明显的剂量效应关系(图5A)。在此基础上,选用10 ng/m L的剂量,进行细胞生长实验。细胞在含有或者不含有TGF-β1的培养基中培养2、4、6 d后,测定细胞总数,结果显示TGF-β1显著促进PDLSCs的生长(P<0.05,图5B,表1)。
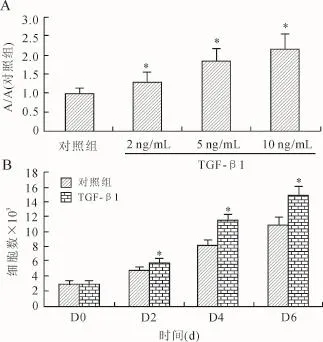
图5 TGF-β1对PDLSCs增殖能力的影响Fig.5 Effect of TGF-β1 on the proliferation of PDLSCs
表1 对照组和TGF-β1组细胞在不同培养时间的细胞数量Tab.1 The cell number in the control group and TGF-β1 groups at different durations of culture()

表1 对照组和TGF-β1组细胞在不同培养时间的细胞数量Tab.1 The cell number in the control group and TGF-β1 groups at different durations of culture()
与对照组比较,*P<0.05。
3 讨 论
TGF-β是骨基质中含量最高的细胞因子之一,可以调节成骨前体细胞的增殖和分化。TGF-β在分泌后以未活化的状态储存在细胞外基质中,在受到机械应力、组织损伤或者炎症刺激后,其作为一种分子感受器被活化和释放[7]。TGF-β有5个亚型,在人类组织细胞中仅发现有TGF-β1、TGF-β2、TGF-β3 3种亚型,其中TGF-β1发挥最主要的作用。TGF-β与应力引起的MSCs细胞增殖密切相关[8]。曹教授和他的团队[9]用不同的动物模型,通过体内和体外实验证实了在骨吸收部位释放的活化TGF-β1可诱导BMMSCs迁移至骨吸收部位,进行骨形成,完成骨重建。也有研究发现TGF-β可能与牙发育相关干细胞的分化、增殖相关。如TGF-β1是参与牙胚细胞分化及形态发生的重要调节因子[10],其在体外可促进根尖牙乳头干细胞增殖和分化[11],其在小鼠切牙间充质干细胞和上皮干细胞的相互调节方面发挥重要作用[12]。正畸力可上调局部组织的TGF-β,而且局部组织内干细胞数量增加[13]。总的来说,以上这些研究都发现TGF-β可以调节成体干细胞的增殖、分化、迁移和募集。但是,对牙周膜内的干细胞——PDLSCs的影响研究较少,对PDLSCs的迁移、增殖等的影响还未见报道。
PDLSCs是存在于牙周组织内的干细胞,具有多向分化潜力,其可分化为成纤维细胞、成骨细胞、成牙骨质细胞等参与牙周组织的改建和修复。PDLSCs在体内处于复杂的微环境中,受到各种细胞因子的作用。以往的研究发现TGF-β1参与牙周组织的改建,影响牙周相关细胞的增殖分化。如:TGF-β1可以诱导人牙周膜细胞骨架重排[14]。TGF-β1参与牙周膜成纤维细胞的细胞增殖,并且TGF-β1对人牙周膜成纤维细胞I型胶原的表达起促进作用[15]。但这些研究并未探讨TGF-β对PDLSCs的影响。本研究发现TGF-β1可促进PDLSCs的迁移、粘附和增殖,进一步阐明了TGF-β在牙周改建中的作用及其机制。
PDLSCs处于牙周膜内,其微环境有其特别之处。咀嚼时咀嚼力通过牙齿、牙周膜传导至牙槽骨,有助于维持正常的牙槽骨结构;在正畸治疗中,机械力学刺激可影响牙槽骨改建,这都提示力学刺激可影响颌骨及牙周组织的改建。已有较多研究着眼于机械应力在细胞和分子水平上对成骨细胞、破骨细胞功能状态及分化的影响及其机制。但在另一方面,机械应力也可能促进干细胞/前体细胞向局部迁移,从而影响局部的骨改建。有研究发现在体外应力可促进BMMSCs的迁移。如王军等[13]的研究发现,正畸牙移动中人牙周膜内间充质干细胞的数量明显增加,分布范围更广,提示力学刺激可影响间充质干细胞的分布及数量从而影响牙周组织改建。
可见PDLSCs既受到各种细胞因子的作用,同时又受到力的作用。在牙齿受正畸加力(或者咀嚼力)的条件下,牙槽骨内或者血管壁旁的干细胞同时受到力学因素(张应力或者压应力)和化学因素(TGF-β1)的作用,这两种因素可能通过不同的信号途径发挥作用,也可能通过相同的信号途径发挥作用,因为应力可以通过力学敏感型受体引起的一系列生化反应,从胞质侧膜上的分子传导至第二信使,激活蛋白激酶路径。
目前,应力、TGF-β诱导干细胞迁移的力学-化学因素耦合作用和其中的力学生物学机制未见报道。结合以往的研究和本研究的发现,我们推测TGF-βR可能是其共同的信号途径,但其涉及的下游信号分子还需要进一步的研究。
[1]傅民魁,张丁,王邦康,等.中国25 392名儿童与青少年错合畸形患病率的调查[J].中华口腔医学杂志,2002,37(5):371-373.
[2]汪玲丽,朱虹,梁傥.大鼠正畸牙移动过程中牙周组织内转化生长因子β1的变化[J].中华口腔医学杂志,1999,34(4):242-244.
[3]WANG L,LEE W,LEI DL,et al.Tissue responses in corticotomy-and osteotomy-assisted tooth movements in rats:histology and immunostaining[J].Am J Orthod Dentofacial Orthop,2009,136(6):770.e1-11.
[4]BARBIERI G,SOLANO P,ALARCON JA,et al.Biochemical markers of bone metabolism in gingival crevicular fluid during early orthodontic tooth movement[J].Angle Orthod,2012,83(1):63-69.
[5]BYOUNG MS,MASAKO M,GRONTHOSS,et al.Investigation of multipotent postanal stem cells from periodontal ligament[J].Lanct,2004,364(1429):149-155.
[6]TANG Y,WU X,LEI W,et al.TGF-beta1-induced migration of bone mesenchymal stem cells couples bone resorption with formation[J].Nat Med,2009,15(7):757-765.
[7]ANNES JP,MUNGER JS,RIFKIN DB.Making sense of latent TGFbeta activation[J].J Cell Sci,2003,116(Pt2):217-224.
[8]朱晓文,周昊,戚孟春,等.TGF-β/Smad信号通路在大鼠间充质干细胞机械牵张中的表达[J].口腔医学研究,2013,29(8):704-709.
[9]TANG Y,WU X,LEI W,et al.TGF-beta1-induced migration of bone mesenchymal stem cells couples bone resorption with formation[J].Nat Med,2009,15(7):757-565.
[10]程敏,苗雷英,刘玉艳,等.转化生长因子β1和E-钙黏附分子在人牙胚发育过程中的表达及意义[J].吉林大学学报:医学版,2007,33(6):1054-1058.
[11]丁芳,吴家媛,贾谦,等.TGF-β1对人根尖牙乳头干细胞增殖和分化的影响[J].牙体牙髓牙周病学杂志,2011,21(7):375-379.
[12]YANG G,ZHOU J,TANG Y,et al.Mesenchymal TGF-βsignaling orchestrates dental epithelial stem cell homeostasis through Wnt signaling[J].Stem Cells,2014,32(11):2939-2948.
[13]王军,雷蕾。赵志河.正畸力作用下人牙周膜间充质干细胞数量及分布的研究[J].医用生物力学,2009,24(Suppl):79-80.
[14]王莉,汪廷乐,欧学平,等.TGF-β1诱导人牙周膜细胞细胞骨架重排的机制[J].现代生物医学进展,2014,14(8):1415-1419.
[15]薛敏,于江波,张月,等.TGF-β1在应力介导的牙周膜成纤维细胞增殖中的作用及其机制[J].现代生物医学进展,2013,13(7):1240-1243.
(编辑 韩维栋)
Effects of TGF-β1 on the migration,adhesion and proliferation of periodontal ligament stem cells
WANG Shuang1,FENG Pei-xun2,CHEN Yue1,SHI Jian-feng1,CAO Pei1,ZHANG Hai-juan1
(1.Department of Orthodontics and Research Center of Stomatology,Stomatology Hospital of Xi’an Jiaotong University Health Science Center,Xi’an 710004;2.Department of Stomatology,Shaanxi Provincial Corps Hospital,Chinese People’s Armed Police Forces,Xi’an 710054,China)
ObjectiveTo evaluate the effects of transforming growth factorβ1(TGF-β1)on migration,adhesion and proliferation of periodontal ligament stem cells(PDLSCs)and explore the mechanisms of PDLSCsinduced periodontal remodeling.MethodsPDLSCs were isolated and identified from human teeth.The effect of TGF-β1 on migration of PDLSCs was evaluated using transwell migration assay.Cells attachment assay was used to test the effect of TGF-β1 on the adhesion of PDLSCs.In addition,the ef fect of TGF-β1 on the proliferation of PDLSCs was evaluated by MTT and cell growth rate assay.ResultsThe results showed that TGF-β1 induced the migration of PDLSCs in a dose-dependent manner,improved the adhesion and proliferation of PDLSCs.So we propose that TGF-β1 may promote periodium remodeling by inducing PDLSCs migration,following adhesion and proliferation in these areas.ConclusionThis study demonstrated for the first time that TGF-β1 increases the adhesion and migration of PDLSCs in vitro.The signal pathway is involved in the TGF-β1-induced migration of PDLSCs and the mechanical-chemical interaction during the orthodontic periodontal remodeling will be researched in our further studies.
periodontal ligament stem cell;TGF-β1;migration;adhesion;proliferation
R783
A
10.7652/jdyxb201506013
2015-02-08
2015-06-08
国家自然科学基金资助项目(No.81200822);中央高校基本科研业务费专项资金资助项目(No.2012jdhz27);陕西省自然科学基金资助项目(No.2012JQ4004)
Supported by the National Natural Science Foundation of China(No.81200822),the Fundamental Research Funds for the Central Universities(No.2012jdhz27)and the Natural Science Foundation of Shaanxi Province(No.2012JQ4004)
王爽.E-mail:shuangw98@163.com
优先出版:http://w ww.cnki.net/kcms/detail/61.1399.R.20150928.1454.004.html(2015-09-28)

