促红细胞生成素通过BMP/SMAD 通路对肾性贫血大鼠肾脏的保护作用及其机制
张 妍,李银岚,陈孟华
(宁夏医科大学第二附属医院肾脏内科,宁夏银川 750001)
◇基础研究◇
促红细胞生成素通过BMP/SMAD 通路对肾性贫血大鼠肾脏的保护作用及其机制
张 妍,李银岚,陈孟华
(宁夏医科大学第二附属医院肾脏内科,宁夏银川 750001)
目的探讨促红细胞生成素(EPO)对肾性贫血大鼠肾脏的保护作用及其可能的作用机制。方法将实验大鼠随机分为对照组(NC组,n=18)和实验组(n=72),采用腺嘌呤注射建立肾性贫血大鼠模型,再随机分为单纯贫血组(SA组)、铁剂+促红素组(IR+EPO组)、促红素组(EPO组)、铁剂组(IR组)。药物干预4周后,处死大鼠(心脏取血),自动化血液分析仪检测血清肌酐(Scr)、尿素氮(Bun)、血红蛋白(Hb)、血细胞比容(Hct);ELISA法检测铁调素(Hepcidin)。免疫组织化学染色法和Western blot法分别检测大鼠肾脏骨形态蛋白-6(BMP-6)、丝/苏氨酸激酶受体-1(SMAD-1)和SMAD-4的表达。结果①一般指标的比较:与SA组相比较,IR+EPO组和EPO组BUN、Scr显著降低(P<0.01);IR+EPO组和EPO组Hb、Hct显著升高(P<0.01)。②ELISA法检测示IR+EPO组和EPO组铁调素显著降低(P<0.01)。③病理学观察提示EPO可以减轻大鼠肾脏病理及功能改变。④免疫组织化学染色示各组大鼠肾小球细胞胞质和肾小管上皮细胞内均表达SMAD-4、SMAD-1、BMP-6。⑤Western blot进一步提示,与SA组相比,IR+EPO组和EPO组SMAD-4蛋白表达量显著下调(P<0.01),IR+EPO组和EPO组SMAD-1蛋白表达量下调(P<0.05),IR+EPO组和EPO组BMP-6蛋白表达量显著上调(P<0.01)。结论EPO通过BMP/SMAD传导通路,抑制铁调素的表达及分泌,纠正贫血,发挥肾脏保护作用。
肾性贫血;促红细胞生成素;BMP/SMAD;铁调素;骨形态蛋白-6(BMP-6)
肾脏纤维化是各种肾脏疾病进展到慢性肾脏衰竭的共同途径和主要病理基础。近年来研究发现,细胞因子在肾间质纤维化形成中发挥重要作用。促纤维化启动的同时,抗纤维化因素也同时启动。比如骨形成蛋白-6(bone morphogebetic proteins-6,BMP-6)及其下游调节基因SMADs、促红细胞生成素(erythropoietin,EPO)[1-3]。BMP亚家族是TGF-B细胞因子超家族的一员,其中至少有15种骨形态发生蛋白(BMP1-15)参与了细胞内信号转导,通过骨形态发生蛋白受体复合物(丝/苏氨酸激酶受体,RS/ TKs)激活SMAD蛋白家族磷酸化,引起SMAD蛋白在核内积聚,并激活转录活性,从而调节细胞增生、分化和凋亡,调控许多组织的发育和形态维持[1-5]。EPO作为一种主要由肾脏Ⅰ型间质细胞分泌的造血因子,目前临床上广泛应用于肾性贫血的治疗。随着人们对EPO生物学效应的深入研究,EPO除了造血作用外,还可显著延缓慢性肾脏病的进展[1-3]。目前,关于EPO如何发挥对慢性肾病保护作用的报道较少。本研究通过腺嘌呤(Adenine)诱导慢性肾衰竭肾性贫血模型,观察慢性肾衰竭状态下EPO干预后大鼠贫血改善状况,并探讨EPO通过BMP/SMAD传导通路发挥肾脏保护作用的可能机制。
1 材料与方法
1.1 主要试剂Adenine(南京凯基生物科技发展有限公司),EPO(沈阳三生制药有限责任公司),蔗糖铁注射液(南京恒生制药有限公司),Hepcidin酶联免疫分析试剂盒(美国R&D公司),兔抗鼠细胞信号转导分子Smad-1抗体、兔抗鼠细胞信号转导分子Smad-4抗体、兔抗鼠骨形态发生蛋白6抗体(美国Sigma),总蛋白提取试剂盒、BCA蛋白浓度测定试剂盒(美国Pierce)。其他试剂均为国产分析纯。
1.2 动物模型的建立及分组SD大鼠90只,45~50 d龄(雄性,200~250 g)。适应性喂养1周后,按随机数字表分为对照组(normal control,NC,n=18)和实验组(n=72)。正常对照组连续普通饲料喂养。实验组按300 mg/(kg·d)剂量,以腺嘌呤连续灌胃10 d;再改为250 mg/(kg·d)剂量腺嘌呤灌胃,连续11 d,总用药21 d。用药结束后采血(心脏取血)送检(宁夏医科大学实验室)血常规及肾功:①若血红蛋白持续低于90 g/L,且血肌酐高于130μmol/L;②实验组与正常组比较,血清尿素氮与血肌酐含量明显升高,血清血红蛋白明显降低。则判定为肾性贫血大鼠[6-7]。将72只造模成功的大鼠随机分为4组,即单纯贫血组(simple anemia group,SA组,n=18)、铁剂+促红素组(iron+erythropoietin,IR+EPO组,n =18)、促红素组(erythropoietin group,EPO组,n= 18)、铁剂组(iron group,IR组,n=18)。IR+EPO组和EPO组给予皮下注射EPO治疗(50 U/kg,3次/周);IR+EPO组和IR组采用灌胃法给药,每日硫酸亚铁溶液(2 mg/m L)2 m L灌胃。药物干预共4周后,处死大鼠,心脏取血收集血标本;部分肾组织于40 g/L多聚甲醛固定,石蜡包埋,制成切片用于免疫组织化学染色检测;部分肾组织保存于-70℃冰箱备用,待行Western blot检测。
1.3 一般指标的检测血红蛋白(Hb)、血细胞比容(Hct)采用自动化血液分析仪检测,血肌酐(Scr)、尿素氮(BUN)采用全自动生化检测。
1.4 酶联免疫分析法测定血清hepcidinhepcidin酶联免疫分析试剂盒购自美国R&D公司,严格按试剂盒说明书操作。
1.5 免疫组织化学染色法检测肾组织BMP-6、SMAD-1和SMAD-4的表达40 g/L多聚甲醛固定的肾脏组织常规脱水,石蜡包埋,切片,制成4μm厚的组织切片。经抗原修复,非离子表面活性剂(Triton)作用10 min;30 mL/L过氧化氢作用20 min;羊血清封闭30 min;滴加一抗(BMP-6、SMAD-1和SMAD-4),阴性对照用磷酸盐缓冲液(PBS)代替一抗,置湿盒中4℃过夜;PBS洗涤3次,滴加羊抗兔二抗,37℃孵育30 min;PBS洗涤3次,滴加链霉亲和素-生物素复合物(SABC)室温孵育20 min;PBS洗涤3次,滴加DAB显色、终止;PBS洗涤3次,苏木素轻度复染、脱水、透明,中性树胶封片。显微镜下观察,采用Min-Vnt图像分析系统在400倍显微镜下对免疫组织化学阳性结果进行分析。
1.6 Western blot检测肾组织BMP-6、SMAD-1和SMAD-4的表达将液氮冻存的肾脏组织提取总蛋白,称取50 mg于研钵研磨,加入细胞裂解液800 μL,在冰上裂解30 min,反复吹打使其充分裂解后,移入1.5 m L离心管,4℃12 000 r/min离心15 min,收集上清,测定总蛋白浓度。每组取50μg总蛋白上样,150 g/L十二烷基四乙酸二钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,运用电转移法将蛋白转移至PVDF膜。50 g/L脱脂奶粉室温封闭2 h,分别滴加一抗(BMP-6、SMAD-1和SMAD-4),4℃孵育过夜,洗膜后加辣根过氧化物酶(HRP)标记的羊抗兔二抗(1∶5 000),37℃孵育2 h,化学发光法ECL显影。实验重复3次。
1.7 统计学处理采用IPP6.0软件对Western blot结果特异性产物条带进行累计吸光度检测(IA),实验数据采用SPSS 11.5软件包进行统计学分析,计量资料数据以表示。多个样本均数间采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05认为差异有统计学意义。
2 结 果
2.1 一般检测指标的比较与NC组相比,SA组BUN、Scr显著升高(P<0.01);与SA组相比,IR+ EPO组和EPO组BUN、Scr显著降低(P<0.01);与IR组相比,IR+EPO组和EPO组BUN、Scr降低(P<0.05)。与NC相比,SA组的Hb、Hct显著降低(P<0.01);与SA组相比,IR+EPO组和EPO组Hb、Hct升高(P<0.01);与IR组相比,IR+EPO组和EPO组的Hb、Hct升高(P<0.05,表1)。
2.2 Hepcidin水平的比较与NC组相比,SA组Hepcidin显著升高(P<0.01);与SA组相比,IR+ EPO组和EPO组Hepcidin明显降低(P<0.01);与IR组相比,IR+EPO组和EPO组的Hepcidin升高(P<0.05,表1)。
表1 各组大鼠一般检测指标的比较Tab.1 Comparison of detection indexes among the groups(n=18,)

表1 各组大鼠一般检测指标的比较Tab.1 Comparison of detection indexes among the groups(n=18,)
与NC组比较,*P<0.01;与SA组比较,#P<0.01;与IR组比较,△P<0.05,▲P<0.05。
2.3 各组大鼠肾脏组织病理学改变模型组大鼠肾小球数量减少,部分肾小球萎缩;近曲小管上皮细胞可见灶状、片状坏死,内有淋巴细胞浸润,肾小管内可见颗粒管型,部分肾小管囊状扩张;间质纤维结缔组织增生较明显,血管未见异常。EPO组和IR+EPO组大鼠肾小管上皮细胞颗粒变性不明显,部分小管上皮细胞脱落,腔内有少量分泌物,小管代偿性扩张,严重者肾小管坏死,被增生的纤维结缔组织所替代。
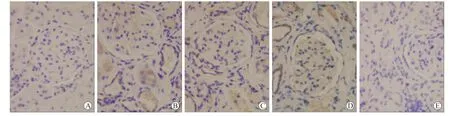
图1 各组大鼠肾脏SMAD-4蛋白的表达Fig.1 The expression of SMAD-4 protein in the rat kidney(immunohistochemical staining,×400)
2.4 各组大鼠肾组织SMAD-4的表达NC组表达低水平的SMAD-4。与NC组相比,SA组SMAD-4表达显著升高,差异有统计学意义(P<0.01)。与SA组相比,IR+EPO组和EPO组SMAD-4表达显著降低(P<0.01),IR组表达降低(P<0.05)。与IR组相比,IR+EPO组SMAD-4表达降低(P<0.05,图1)。
2.5 各组大鼠肾组织SMAD-1的表达NC组表达低水平的SMAD-1。与NC组相比,SA组SMAD-1表达升高,差异有统计学意义(P<0.01)。与SA组相比,IR+EPO组和EPO组SMAD-1表达轻度降低(P<0.05),IR组表达显著升高(P<0.01)。与IR组相比,IR+EPO组和EPO组SMAD-1表达降低(P<0.05,图2)。
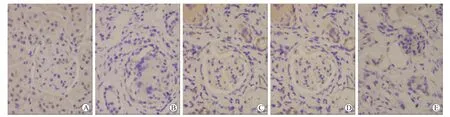
图2 各组大鼠肾脏SMAD-1蛋白的表达Fig.2 The expression of SMAD-1 protein in the rat kidney(immunohistochemical staining,×400)
2.6 各组大鼠肾组织BMP-6的表达NC组表达低水平的BMP-6。与NC组相比,SA组BMP-6表达升高,差异有统计学意义(P<0.01)。与SA组相比,IR +EPO组和EPO组BMP-6表达显著升高(P<0.01),IR组表达升高(P<0.05)。与IR组相比,IR+EPO组和EPO组BMP-6表达降低(P<0.05,图3)。
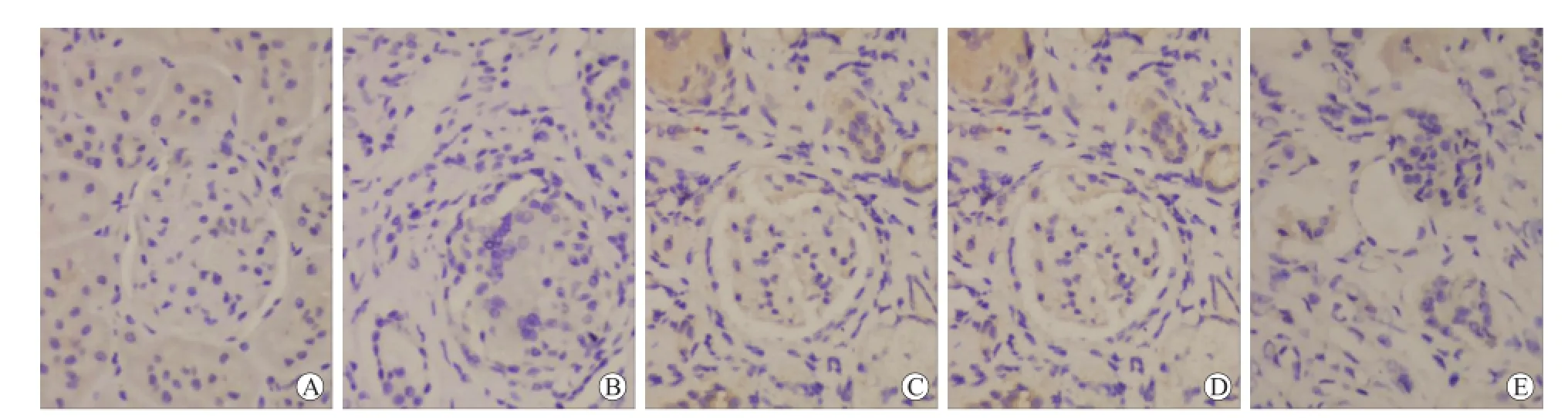
图3 各组大鼠肾脏BMP-6蛋白的表达Fig.3 The expression of BMP-6 protein in the rat kidney(immunohistochemical staining,×400)
2.7 EPO和铁剂对肾性贫血大鼠肾脏组织SMAD-4、SMAD-1、BMP-6蛋白相对含量的影响肾性贫血大鼠模型建立成功后,各组均可检测到SMAD-4、SMAD-1、BMP-6蛋白的表达(图4)。与SA组相比,IR+EPO组和EPO组SMAD-4表达显著下调(P<0.01),SMAD-1表达轻度下调(P<0.05),BMP-6表达显著上调(P<0.01)。IR组SMAD-4表达下调(P<0.05),IR组SMAD-1表达显著升高(P<0.01)。与IR组相比,IR+EPO组SMAD-4、SMAD-1表达下调(P<0.05)。
3 讨 论
近年研究表明,EPO受体具有促进血管生成、组织保护、抗炎等非造血作用,被认为是一种全身性保护因子[4],而Hepcidin作为调节机体铁稳态的一类抗菌多肽,受EPO的调节[8-10]。我们发现,治疗中给予EPO和静脉铁剂,不仅可纠正肾性贫血,而且可延缓肾功能恶化。分析原因:EPO可增强骨髓的造血功能,消耗大量铁元素,从而提高机体对铁的需求量,通过一系列下线蛋白的调节,最终抑制hepcidin的表达及分泌,以满足红细胞合成。所以EPO不仅是红细胞生成的刺激因子,而且是hepcidin的特异性的抑制剂[11-13]。对于其通过BMP/SMAD传导通路发挥肾脏保护作用的可能机制,目前报道较少。本研究从一个崭新的角度来探讨其保护作用的机制。
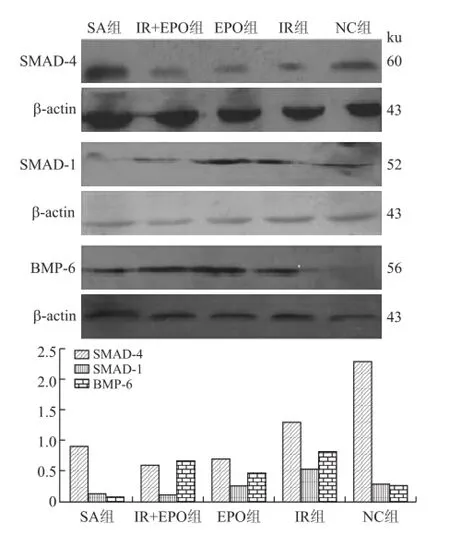
图4 各组大鼠肾脏SMAD-4、SMAD-1、BMP-6蛋白的表达水平Fig.4 The expression level of rat renal SMAD-4,SMAD-1,and BMP-6 protein(Western blot)
研究发现,SMAD-1、SMAD-4和BMP-6在肾性贫血大鼠肾小球和肾小管上皮细胞内均有表达。给予EPO和静脉铁剂或EPO治疗后,SMAD-1、SMAD-4表达下调,铁调素沉积减少。考虑其机制可能为:BMP6首先与两分子BMPⅡ型受体(BM-PR-Ⅱ)结合,引起BMPⅠ型受体(BMPR-Ⅰ)磷酸化,然后BMPR-Ⅰ(BMPR-IA和BMPR-IB)与两分子BMPR-Ⅱ结合成高亲和力的异四聚体,成为丝氨酸/酪氨酸激酶的受体,激活的受体复合物可进一步磷酸化SMAD-1、SMAD-5及SMAD-8蛋白,形成SMAD1/5/8复合物。该复合物在SMAD4介导下移位到细胞核,与铁调素基因的调控序列结合,促进铁调素转录[14-17]。BMP-6作为关键的铁调素的内源调节子,调节铁调素的表达和机体铁代谢,而当体内EPO和铁负荷增多时,必然会导致以上调控途径受阻,阻碍铁调素转录。
在本研究中,与NC组相比,SA组SMAD-1、SMAD-4表达显著增高,说明SMAD-1、SMAD-4促进肾脏纤维化的形成。其机制可能为:SMADs蛋白是TGF-β(transfonning growth factor-β)超家族信号从受体到细胞的细胞内转导分子,在TGF-β/SMADs通路的信号传导过程中,SMAD2/3磷酸化为β-SMAD2/3后,再与SMAD4形成活性的转录复合物进入核内,调节相应的靶基因转录,进而促进纤维化及疤痕硬化的形成。
细胞因子在肾间质纤维化发展过程中起着重要作用,它们通过与靶细胞膜上的受体相结合通过各自的传导通路,将指令传到靶基因产生生物学效应[18]。近几年,抗肾间质纤维化因子己成为新的研究热点,其中最主要的是BMP-6。通过本研究我们发现,与NC组相比,SA组BMP-6表达显著升高;而再给予EPO和静脉铁剂或EPO治疗后,IR+EPO组和EPO组BMP-6表达显著升高。说明BMP-6可感受铁的变化,考虑主要是通过铁调素调节铁代谢,即当循环铁增加时,BMP6表达升高,与BMPR、HJV、SMAD形成复合体,通过BMP/SMAD途径上调铁调素,最终使循环铁降低。当循环铁降低时,BMP6表达降低,SMAD/BMP途径受到抑制,铁调素分泌减少,循环铁恢复到正常。此外,BMP-6与肾脏纤维化关系密切,是一个重要的抑制肾纤维化的细胞因子。研究证实,肾脏损伤时肾组织中BMP-6明显下降,而给予EPO治疗后能减轻肾损伤的发生和发展,保护肾功能[19-21]。
总之,本研究证实大鼠肾脏表达SMAD-1、SMAD-4和BMP-6,EPO可通过SMAD/BMP传导通路,最终抑制hepcidin的表达及分泌,以纠正贫血,发挥肾脏保护作用。通过此项研究增加了我们对于SMAD/BMP传导通路的认识,同时也为未来慢性肾功能衰竭并肾性贫血的防治提供了新的思路。
[1]TEIXEIRA AM,GARRIDO P,SANTOS P,et al.Recombinant human erythropoietin treatment protects the cardio-renal axis in a model of moderate chronic renal failure[J].Ren Fail,2010,32(9):1073-1080.
[2]ZHANG F,XING J,LIOU AK,et al.Enhanced delivery of erythropoietin across the blood-brain barrier for neuroprotection against ischbemic neuronal injury[J].Transl Stroke Res,2010,1:113-121.
[3]WILLEM G,GERTRUDEJ,PETRA J,et al.Renoprotective capacities of non-erythropoietic EPO derivative,ARA290,following renal ischemia/reperfusion injury[J].Transl Med,2013,11:289-293.
[4]党建中,贾汝汉,涂亚芳,等.红细胞生成素对糖尿病大鼠肾脏保护作用的机制[J].中华肾脏病杂志,2011,8:597-601.
[5]FUNG E,NEMET E.Manipulation of the hepcidin pathway for therapeutic purposes[J].Bibl Haematol,2013,98(11):1667-1676.
[6]刘永学,魏汉东,吴祖泽,等.腺嘌呤诱发大鼠肾性贫血模型的特点及鉴定[J].中华肾脏病杂志,1998,2:53-54.
[7]董志刚,马晓燕,姚春雷,等.温肾益精降浊法方药治疗腺嘌呤至大鼠肾性贫血的实验研究[J].中国中医药科技,2010,4:302-304.
[8]CAMASCHELLA C.Iron and hepcidin:a story of recycling and balance[J].Hematol Am Soc Hematol Educ Program,2013,1(1):1-8.
[9]MERCADEL L,METZGER M,HAYMANN J,et al.The relation of hepcidin to iron disorders,inflammation and hemoglobin in chronic kidney disease[J].Public Libr Sci,2014,(9)6:1-7.
[10]KFW M.Hepatic iron overload and hepatocellular carcinoma[J].Liver Cancer,2014,3(1):31-40.
[11]LIU Q,DAVIDOFF O,NISS K,et al.Hypoxia-inducible factor regulates hepcidin via erythropoietin-induced erythropoiesis[J].J Clin Invest,2012,122(12):4635-4644.
[12]CHANG C,CHIU P,CHEN H,et al.Simvastatin downregulates the expression of hepcidin and erythropoietin in Hep G2 cells[J].Hemodial Int,2013,17(1):116-121.
[13]LAINE F,LAVIOLLE B,ROPERT M,et al.Early effects of erythropoietin on serum hepcidin and serum iron bioavailability in healthy volunteers[J].Eur J Appl Physiol,2012,112(4):1391-1397.
[14]CASANOVAS G,MLECZKO-SANECKA K,ALTAMURA S,et al.Bone morphogenetic protein(BMP)-responsive elements located in the proximal and distal hepcidin promoter are critical for its response to HJV/BMP/SMAD[J].J Mol Med(Berl),2009,87(5):471-480.
[15]CORRADINI E,ROZIER M,MEYNARD D,et al.Iron regulation of hepcidin despite attenuated Smad1,5,8 signaling in mice without transferrin receptor 2 or Hfe[J].Gastroenterology,2011,141(5):1907-1914.
[16]MAYEUR C,LEYTON P,KOLODZIEJ S,et al.BMP typeⅡreceptors have redundant rolesa in the regulation of hepatic hepcidin gene expression and iron metabolism[J].Blood,2014,124(13):2116-2123.
[17]ZHANG Y,CHENG Y,WANG N,et al.The action of JAK,SMAD and ERK signal pathways on hepcidin suppression by polysaccharides from Angelica sinensis in rats with iron deficiency anemia[J].Food Funct,2014,5(7):1381-1388.
[18]ZENG J,DOU Y,GUO J,et al.Paeoniflorin of Paeonia lactiflora prevents renal interstitial fibrosis induced by unilateral ureteral obstruction in mice[J].Phytomedicine,2013,20(8-9):753-759.
[19]KANAMORI Y,MURAKAMI M,MATSUI T,et al.The regulation of hepcidin expression by serum treatment:Requirements of the BMP response element and STAT-and AP-1-binding sites[J].Gene,2014,551(2):119-126.
[20]WU X,WANG Y,WU Q,et al.HFE interacts with the BMP type I receptor ALK3 to regulate hepcidin expression[J].Blood,2014,124(8):1335-1343.
[21]WU X,YUNG L,CHENG W,et al.Hepcidin regulation by BMP signaling in macrophages is lipopolysaccharide dependent[J].Plos One,2012,7(9):44622-44628.
(编辑 卓选鹏)
Renoprotective action by erythropoietin via BMP/SMAD signaling pathway in renal anemia in rats and its mechanism
ZHANG Yan,LI Yin-lan,CHEN Meng-hua
(Department of Nephrology,the Second Affiliated Hospital of Ningxia Medical University,Yinchuan 750001,China)
ObjectiveTo investigate the protective effect of erythropoietin(EPO)on the kidney of renal anemia rats and further explore the renoprotective action and possible mechanisms.MethodsA total of 90 SD rats were randomly divided into 5 groups:normal control rats(NC),simple anemia group(SA),iron+EPO group(IR +EPO),erythropoietin group(EPO),and iron group(IR)with 18 in each.The rats were sacrificed after 4 weeks' treatment with intragastrically-injected adenine.Serum creatinine(Scr),blood urea nitrogen(Bun),hemoglobin(Hb),hematocrit(Hct),and hepcidin were measured with automated hematology analyzer.The expressions of bone morphogenetic protein-6(BMP-6),a serine/threonine kinase receptor-1(SMAD-1)and serine/threonine kinase receptor-4(SMAD-4)in the kidney were detected by immunohistochemistry and Western blot.Results①The results of general indicators:BUN and Scr in IR+EPO group and EPO group were lower than those in SA group(P<0.01).Hb and Hct in IR+EPO group and EPO group were increased significantly compared with those in SA group(P<0.01).Hepcidin was significantly increased in simple anemia group(P<0.01).②ELISA results showed that Hepcidin was lower in IR+EPO group and EPO group than in SA group(P<0.01).③The results of pathological observation indicated that EPO could reduce rat renal pathology and function.④Immunohistochemistryrevealed that SMAD-4,SMAD-1 and BMP-6 were expressed in the rat glomerular cells and renal tubular epithelial cells.⑤Western blot further indicated that the expression of SMAD-4 was significantly decreased in IR+EPO group and EPO group(P<0.01).The expression of SMAD-1 in IR+EPO group and EPO group was decreased(P<0.05)while that of BMP-6 was elevated in IR+EPO group and EPO group(P<0.01).ConclusionThe expression and secretion of hepcidin were inhibited by EPO via the BMP/SMAD pathway,which further corrects anemia and exerts a renal protective effect.
renal anemia;erythropoietin;BMP/SMAD;hepcidin;BMP-6
R556
A
10.7652/jdyxb201506010
2014-12-02
2015-03-29
宁夏自然科学基金资助项目(No.NZ13202);宁夏医科大学科学研究基金资助项目(No.XM2012036)
Supported by the Natural Science Foundation of Ningxia(No.NZ13202)and Ningxia University Scientific Research Foundation(No.XM2012036)
张妍.E-mail:momoxiyu@163.com
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20150929.0848.006.html(2015-09-29)
——忌食

